茶蚕大陆种群性信息素鉴定与虫口监测应用
崔少伟,赵冬香,张家侠,商建农,蔡晓明,李兆群,边磊,修春丽,付楠霞,陈宗懋,罗宗秀*
茶蚕大陆种群性信息素鉴定与虫口监测应用
崔少伟1,赵冬香2,张家侠3,商建农4,蔡晓明1,李兆群1,边磊1,修春丽1,付楠霞1,陈宗懋1,罗宗秀1*
1. 中国农业科学院茶叶研究所,浙江 杭州 310008;2. 中国热带农业科学院环境与植物保护研究所,海南 海口 571101;3. 安徽省农业科学院茶叶研究所,安徽 黄山 245000;4. 杭州市西湖区农业技术推广服务中心,浙江 杭州 310013
茶蚕(Walker)是我国一种重要的茶树食叶害虫,严重时其幼虫可将整株茶树的叶片取食殆尽,造成极大危害。本研究对我国茶蚕大陆种群性信息素进行了鉴定,利用正己烷浸提法对求偶高峰期的茶蚕雌虫性信息素进行了提取,利用气相色谱-触角电位联用仪(GC-EAD)筛选性信息素提取物中的活性成分,运用气相色谱-质谱联用仪(GC-MS)对活性成分进行分析,采用触角电位技术(EAG)测试了性信息素成分的电生理活性,并通过田间诱捕试验筛选出性信息素最佳剂量,最后利用性信息素对海南五指山地区的茶蚕种群进行了监测。GC-EAD结果显示,茶蚕性信息素提取物中只有1种成分可引起雄虫的触角电位反应。GC-MS分析结果初步确定该活性成分为顺11,顺14-十八碳醛(11,14-18Ald)。EAG测试和田间引诱试验验证了性信息素鉴定结果,田间诱捕数据显示不同剂量的性信息素在田间的引诱效果不同,当剂量为0.9 mg时,田间引诱效果最佳。虫口监测结果表明,茶蚕性信息素是一种理想的虫口监测方法,利用该方法明确海南五指山地区5—10月共有两代茶蚕,成虫高峰期为6月17日和8月27日。本研究结果为我国茶叶主产区利用性信息素进行诱杀防治或虫口监测提供了理论依据。
茶蚕;性信息素;鉴定;虫口监测
茶蚕(Walker),属鳞翅目(Lepidoptera)蚕蛾科(Bombycidae)茶蚕蛾属(Andraca),是一种重要的茶树食叶害虫,主要以其幼虫聚集咀食茶树叶片,严重时可将整株茶树上的叶片取食殆尽,不仅影响当年产量,而且会导致树势衰退,几年内难以恢复,造成极大危害[1-2]。茶蚕分布广泛,国外分布于日本、印度、马来西亚、越南、印度尼西亚等国[3],我国分布于台湾、江西、安徽、福建、浙江、江苏、湖北、四川、海南、广东、广西、云南等地[4-5]。目前我国茶园常规防治茶蚕的效果并不十分理想,如农业防治、人工捕杀、物理防治均需要大量的人力、物力等,成本相对较高;化学农药则对有益昆虫、鱼虾等毒性较大;而生物防治见效慢,效果略差,难以推广。因此,探寻新的防治措施迫在眉睫。
昆虫性信息素是由昆虫某一性别个体分泌于体外,能被同种异性个体所接受,并引起异性个体产生一定的行为和生理反应(如觅偶、定向求偶、交配等)的微量化学物质。昆虫性信息素的研究已从最初的物质鉴定,发展到性信息素的定向合成、嗅觉感受机制以及田间应用(虫情监测、大量诱捕、迷向干扰)的全方面研究[6-8]。因为昆虫性信息素具有生物活性高、使用简便、专一性强等特点,利用性信息素作为害虫防治的新技术具有广阔的前景[9]。Ho等[10]曾对我国台湾地区茶蚕种群的性信息素进行了初步研究,在性腺提取物中发现了4种活性物质,初步明确其中11,14-18Ald为主要有效成分。有研究表明,远距离或特殊地理条件等因素会造成同种不同地理种群昆虫性信息素成分、比例或剂量存在差异[11-12]。考虑到茶蚕大陆种群和台湾种群相隔台湾海峡,性信息素可能存在一定差异,为精准指导我国茶叶主产区利用性信息素防治茶蚕,本研究对大陆茶蚕种群的性信息素进行了分离与鉴定,并利用其性信息素进行了田间诱捕与虫口监测,相关结果对今后茶叶生产中的茶蚕防控具有一定的指导意义。
1 材料与方法
1.1 试验材料
1.1.1 供试昆虫
试验所用茶蚕于2018年10月16日采自安徽省岳西县莲云乡莲塘村茶园(30.90°N,116.7°E),当地温度为8~20℃。将茶蚕幼虫带回实验室饲养在茶枝上,养虫室条件为:温度(26±1)℃,相对湿度(70±5)%,光周期L∶D=16∶8。幼虫饲养至化蛹,将蛹分辨雌雄后分别放置在不同的养虫笼(50 cm×50 cm×50 cm)内等待羽化。羽化后成虫饲喂10%的蜂蜜水,其中雌蛾用于提取性信息素,雄蛾用于性信息素的相关活性测定。
1.1.2 仪器与材料
气相色谱-触角电位联用仪(GC-EAD):气相色谱(美国Agilent Technologies公司,7890A)串联触角电位仪(德国Syntech公司);气相色谱-质谱联用仪(GC-MS,美国Agilent Technologies公司,7890A气相色谱串联5977B质谱);DB-23毛细色谱柱(0.25 mm×30 m,0.25 μm,美国Agilent Technologies公司);氮吹仪(Handiness Technologies公司);船形诱捕器(杭州中茶技术服务有限公司);缓释橡胶塞(白色,口径8 mm,美国Sigma Aldrich公司);样品瓶(1.5 mL进样瓶,美国Agilent Technologies公司);11,14-18Ald(95%纯度,杭州泽泉生物科技有限公司)。
1.2 试验方法
1.2.1 茶蚕性信息素的提取
茶蚕性信息素提取方法参考罗宗秀等[13]的灰茶尺蠖性信息素提取方法。茶蚕羽化第二天,置于暗周期4 h后,选择求偶状态下的处女雌蛾,用镊子轻轻挤压雌蛾腹部,待其性腺露出后,自第8腹节用眼科手术剪剪下。剪下后的腹部末端放入装有150 μL正己烷的样品瓶浸提15 min,粗提物用无水硫酸钠脱水,并用氮吹浓缩后密封置于冰箱中(–20℃)保存备用。
1.2.2 茶蚕性信息素提取物的GC-EAD分析
GC-EAD装配DB-23毛细色谱柱(30 m×250 μm,ID:0.25 μm)。出口端1∶3分流,1/4进入FID氢火焰离子检测器,3/4经过加热套流出GC,刺激EAD电极上的触角。GC载气为He,不分流进样。升温程序为:起始温度100℃,保持2 min,以5℃·min-1的升温速度升至250℃后,保持10 min。GC-EAD分析时,选择羽化第2天的茶蚕雄虫,用刀片将其触角自基部切下,端部切除少许,用内含0.8%NaCl生理盐水的玻璃电极将触角连接于EAD电极两端。进样1 μL性信息素提取物,计算机记录下分析数据,以此筛选出性信息素提取物中的活性成分。
1.2.3 茶蚕性信息素活性成分的GC-MS分析
茶蚕性信息素活性成分进行GC-MS分析时,GC-MS中GC的升温程序、色谱柱型号与GC-EAD分析时完全一致,载气为He。MS电离方式EI,电离能量为70 eV,离子源发生器温度为250℃,质量扫描范围m/z为40~400。分析时性信息素提取物的进样量为1 μL。结合GC-EAD分析结果定位候选化合物色谱峰,根据蛾类性信息素特征离子进行初步定性分析,再对比标准品验证,11,14-18Ald的质谱离子峰m/z为41、55、67(基峰)、81、95、109、123、133、151、264(M+)。
1.2.4 茶蚕性信息素活性组分EAG测定
EAG测定中,触角连接方法同GC-EAD测试,为保证测试期间触角具有良好的活性,气流通过活性炭过滤后再通过加湿瓶,持续气流流量为800 mL·min-1,瞬时刺激气流流量为3 000 mL·min-1。味源采用缓释橡胶塞分别添加0.3、0.6、0.9、1.2 mg等4个剂量的性信息素正己烷溶液,空白诱芯加等量正己烷为对照。测试时,将装有味源的巴斯德管末端与气流控制装置连接。待基线平稳时予以刺激,刺激时间设置为0.5 s,刺激间隔时间为1 min,以保证触角感受器的感觉功能完全恢复。每根触角先测定对照味源,再由低剂量到高剂量测试性信息素味源。以待测化合物与对照样品的反应差值作为待测样品的反应值。每个待测样品为1个处理,每个处理重复10次。
1.2.5 不同剂量茶蚕性信息素田间诱捕试验
不同剂量茶蚕性信息素田间诱捕试验,2019年在安徽省岳西县陈瑶湖镇龙王咀村茶园(30.95°N,116.21°E)进行,2020年在海南省五指山市茶园(18.88°N,109.67°E)进行。试验所用人工合成性信息素11,14-18Ald溶解于正己烷。将性信息素正己烷溶液加入缓释橡胶塞中,形成0.3、0.6、0.9 mg等3种剂量的性信息素诱芯,空白对照为添加正己烷的橡胶塞。性信息素橡胶塞置于船形诱捕器中,每个处理4次重复。船形诱捕器棋盘式随机布置于茶蚕发生的茶园,诱捕器高于茶树0.3 m,间隔15 m。2019年安徽省岳西县田间诱捕试验每3 d调查1次,共计5次;2020年海南省五指山市田间诱捕试验每3 d调查1次,共计10次。
1.2.6 虫口监测试验
虫口监测试验在海南省五指山市茶园进行,茶园中茶树高度为1.1 m。将滴加性信息素化合物的橡胶塞置于船型诱捕器中,共悬挂4个诱捕器于茶蚕发生的茶园,每个诱捕器高1.4 m,间隔50 m。每10 d调查1次,并更换粘虫板,统计5月—10月的成虫虫口发生情况。
1.3 数据分析
GC-EAD数据采用Syntech公司GCEAD-2014版本软件分析;GC-MS数据采用Agilent Technologies公司MassHunter Qualitative Analysis Navigator B.08.00版本软件分析;EAG数据采用Syntech公司EAG-Pro版本软件分析,不同剂量性信息素处理下雄虫EAG反应采用IBM公司SPSS Statistics 21版本软件单因素方差SNK分析;田间诱捕调查数据采用SPSS单因素方差分析,数据通过lg(+1)转换后进行Tukey’s-b分析。
2 结果与分析
2.1 茶蚕性信息素鉴定结果
如图1所示,茶蚕性信息素提取物GC-EAD分析结果显示,采用正己烷浸提法提取的性信息素粗提物中有1个活性成分可以引起雄蛾触角电生理反应,其保留时间为21.41 min。
与GC-EAD相同色谱条件下对性信息素提取物进行GC-MS分析,得到了总离子流色谱图(图2),根据出峰顺序、相对保留时间,以及鳞翅目性信息素特征离子锁定一个活性成分色谱峰,活性成分的保留时间为23.40 min。
如图3所示,活性成分的质谱离子峰m/z 41、55、67、81、95、109、123、133、151、264,通过与标准品的保留时间、质谱信息对比,最终确定活性成分为11,14-18Ald。
2.2 茶蚕性信息素活性组分EAG测定结果
由图4可知,茶蚕雄虫对性信息素11,14-18Ald具有明显的电生理反应,性信息素剂量对雄虫的触角电位反应值具有显著影响。0.3 mg处理的EAG反应值为(1.34±0.20)mV,随着性信息素剂量的增加,茶蚕雄虫的触角电位反应值增大,当测试剂量浓度升至0.9 mg时,EAG反应值达到(2.59±0.33)mV,显著高于0.3 mg处理(=3.275,=3,<0.05),当剂量进一步增加到1.2 mg时,EAG反应值与0.9 mg处理近似,无显著差异(=3.275,=3,>0.05)(图4)。

图1 茶蚕性信息素粗提物GC-EAD图

图2 茶蚕性信息素粗提物总离子流色谱图
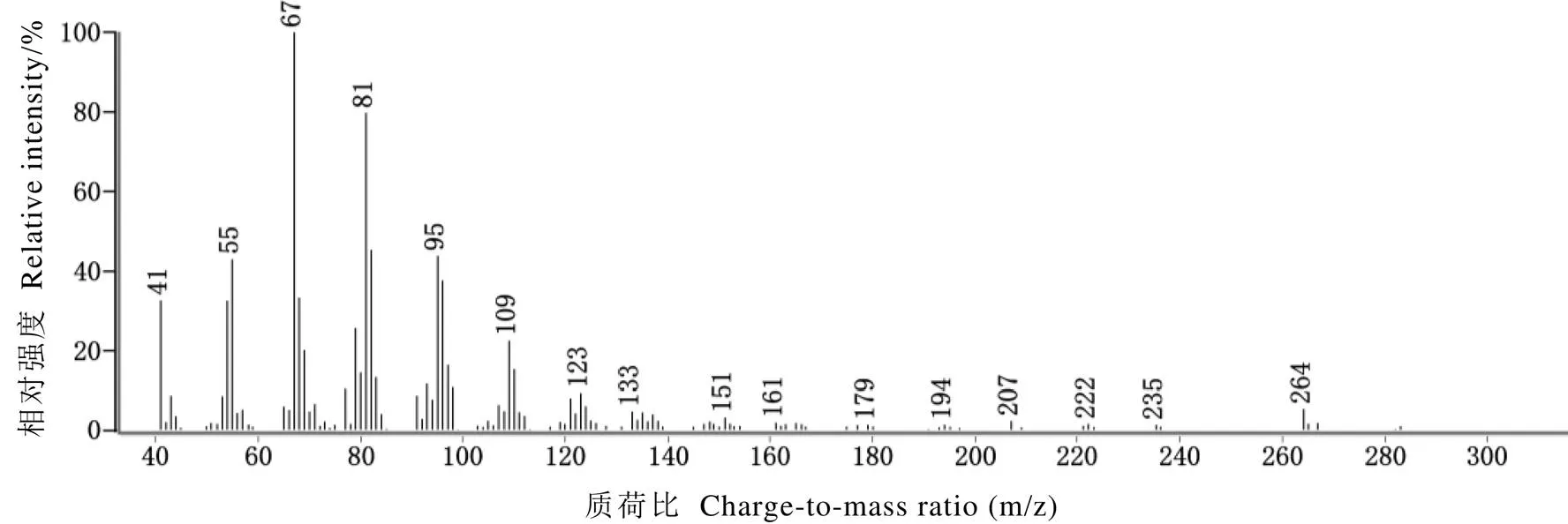
图3 性信息素提取物活性成分质谱图
2.3 茶蚕性信息素田间诱捕效果
海南、安徽两地田间诱捕结果表明,与空白对照相比,11,14-18Ald对茶蚕雄虫具有显著的引诱作用(表1),且性信息素不同剂量对茶蚕雄虫的引诱效果具有显著影响。两地诱捕结果显示,随性信息素剂量(0.3、0.6、0.9 mg)的增加,雄虫的诱捕数逐渐增加。海南五指山试验数据显示,当性信息素剂量为0.9 mg,雄虫的诱捕数达到(213.50±11.90)头,显著高于剂量为0.3 mg与0.6 mg时的诱捕数(=1 052.751,=3,<0.01)。安徽岳西试验数据显示,0.6 mg与0.9 mg处理的诱捕数显著高于0.3 mg处理和空白对照(=24.681,=3,<0.01),其中剂量为0.9 mg时的诱捕数为(21.50±8.17)头,诱捕量为0.6 mg处理的2.46倍,然而0.9 mg和0.6 mg剂量处理之间无显著差异。
2.4 茶蚕田间种群虫口监测结果
茶蚕田间种群虫口监测结果显示,利用性信息素进行虫口监测是一种有效方法。利用该方法对海南五指山地区茶园茶蚕虫口监测发现,该地区5月—10月共发生两代茶蚕。第一代成虫自5月7日调查仅为(7.00±2.12)头,低虫口密度持续约1个月,6月7日成虫虫口增加,6月17日达到虫口高峰,达到(36.00±2.20)头,6月27日成虫虫口降低至(12.75±2.46)头。第二代成虫自7月7日调查为(16.00±1.41)头,7月27日开始成虫虫口增加,8月7日达到虫口高峰,这一代虫口高峰持续时间较长,到9月7日后虫口开始下降。共计16次的调查中,虫口高峰期的6月17日、8月7日、8月17日、8月27日和9月7日的虫口数显著高于虫口低谷期的5月7日、5月27日、9月27日和10月7日(=5.736,=15,<0.01)。
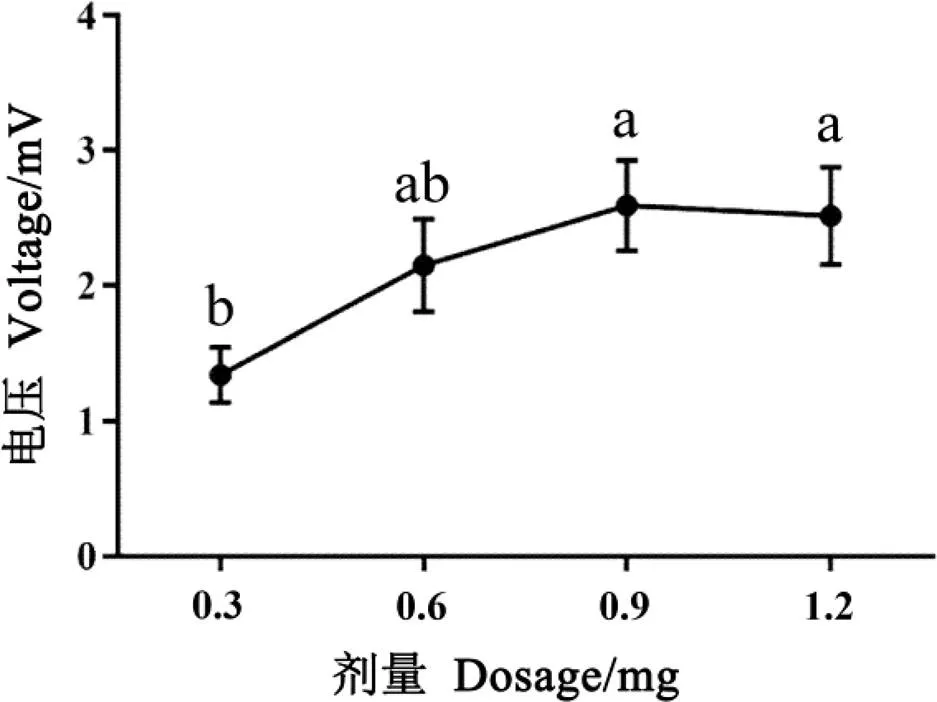
图4 茶蚕雄虫对不同剂量性信息素的触角电位反应图

表1 茶蚕性信息素化合物的田间引诱结果
注:数据为平均值±标准误,同列数据后不同小写英文字母表示在0.05水平上单因素方差分析差异显著
Note: Mean±SE, different lowercase letters in the same column mean significance difference (<0.05)
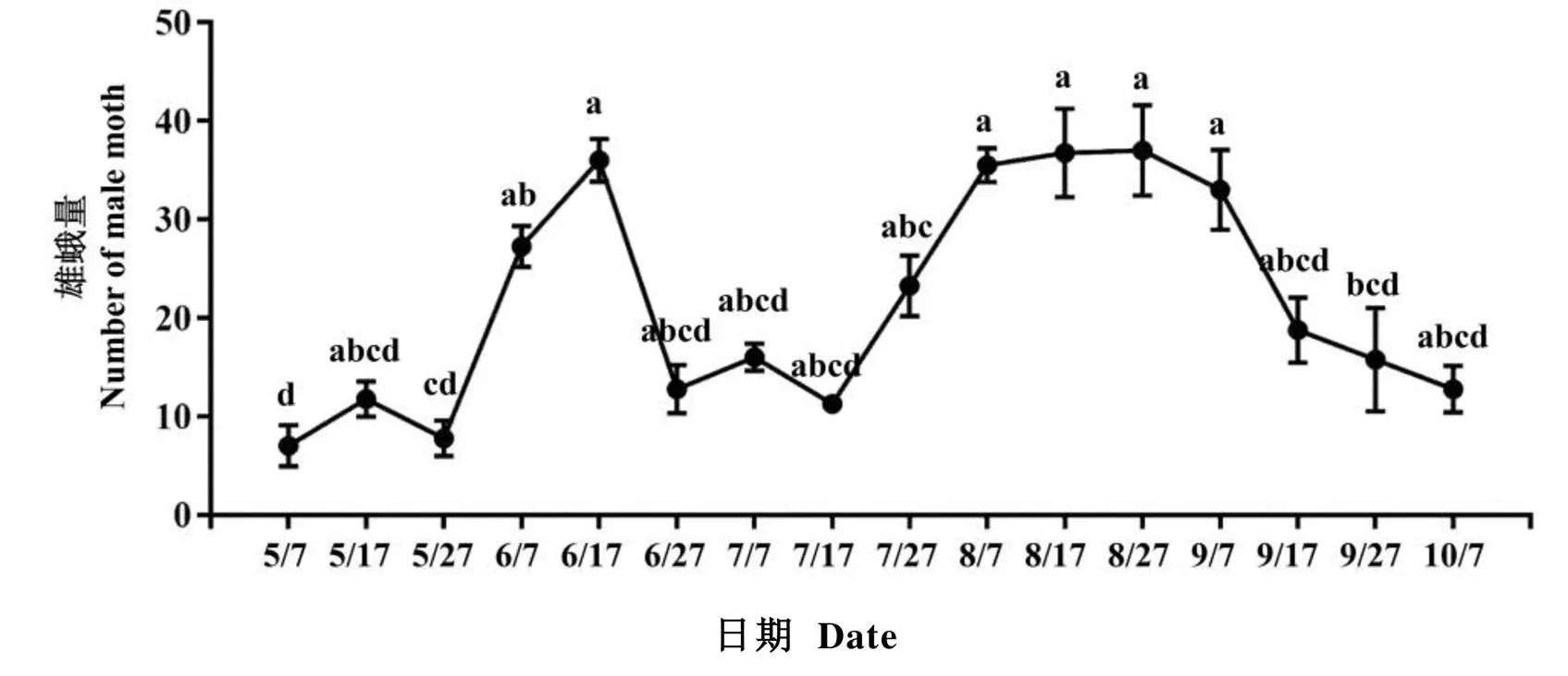
图5 海南省茶蚕种群动态监测
3 讨论
茶蚕作为我国茶园中一种重要的茶树食叶害虫,具有区域性暴发和危害性大的特点。现有的防治措施,因各方面原因未能完全满足高效、环保等要求,因此探究新的、有效的、环境友好型的防治方法具有深远的意义。性信息素是近年来农作物害虫绿色防控的重要技术之一,有望在一定程度上减少化学农药的使用量。同种昆虫的不同地理种群其性信息素存在差异,这种现象并不鲜见。Huang等[11]收集了日本纬度处于39.7°N~32.9°N的4个地方的亚洲玉米螟(Guenee),并分析了性信息素,发现日本的亚洲玉米螟性信息素存在地理变异现象,北部的3个亚洲玉米螟种群性信息素成分为反12-十四碳烯乙酸酯(12-14:OAc)和顺12-十四碳烯乙酸酯(12-14:OAc),其中12-14:OAc占36%~39%;南方种群的性信息素组分虽与北方种群性信息素组分相同,但12-14:OAc的含量显著高于北方种群,达到44%。不同区域的欧洲玉米螟()种群的性信息素比例亦存在差异,欧洲玉米螟纽约种群的信息素成分为顺11-十四碳烯乙酸酯和反11-十三碳烯乙酸酯,在欧洲和北美地区的绝大部分范围两种性信息素都是以97∶3的比例引诱效果最佳,而美国东北地区、荷兰和意大利的欧洲玉米螟种群却对3∶97的性信息素比例表现良好的趋性[14-15]。棉铃虫()雄性对性信息素诱捕反应也呈现出地理变异,当在棉铃虫的信息素混合物中加入拮抗化合物11-16:OAc时,在澳大利亚和中国诱捕的棉铃虫雄性数量明显减少,但在西班牙种群却并未受影响[16]。Ho等[10]曾对我国台湾地区茶蚕种群的性信息素进行了初步研究,然而台湾海峡的区隔可能会导致茶蚕大陆种群和台湾种群的性信息素在成分、比例或剂量方面存在差异。为精准指导我国茶叶主产区利用性信息素防治茶蚕,本研究对茶蚕大陆种群性信息素进行鉴定,结果表明,茶蚕大陆种群性信息素主要活性组分为11,14-18:Ald,与之前报道的我国台湾地区茶蚕信息素主要活性组分一致。然而雌虫性腺中性信息素类似物方面却有所差异,茶蚕台湾种群发现3种成分,分别为Octadecanal(18:Ald)、()-11-Octadecenal(11-18:Ald)、()-14-Ocladecenal(14-18:Ald),本研究中茶蚕大陆种群雌虫体内仅发现11-18:Ald。这几种性信息素类似物是否在茶蚕求偶通讯中发挥了功能?性信息素类似物差异是否导致了求偶通讯的隔离?这些问题有待在后续的工作中进一步的研究。
性信息素目前主要有3种应用策略,分别是虫口监测、大规模诱杀和迷向干扰[17]。本研究的茶蚕性信息素对茶蚕雄虫引诱效果良好,具有开发大规模诱杀技术的潜力。在今后的茶蚕防治中,可开发具有应用潜力的性诱剂产品对茶蚕雄虫进行大规模诱捕,以降低交配成功率,从而达到防治目的。然而大规模诱杀茶蚕仍需解决两个关键问题,首先茶蚕性信息素为醛类化合物,稳定性相对较差,需研发相应的性信息素缓释材料及稳定剂;其次需开发适宜于诱杀茶蚕的配套装置,达到高效和节省人力、物力的要求。此外利用性信息素对茶蚕进行虫口监测同样具有十分重要的应用价值。监测虫情以掌握茶蚕的虫态和数量等可以为精准地开展防治工作提供依据,有助于确定防治阈值和防治时机等。本研究利用性信息素对茶蚕虫口种群动态进行监测,结果准确地反映了海南五指山地区5—10月两代茶蚕的发生情况。可见,相较于人工调查或灯诱调查,茶蚕性信息素是一种更为便捷和高效的虫口监测方法。因此,利用茶蚕性信息素对茶蚕可能发生的重点区域进行监测,可及时发现虫情并为精准防治提供依据。
[1] 黄国华, 王星. 中国茶蚕蛾属Walker, 1865记述[J]. 昆虫分类学报, 2004(1): 47-48.
Huang G H, Wang X. Notes on theWalker, 1865 (Lepidoptera: Bombycidae) from China with a newly recorded species [J]. Enotomotaxonomia, 2004(1): 47-48.
[2] 李锡好. 茶蚕发生规律及其防治[J]. 中国茶叶, 1984(2): 36-37.
Li X H. The occurrence and control management ofWalker [J]. China Tea, 1984(2): 36-37.
[3] Banerjee B. A strategy for the control ofWalker on tea [J]. Crop Protection, 1982, 1(1): 115-119.
[4] 余复陶. 茶蚕的形态习性及防治法介绍[J]. 华中农业科学, 1957(1): 59-60.
Yu F T. Morphological habits and management ofWalker [J]. Hubei Agricultural Sciences, 1957(1): 59-60.
[5] 徐德进, 陈锦绣, 章东方, 等. 茶蚕发生规律的研究[J]. 安徽农业科学, 1993(3): 265-268.
Xu D J, Chen J X, Zhang D F, et al. Research on the occurrence ofWalker [J]. Journal of Agricultural Sciences, 1993(3): 265-268.
[6] Stelinski L L, Gut L J, Miller J R. An attempt to increase efficacy of moth mating disruption by co-releasing pheromones with kairomones and to understand possible underlying mechanisms of this technique [J]. Environmental Entomology, 2013, 42(1): 158-66.
[7] Liebhold A M, Tobin P C. Population ecology of insect invasions and their management [J]. Annual Review of Entomology, 2008, 53(1): 387-408.
[8] Luo Z X, Magsi F H, Li Z Q,et al. Development and evaluation of sex pheromone mass trapping technology for: a potential integrated pest management strategy [J]. Insects, 2020, 11(1): 15. doi: 10.3390/insects11010015.
[9] 杜家纬. 昆虫信息素及其应用[M]. 北京: 中国林业出版社, 1988.
Du J W. Insect sex pheromone and its application [M]. Beijing: China Forestry Publishing House, 1988.
[10] Ho H Y, Tao Y T, Tsai R S, et al. Isolation, identification, and synthesis of sex pheromone components of female tea cluster caterpillar,Walker (Lepidoptera: Bombycidae) in Taiwan [J]. Journal of Chemical Ecology, 1996, 22(2): 271-285.
[11] Huang Y P, Takanashi T, Hoshizaki S, et al. Geographic variation in sex pheromone of Asian corn borer,, in Japan [J]. Journal of Chemical Ecology, 1998, 24(12): 2079-2088.
[12] 孙付存, 孔祥波, 张苏芳, 等. 思茅松毛虫3个地理种群性信息素成分差异分析[J]. 林业科学研究, 2017, 30(6): 993-998.
Sun F C, Kong X B, Zhang S F, et al. Geographic variation of aex pheromones in three populations of(Lepidoptera: Lasiocampidae) [J]. Forest Research, 2017, 30(6): 993-998.
[13] 罗宗秀, 李兆群, 蔡晓明, 等. 灰茶尺蛾性信息素的初步研究[J]. 茶叶科学, 2016, 36(5): 537-543.
Luo Z X, Li Z Q, Cai X M, et al. A primary study on sex pheromone of[J]. Journal of Tea Science, 2016, 36(5): 537-543.
[14] Klun J A. Insect sex pheromones: intraspecific pheromonal variability ofin North America and Europe [J]. Environmental Entomology, 1975, 4(6): 891-894.
[15] Kochansky J,Cardé R T, Liebherr J, et al. Sex pheromone of the European corn borer,(Lepidoptera: Pyralidae), in New York [J]. Journal of Chemical Ecology, 1975, 1(2): 225-231.
[16] Gao K, Torres-vila L M, Zalucki M P, et al. Geographic variation in sexual communication in the cotton bollworm,[J]. Pest Management Science, 2020, 76: 3596-3605.
[17] Malo E A, Cruz-Esteban S, González F J, et al. A home-made trap baited with sex pheromone for monitoringmales (Lepidoptera: Noctuidae) in corn crops in Mexico [J]. Journal of Economic Entomology, 2018, 111(4): 1674-1681.
Sex Pheromone ofMainland Population in China: Identification and Population Monitoring
CUI Shaowei1, ZHAO Dongxiang2, ZHANG Jiaxia3, SHANG Jiannong4, CAI Xiaoming1, LI Zhaoqun1, BIAN Lei1, XIU Chunli1, FU Nanxia1, CHEN Zongmao1,LUO Zongxiu1*
1. Tea Research Institute of Chinese Academy of Agricultural Sciences, Hangzhou 310008, China;2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agriculture Sciences, Haikou 571101, China; 3. Tea Research Institute of Anhui Academy of Agricultural Sciences, Huangshan 245000, China; 4. Xihu District Agricultural Technology Extension Service Center, Hangzhou 310013, China
Walker is a severe defoliator species in Chinese tea plantation. The larvae ofcan eat all the tea leaves in case of severe attack, and cause a significant damage. In this study, the sex pheromone of mainland population was identified. The crude pheromone was extracted from abdominal tips of virgin females by-hexane during their courtship peak period. The extracts were analyzed by gas chromatography-electroantennographic detection (GC-EAD) and gas chromatography-mass spectrometry (GC-MS). The electrophysiological activity of sex pheromone components was tested by electroantennogram (EAG), and the optimal dose of sex pheromone was determined by the field trapping test. Ultimately, the sex pheromone ofwas used to monitor the population dynamics in Wuzhishan city of Hainan province. The GC-EAD analyses revealed only one component that elicited responses for the male moth antennae. Based on the mass spectrum, the component was identified as11,14-18Ald. The pheromone component was proved to be correctly identified by EAD tests and field trapping results. The data of field trapping show the dose dependent attraction of the pest, with the maximum attractiveness at 0.9 mg sex pheromone loaded on rubber septum lure. The results of population monitoring show that the sex pheromone was a promising tool for monitoring the pest population. It is clear that there were two generations ofin Wuzhishan city of Hainan Province from May to October, and the peak emergence of adult were 17 June and 27 August respectively. The results of this study provided a theoretical basis for the application of sex pheromones for attracting and killing or monitoring pest population in the main tea producing areas of China.
, sex pheromone, identification, population monitoring
S571;S435.711
A
1000-369X(2022)01-101-08
2021-09-01
2021-11-01
浙江省重点研发计划(2019C02033)、中国农业科学院创新工程(CAAS-ASTIP-2017-TRICAAS)、财政部和农业农村部:国家现代农业产业技术体系(CARS-23)
崔少伟,男,硕士研究生,主要从事茶树害虫防治技术研究与推广。*通信作者:luozongxiu@tricaas.com
(责任编辑:赵锋)

