苦茶碱代谢关键转录因子基因的筛选鉴定
刘玉飞,庞丹丹,李友勇,蒋会兵,田易萍,孙云南,陈林波*
苦茶碱代谢关键转录因子基因的筛选鉴定
刘玉飞1,2,庞丹丹1,2,李友勇1,2,蒋会兵1,2,田易萍1,2,孙云南1,2,陈林波1,2*
1. 云南省农业科学院茶叶研究所,云南 勐海 666201;2. 云南省茶学重点实验室,云南 勐海 666201
苦茶是我国特异的茶树资源,主要分布于西南地区,富含苦茶碱(1,3,7,9-四甲基尿酸)。苦茶碱具有镇静、催眠和抗抑郁等多种生理活性,其合成关键基因(苦茶碱合成酶基因)已经得到克隆和研究,但是苦茶碱代谢调控机制的研究鲜有报道。为了挖掘与苦茶碱代谢调控相关的转录因子,本研究以高苦茶碱(GKC)、低苦茶碱(LKC)茶树品种以及常规茶树品种(YK10)为研究对象,通过HPLC和RNA-seq分别就样品的嘌呤生物碱含量和基因表达情况进行分析,并通过荧光定量PCR验证了转录组数据的可靠性。结果表明,GKC和LKC的苦茶碱含量分别为21.82 mg·g-1和14.70 mg·g-1,而YK10中检测不到苦茶碱,另外,GKC和LKC的咖啡碱含量均低于15.00 mg·g-1;通过RNA-seq方法,获得了3 948个GKC vs YK10和LKC vs YK10共同的且表达趋势一致的差异基因,这些差异基因是分属29个家族的96个转录因子,通过分析最终确定30个候选转录因子,尤其是属于NAC和HD-ZIP转录因子家族的、、、和等转录因子可能是参与苦茶碱代谢调控的关键基因。
苦茶;苦茶碱;RNA测序;转录因子
苦茶(var. kucha)是我国特异的茶树资源,其鲜叶和以其鲜叶所制作的茶叶都具有独特的苦味,其主要分布于广东、广西、云南、湖南,尤以云南以及南岭山脉两侧最多[1-2],其中云南省南部、东南部的西双版纳州、红河州分布着大量的苦茶资源[3]。苦茶形态与栽培茶树相似,其一般为小乔木,叶片较大[4]。但是制成茶叶的滋味(具有特殊的苦味)和香气(具有丁香香气)与栽培茶树存在明显的差异[1-2,4]。在苦茶的原生地,苦茶成为当地人民生活的必需品,认为常饮有“退火发汗、解毒、治病”的药用功效[1]。
苦茶与常规茶树的嘌呤生物碱组成有较大差异,常规茶树以咖啡碱为主,其次是可可碱和茶叶碱,而苦茶以苦茶碱(1,3,7,9-四甲基尿酸)为主,已报道的含量可以超过茶叶干重的3%,其次是咖啡碱和可可碱[5-8]。苦茶碱与苦茶的苦味显著相关[6,9],同时,多项研究表明苦茶碱具有镇静、催眠、抗抑郁、消炎、镇痛、减少肝细胞的应激损伤和改善运动能力等多种生物活性[10-15]。苦茶碱生物合成已相对明确,其是由1,3,7-三甲基尿酸经甲基化转化而来,而1,3,7-三甲基尿酸来源于咖啡碱的氧化还原。Wang等[4]和陈潇敏等[16]对苦茶碱合成途径相关的基因进行了探究,筛选到可能催化1,3,7-三甲基尿酸甲基化的苦茶碱合成酶基因(,属于氮甲基转移酶家族基因),同时发现苦茶碱代谢途径的多个基因在苦茶和常规茶树中存在差异表达。Zhang等[17]通过转录组测序、酶活性测定和晶体结构分析获得了(MN163831),并对其关键活性位点进行了探讨,同时指出苦茶中大量积累苦茶碱的原因可能是的高表达引起,其在苦茶中的表达量是常规茶树的30万倍左右。
以上研究主要集中在苦茶碱合成相关的结构基因,但是是否存在调控基因参与苦茶碱的生物合成目前还不明确。基于此,本研究选择高苦茶碱(GKC)、低苦茶碱(LKC)和未检测到苦茶碱(YK10)的茶树种质/品种作为试验材料,利用高效液相色谱和RNA-Seq进行嘌呤生物碱分析和转录组测序,筛选鉴定与苦茶碱代谢相关的转录因子基因。本研究结果将有助于揭示苦茶碱代谢的调控机制、解析苦茶富集苦茶碱的分子机制,并有利于后期苦茶茶树品种的选育。
1 材料与方法
1.1 材料
2020年7月10日,采摘高苦茶碱(GKC)、低苦茶碱(LKC)和未检测到苦茶碱(YK10)的茶树种质/品种的一芽二叶,迅速液氮固样,然后保存于–80℃冰箱,用于进一步的转录组测序;同时采摘一部分样品微波固样,然后75℃烘至足干,磨碎用于生物碱含量的测定。LKC和YK10树龄约为30 a,GKC树龄为5 a,每年秋冬对其进行修剪。GKC、LKC和YK10分别来源于云南省的景洪市、金平县和勐海县,现均保存于云南省农业科学院茶叶研究所。
1.2 生物碱含量测定
采用高效液相色谱法测定生化样中生物碱(可可碱、咖啡碱和苦茶碱)含量,各样品均独立重复3次。样品提取方法具体为:称取0.100 g磨碎茶样,置于15 mL离心管中,加入10 mL 75%甲醇水溶液,70℃水浴10 min,中间摇匀3次,然后12 000 r·min-1离心10 min,取上清液过0.45 mm有机滤膜,收集滤液于液相瓶中,用于生物碱含量的测定。液相色谱测定条件参照Jin等[18]的方法。
1.3 RNA序列与差异基因分析
RNA提取与转录组测序均由北京诺禾致源科技有限公司完成,具体方法参见Liu等[19]方法,使用的参考基因组见文献[20]。用DESeq2工具[21]进行差异基因的分析,将两个样品表达量差异大于等于两倍(|log2(Fold change)|≥1)、-value <0.05定义为差异基因(DEG)。利用GO和KEGG数据库,以整个基因组为背景,通过clusterProfile软件对DEGs进行GO与KEGG富集分析。
1.4 差异转录因子鉴定
利用PlantTFDB(Plant transcription factor database)软件[22],对差异基因中的转录因子进行预测。用于预测的序列为差异基因转录组数据的基因序列,比对的参考物种为拟南芥。利用Excel对获得的转录因子进行统计分析。
1.5 qRT-PCR验证
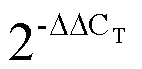
2 结果与分析
2.1 不同样品中生物碱含量分析
由表2可知,GKC和LKC都含有较高的苦茶碱,分别为21.82 mg·g-1和14.70 mg·g-1,而常规茶树YK10未检测出苦茶碱;3个样品中咖啡碱的含量趋势与苦茶碱相反,高低依次为YK10>LKC>GKC,并且GKC和LKC均低于15.00 mg·g-1。GKC相比于LKC和YK10含有较高的可可碱,其含量超过10.00 mg·g-1。YK10生物碱总量最高为52.15 mg·g-1,LKC生物碱总量最低为27.29 mg·g-1。
2.2 测序数据质量分析
本研究分别构建了YK10、LKC和GKC的cDNA文库,每个样品重复3次,并进行转录组测序(表3)。3个样品的平均测序错误率约为0.03%,分别测序获得了41 518 584、43 661 820、43 933 787个原始reads,去除测序接头和低质量reads分别得到40 638 848、42 657 323、42 859 093个高质量reads。另外,3个样品的碱基百分比Q20超过97.93,而Q30超过93.99;GC含量为42.46%~43.17%。将高质量reads与参考基因组比对,比对率超过81.27%。这些结果表明,转录组测序获得数据质量好,并且与参考基因组比对率高,可以用于进一步的研究。

表1 荧光定量PCR引物序列
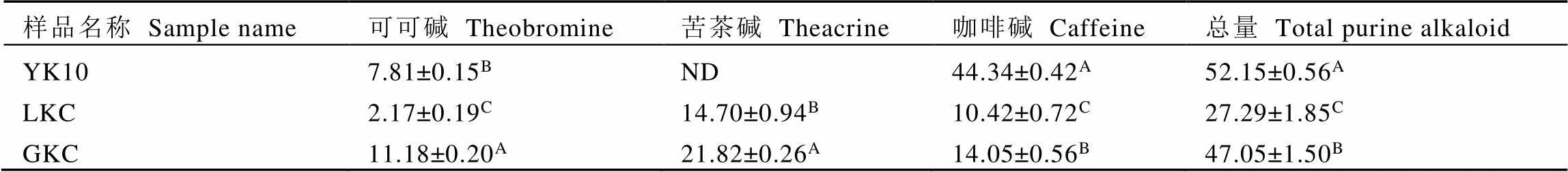
表2 3份样品中嘌呤生物碱含量
注:每列中不同大写字母表示样品间化合物含量差异极显著(< 0.01)。ND:未检出
Note: Different capital letters within a column are highly significant difference at<0.01. ND: not detected
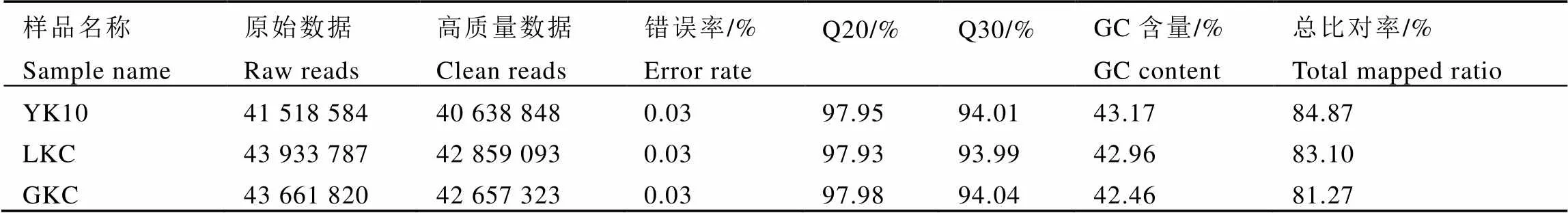
表3 测序质量评估
2.3 差异基因分析
差异基因(DEGs)分析结果显示(图1),GKC与YK10(GKC vs YK10)相比有11 872个DEGs,其中5 647个基因上调,6 225个基因下调;LKC与YK10(LKC vs YK10)相比有10 514个DEG,其中上调和下调的基因数分别为5 011和5 503。其中在GKC vs YK10和LKC vs YK10表达趋势一致的上调基因有1 374个,下调基因有2 574个。这些基因在GKC vs YK10和LKC vs YK10中表达趋势一致,可能与苦茶中高苦茶碱的积累相关。
2.4 差异基因富集分析
对GKC vs YK10和LKC vs YK10中表达趋势一致的3 948个DEGs进行GO和KEGG富集分析。GO富集分析的结果显示,有1 393个差异基因被富集到了GO条目,一共注释到1 048个GO条目,这些条目可以归为分子功能、细胞组分和生物过程3个大的类别,其中富集差异基因最多的类别是生物过程,其次是分子功能。图2-A显示了每个类别前十个GO条目,其中主要富集的条目有碳氧裂解酶活性(Carbon-oxygen lyase activity)、镁离子结合(Magnesium ion binding)、腺苷琥珀酸合酶活性(Adenylosuccinate synthase activity)、核黄素合酶复合物(Riboflavin synthase complex)和嘌呤核苷二磷酸代谢过程(Purine nucleoside bisphosphate metabolic process)。另外,在富集的条目中,还发现多个基因被富集到-腺苷甲硫氨酸依赖性甲基转移酶活性(-adenosylmethionine-dependent methyltransferase activity)和-甲基转移酶活性(-methyltransferase activity),这些基因可能在茶树嘌呤生物碱代谢中发挥着重要作用。
KEGG富集分析结果显示(图2-B),差异基因被富集到111个代谢通路,主要富集的代谢通路有黄酮类生物合成(Flavonoid biosynthesis)、嘌呤代谢(Purine metabolism)、磷酸戊糖途径(Pentose phosphate pathway)和谷胱甘肽代谢(Glutathione metabolism)等。另外,还发现多个基因被富集到异喹啉生物碱的生物合成(Isoquinoline alkaloid biosynthesis)和托烷(Tropane)、哌啶(Piperidine)和吡啶生物碱(Pyridine alkaloid)的生物合成。
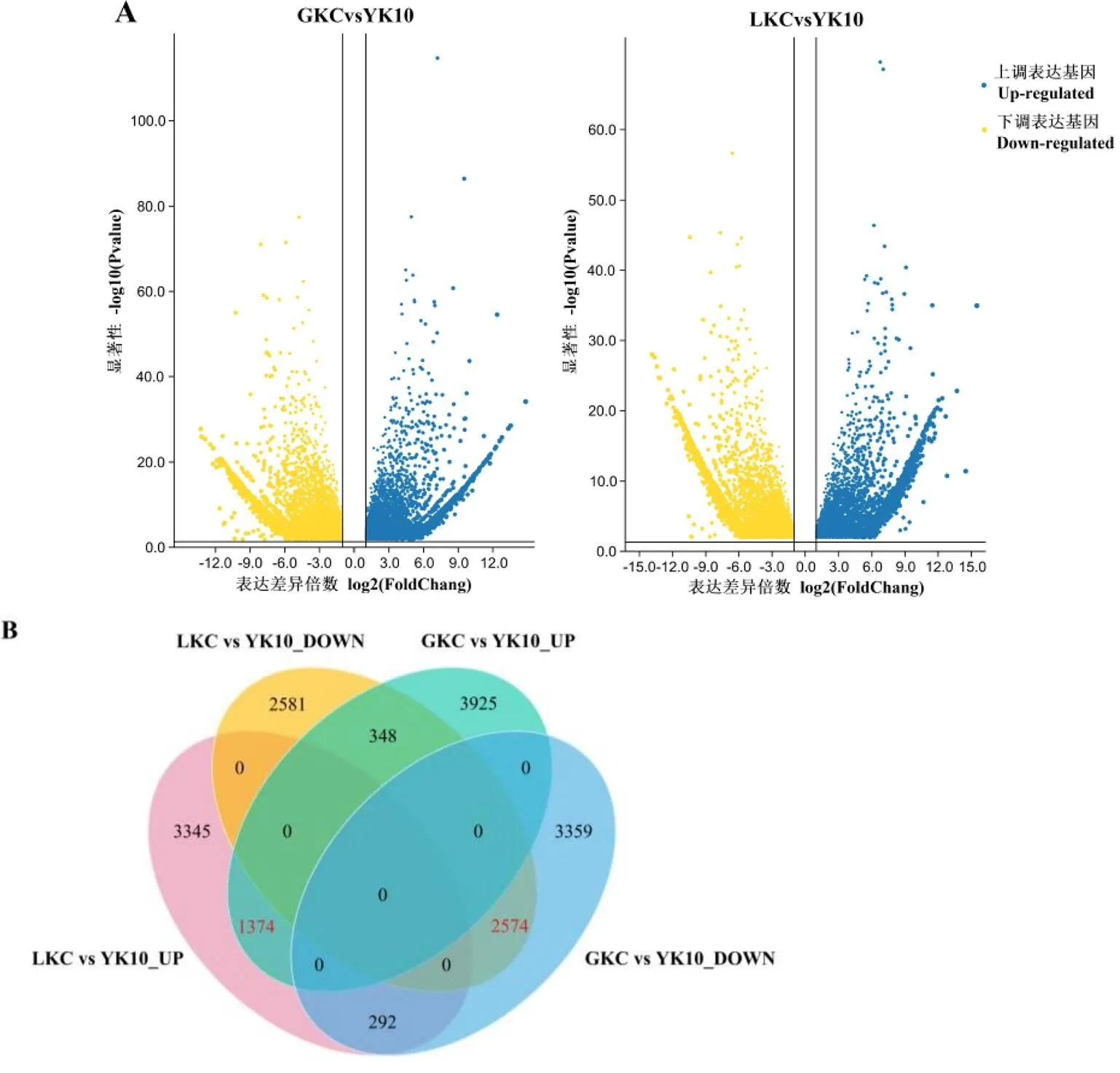
注:A:差异基因火山图;B:上、下调表达基因的Venn图
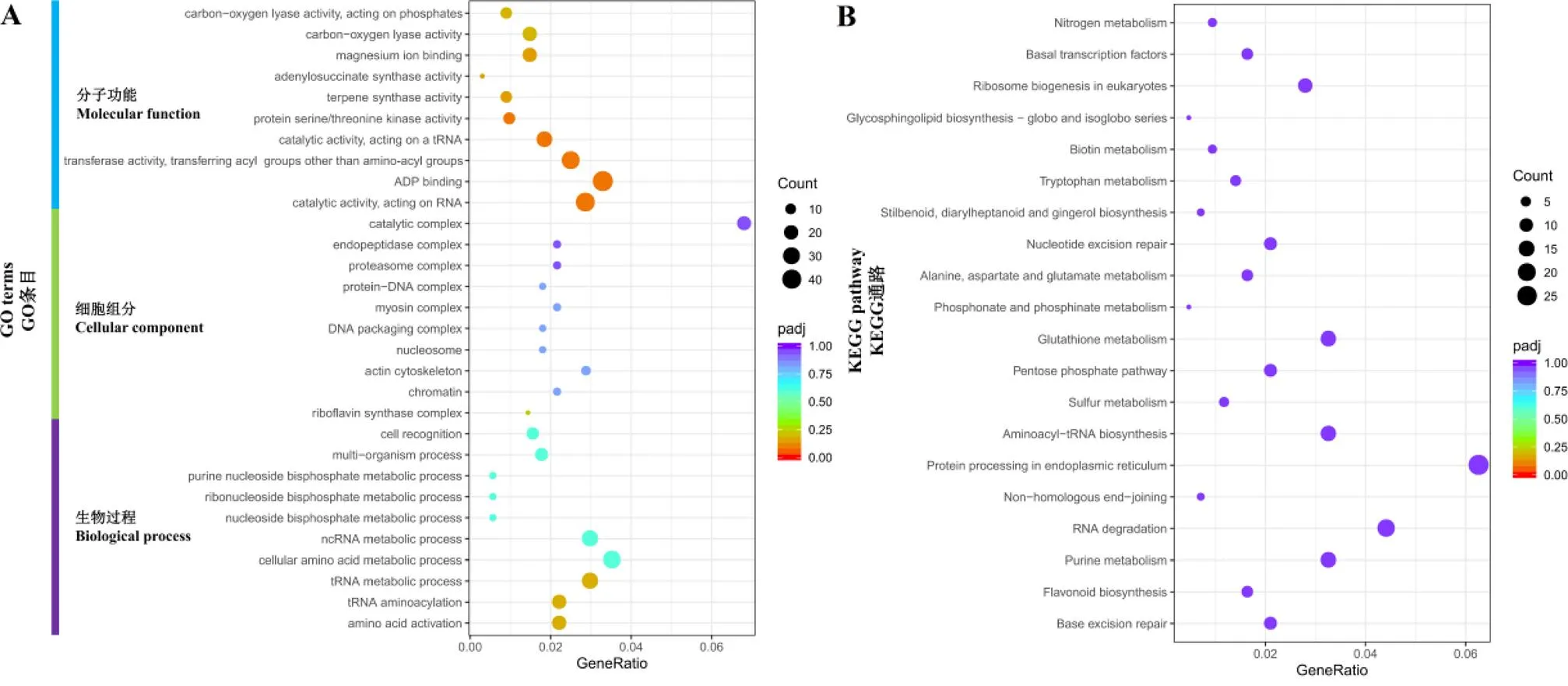
注:A:GO注释;B:KEGG代谢通路
2.5 差异转录因子鉴定与表达量分析
转录因子是重要的调控因子,可以与功能基因的调控区域直接或间接结合,从而激活或抑制基因表达,进而调控多种生物学过程。通过植物转录因子数据库(PlantTFDB)对获得的3 948个差异基因中的转录因子基因进行鉴定,一共获得96个编码转录因子基因,这些转录因子属于29个不同的家族(图3)。转录因子家族包含差异基因数最多是bHLH(差异基因数13,占转录因子总数的比例13.54%),其次是MADS、MYB和FAR1,分别有9个差异基因。另外,bZIP、HD-ZIP、NF-YB、TCP和WRKY家族也包含多个转录因子基因。
鉴定到的96个转录因子基因,其中35个上调表达,61个下调表达(图4)。这96个转录因子基因表达量(FPKM)在YK10、GKC或者LKC至少一个样品中大于等于10的有30个。在这30个转录因子中,MYB(CSS0007879、CSS0031950、CSS0005261和CSS0012202)和NAC(CSS0012182、CSS0013789、CSS0041233和novel.16084)家族的基因最多,其次是MADS(CSS0037110、CSS0013985和CSS0034462)。另外,还包括bZIP(CSS0008967和novel.5903)、HD-ZIP(CSS0014547)和ZF-HD(CSS0043409)等家族基因。
2.6 qRT-PCR分析
为了验证转录组数据的可靠性,从筛选到的96个转录组因子基因中选取10个设计定量引物,并进行qRT-PCR分析。定量结果表明,基因的表达趋势与转录组数据基本一致(图5),说明转录组测序结果是可靠的。
3 讨论
苦茶是我国的特异茶树资源,富含苦茶碱是其有别于常规茶树最典型的生化特征。本研究对“国家大叶茶树资源圃(勐海)”保存的两份苦茶种质进行生物碱的测定,发现它们均含有较高的苦茶碱,与金基强等[24]研究一致,常规茶树YK10中并没有检测到苦茶碱,两份苦茶种质的咖啡碱含量均低于15 mg·g-1,并且苦茶碱的含量与咖啡碱的含量趋势相反,这与Wang等[4]的研究结果一致,咖啡碱是苦茶碱合成的前体物,推测可能是咖啡碱在苦茶中部分转化为苦茶碱所致。以往研究表明咖啡碱具有提神兴奋的作用,但是敏感群体摄入大量咖啡碱会引起失眠等不良的生理反应,而苦茶碱具有安神抗抑郁等生理功效[11-12]。因此,本研究中的含高、低咖啡碱的两个茶树种质,可以作为后期苦茶碱提取的生物来源,也可以用于开发低咖啡碱高苦茶碱的功能性茶产品。
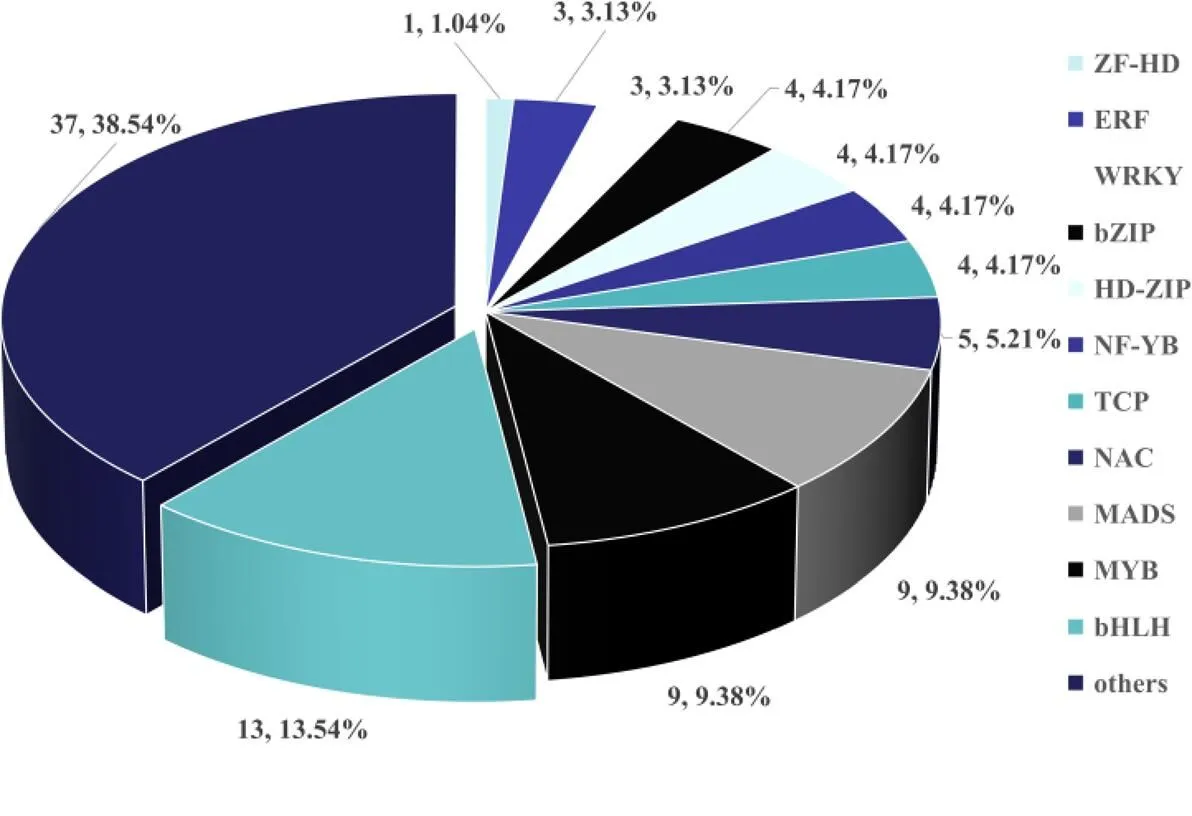
图3 差异基因中不同转录因子统计分析
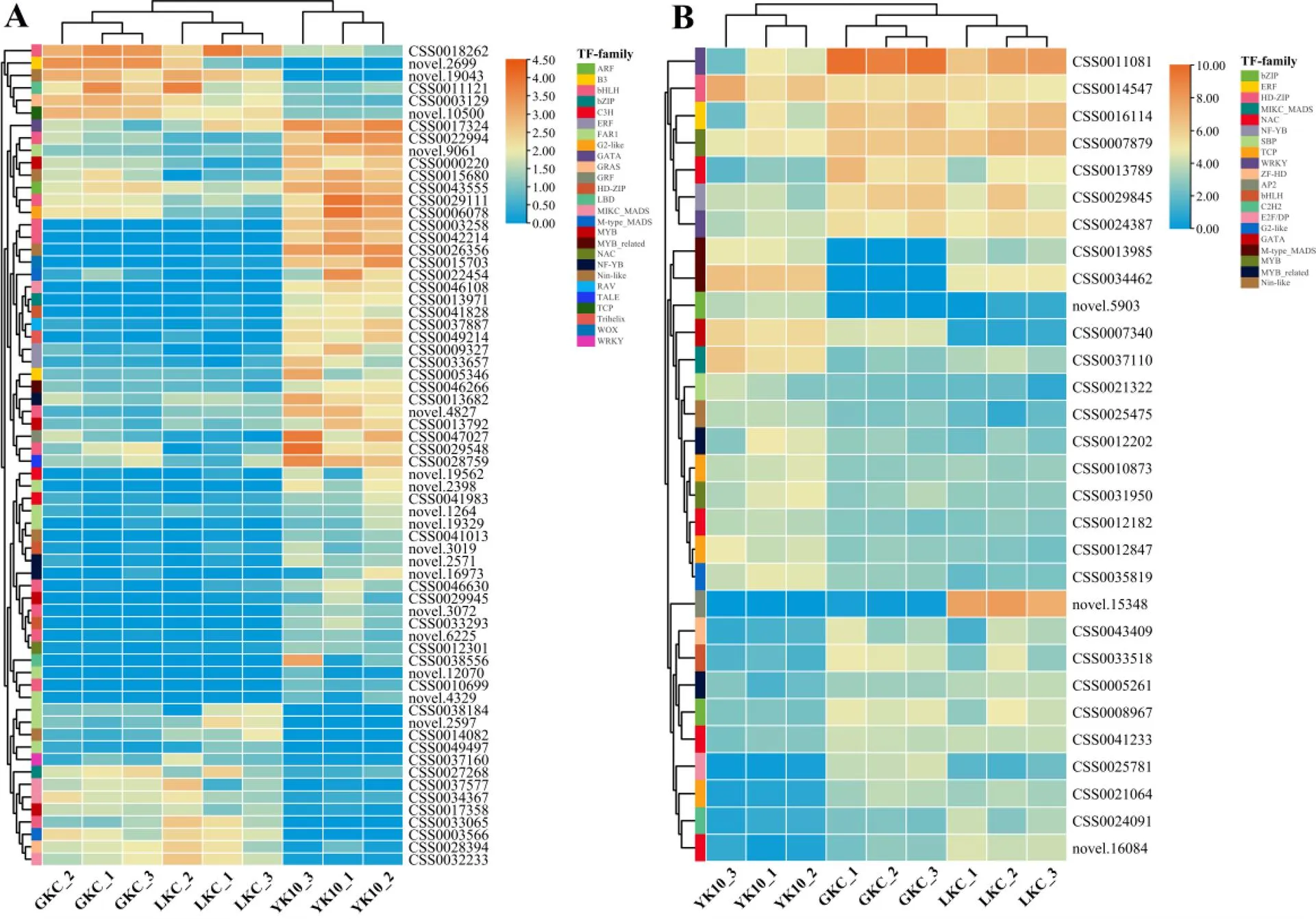
注:A:在GKC、LKC和YK10中的FPKM均小于10;B:在GKC、LKC和YK10至少有1个FPKM大于等于10
苦茶富含苦茶碱的内在分子机制,一直是困扰茶叶研究者的重大问题,2020年,Zhang等[17]通过转录组测序筛选鉴定到了苦茶碱合成酶基因(),并通过结构分析,初步解析了CsTcS催化1,3,7-三甲基尿酸形成苦茶碱的机制。Zhang等[17]研究发现普洱茶和苦茶均含有CsTcS的催化底物1,3,7-三甲基尿酸,并发现在普洱茶中表达量极低,不及苦茶中的万分之一,因此推测苦茶中富含苦茶碱是因为在苦茶中高表达引起,我们的定量结果也同样表明在苦茶中高表达,并且相比于LKC,在GKC中具有更高的表达量,说明的高表达可能与苦茶中富集苦茶碱相关。另外,多项研究还表明,嘌呤生物碱代谢途径相关的多个基因在苦茶与常规茶树中差异表达[4,16],本研究也同样发现嘌呤生物碱代谢等与苦茶碱代谢相关途径中的基因差异表达(图2)。以上研究说明苦茶碱的生物合成可能受到调控因子的影响。
以往的研究表明,多种调控因子可以影响基因的表达,其中转录因子是研究最多也是最为重要的一种[25]。通过转录组分析,本研究发现至少有属于29个不同家族的96个转录因子基因在GKC、LKC和YK10间差异表达。对这96个转录因子基因进一步筛选,获得30个候选基因(至少在1个样品中的FPKM≥10),候选转录因子中有多个属于NAC、HD-ZIP、bHLH、MADS和MYB等家族的基因(图4)。刘平[26]通过酵母单杂筛选到3个属于NAC和HD-ZIP家族的转录因子,推测它们可能参与调控茶树嘌呤生物碱代谢关键氮甲基转移酶基因()。康馨等[27]发现沉默(HD-ZIP家族转录因子)基因,茶树叶片愈伤组织中的基因出现下调表达,并且咖啡碱的含量显著下降,推测可能通过调控影响茶树咖啡碱的含量。咖啡碱是苦茶碱合成的前体物质,NAC和HD-ZIP等转录因子影响咖啡碱的合成和积累,可以间接调控苦茶碱的合成。另外,茶树中NMT家族不仅编码区高度相似,其启动子区也具有一定的相似性[8,28],的启动子上也可能具有NAC和HD-ZIP等转录因子结合的结构域,并受相关转录因子的调控。最终,本研究获得的30个候选的转录因子,尤其是NAC和HD-ZIP家族基因很可能参与苦茶碱的代谢,这些转录因子基因将是下一步研究苦茶碱生物合成调控的重点。
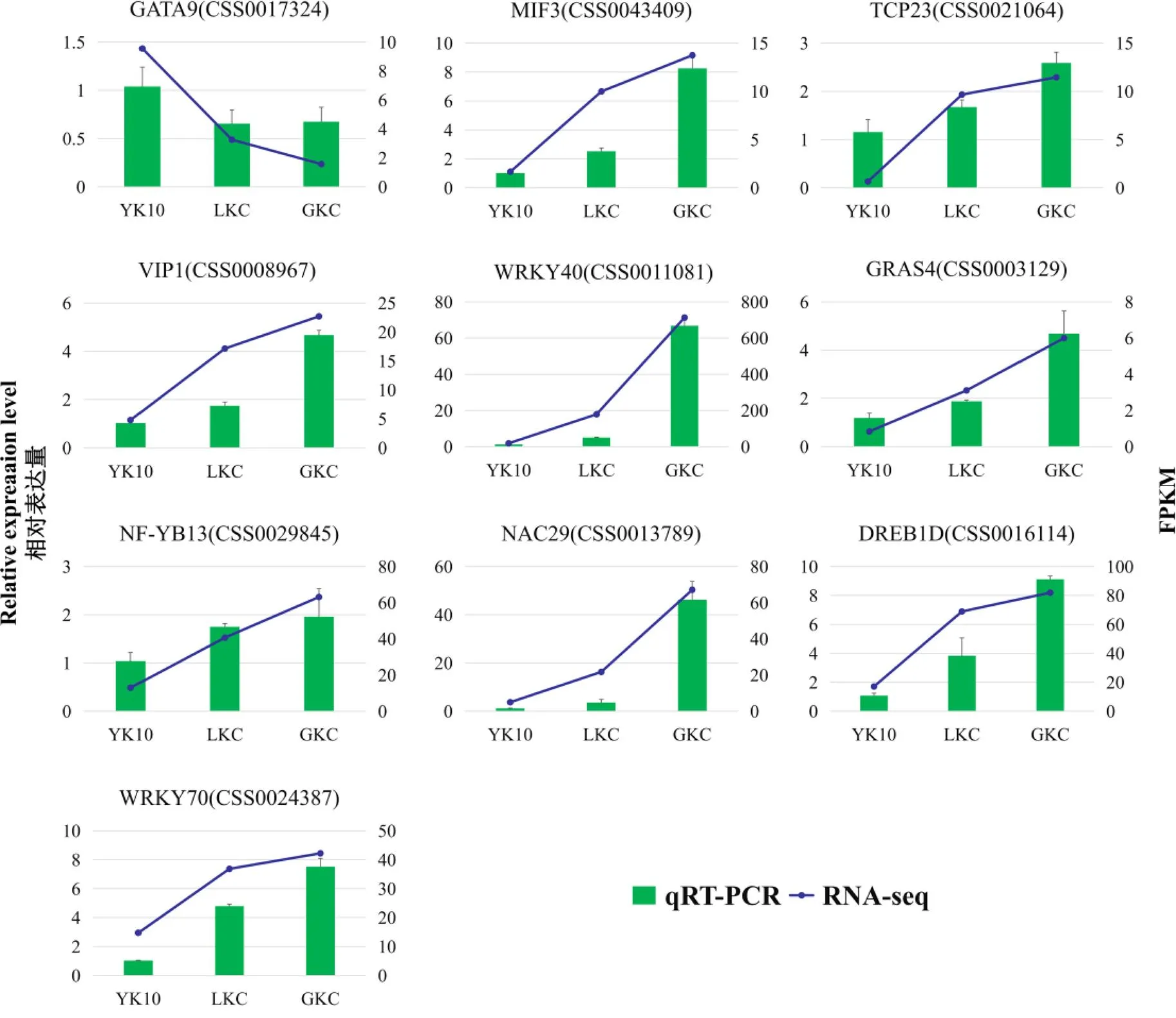
图5 qRT-PCR验证转录组数据
[1] 王新超, 姚明哲, 马春雷, 等. 我国苦茶资源主要生化成分的鉴定评价[J]. 中国农学通报, 2008, 24(6): 65-69.
Wang X C, Yao M Z, Ma C L, et al. Analysis and evaluation of biochemical components in bitter tea plant germplasms [J]. Chinese Agricultural Science Bulletin, 2008, 24(6): 65-69.
[2] 汪云刚, 刘本英, 宋维希, 等. 云南茶组植物的分布[J]. 西南农业学报, 2010, 23(5): 1750-1753.
Wang Y G, Liu B Y, Song W X, et al. Distribution of Sect.(L.) Dyer in Yunnan Province [J]. Southwest China Journal of Agricultural Sciences, 2010, 23(5): 1750-1753.
[3] 漠丽萍. 勐海县苦茶资源现状及开发利用探析[J]. 现代农业科技, 2017(13): 27-28.
Mo L P. Discussion on resource status and development and utilization ofvar. kucha in Menghai County [J]. Modern Agricultural Science and Technology, 2017(13): 27-28.
[4] Wang S L, Chen J D, Ma J Q, et al. Novel insight into theacrine metabolism revealed by transcriptome analysis in bitter tea (Kucha,) [J]. Scientific Reports, 2020, 10(1): 6286. doi: 10.1038/s41598-020-62859-2.
[5] 叶创兴, 林永成, 苏建业, 等. 苦茶var.Chang et Wang的嘌呤生物碱[J]. 中山大学学报(自然科学版), 1999, 38(5): 82-86.
Ye C X, Lin Y C, Su J Y, et al. Purine alkaloids invar.Chang et Wang [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1999, 38(5): 82-86.
[6] 叶创兴, Ashihara H, 郑新强, 等. 一种野生茶树的新嘌呤碱模式[J]. 中山大学学报(自然科学版), 2003, 42(1): 62-65.
Ye C X, Ashihara H, Zheng X Q, et al. New discovery of pattern of purine alkaloids in wild tea tree [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2003, 42(1): 62-65.
[7] 李红建, 秦丹丹, 姜晓辉, 等. 广东苦茶资源嘌呤生物碱含量分析与评价[J]. 茶叶科学, 2021, 41(1): 71-79. Li H J, Qin D D, Jiang X H, et al. Analysis and evaluation of purine alkaloid contents in bitter tea germplasm resources from Guangdong [J]. Journal of Tea Science, 2021, 41(1): 71-79.
[8] Jin J Q, Jiang C K, Yao M Z, et al. Baiyacha, a wild tea plant naturally occurring high contents of theacrine and 3″-methyl-epigallocatechin gallate from Fujian, China [J]. Scientific Reports, 2020, 10(1): 9715. doi: 10.1038/s41598-020-66808-x.
[9] 井娟, 王庆伟, 胡聪, 等. 1,3,7,9-四甲基尿酸的研究进展[J]. 中国药师, 2016, 19(2): 344-346.
Jing J, Wang Q W, Hu C, et al. Research Progress in Theacrine [J]. China Pharmacist, 2016, 19(2): 344-346.
[10] Qiao H Y, Ye X S, Bai X Y, et al. Theacrine: a purine alkaloid fromvar.with a hypnotic property via the adenosine system [J]. Neuroscience Letters, 2017, 659: 48-53.
[11] Xu J K, Kurihara H, Zhao L, et al. Theacrine, a special purine alkaloid with sedative and hypnotic properties fromvar.in mice [J]. Journal of Asian Natural Products Research, 2007, 9(7): 665-672.
[12] 谢果, 吴敏芝, 黄映如, 等. 1,3,7,9-四甲基尿酸抗抑郁作用的实验研究[J]. 中国药理学通报, 2009, 25(9): 1160-1163.
Xie G, Wu M Z, Huang Y R, et al. Experim ental study of theacrine on antidepressant effects [J]. Chinese Pharmacological Bulletin, 2009, 25(9): 1160-1163.
[13] Wang Y Y, Yang X R, Zheng X Q, et al. Theacrine, a purine alkaloid with anti-inflammatory and analgesic activities [J]. Fitoterapia, 2010, 81(6): 627-631.
[14] Li W X, Li Y F, Zhai Y J, et al. Theacrine, a purine alkaloid obtained fromvar. kucha, attenuates restraint stress-provoked liver damage in mice [J]. Journal of Agricultural and Food Chemistry, 2013, 61(26): 6328-6335.
[15] Feduccia A A, Wang Y, Simms J A, et al. Locomotor activation by theacrine, a purine alkaloid structurally similar to caffeine: involvement of adenosine and dopamine receptors [J]. Pharmacology Biochemistry and Behavior, 2012, 102(2): 241-248.
[16] 陈潇敏, 王鹏杰, 王淑燕, 等. 基于转录组的蕉城苦茶苦茶碱合成相关基因的挖掘[J/OL]. 应用与环境生物学报: 1-12[2021-04-01]. https://doi.org/10.19675/j.cnki.1006-687x.2020.05041.
Chen X M, Wang P J, Wang S Y, et al. Excavation of genes involved in theacrine biosynthesis of Jiaochengkucha based on transcriptome [J/OL]. Chinese Journal of Applied and Environmental Biology: 1-12[2021-04-01]. https://doi.org/ 10.19675/j.cnki.1006-687x.2020.05041.
[17] Zhang Y H, Li Y F, Wang Y J, et al. Identification and characterization of9-methyltransferase involved in converting caffeine into non-stimulatory theacrine in tea [J]. Nature Communications, 2020, 11(1): 1473. doi: 10.1038/s41467-020-15324-7.
[18] Jin J Q, Ma J Q, Ma C L, et al. Determination of catechin content in representative Chinese tea germplasms [J]. Journal of Agricultural and Food Chemistry, 2014, 62(39): 9436-9441.
[19] Liu Y F, Pang D D, Tian Y P, et al. Comparative transcriptomic analysis of the tea plant () reveals key genes involved in pistil deletion [J]. Hereditas, 2020, 157: 39. doi: 10.1186/s41065-020-00153-x.
[20] Xia E H, Tong W, Hou Y, et al. The reference genome of tea plant and resequencing of 81 diverse accessions provide insights into its genome evolution and adaptation [J]. Molecular Plant, 2020, 13(7): 1013-1026.
[21] Reiner A, Yekutieli D, Benjamini Y. Identifying differentially expressed genes using false discovery rate controlling procedures [J]. Bioinformatics, 2003, 19(3): 368-375.
[22] Jin J P, Tian F, Yang D C, et al. PlantTFDB 4.0: toward a central hub for transcription factors and regulatory interactions in plants [J]. Nucleic Acids Research, 2017, 45(D1): D1040-D 1045.
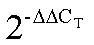
[24] 金基强, 周晨阳, 马春雷, 等. 我国代表性茶树种质嘌呤生物碱的鉴定[J]. 植物遗传资源学报, 2014, 15(2): 279-285.
Jin J Q, Zhou C Y, Ma C L, et al. Identification on purine alkaloids of representative tea germplasms in China [J]. Journal of Plant Genetic Resources, 2014, 15(2): 279-285.
[25] Wu H Y, Shi N R, An X Y, et al. Candidate genes for yellow leaf color in common wheat (L.) and major related metabolic pathways according to transcriptome profiling [J]. International Journal of Molecular Sciences, 2018, 19(6): 1954. doi: 10.3390/ijms19061594.
[26] 刘平. 茶树N-甲基转移酶基因启动子克隆、功能分析及转录因子分离[D]. 广州: 华南农业大学, 2018.
Liu P. Cloning, functional analysis and isolation of transcription factors of N-methyltransferase gene promoter in tea plants () [D]. Guangzhou: South China Agricultural University, 2018.
[27] 康馨, 刘平, 马雯慧, 等. RNAi沉默降低茶树叶片愈伤组织咖啡碱积累[J]. 园艺学报, 2020, 47(12): 2373-2384.
Kang X, Liu P, Ma W H, et al. RNAi silencingreduces the accumulation of caffeine in tea callus [J]. Acta Horticulturae Sinica, 2020, 47(12): 2373-2384.
[28] 刘玉飞, 金基强, 姚明哲, 等. 茶树咖啡碱合成酶基因稀有等位变异的筛选、克隆及功能[J]. 中国农业科学, 2019, 52(10): 1772-1783.
Liu Y F, Jin J Q, Yao M Z, et al. Screening, cloning and functional research of the rare allelic variation of caffeine synthase gene () in tea plants [J]. Scientia Agricultura Sinica, 2019, 52(10): 1772-1783.
The Screening and Identification of Key Transcription Factor Genes for Theacrine Metabolism
LIU Yufei1,2, PANG Dandan1,2, LI Youyong1,2, JIANG Huibing1,2, TIAN Yiping1,2,SUN Yunnan1,2, CHEN Linbo1,2*
1. Tea Research Institute, Yunnan Academy of Agricultural Sciences, Menghai 666201, China; 2. Yunnan Provincial Key Laboratory of Tea Science, Menghai 666201, China
Kucha is a unique tea resource rich in theacrine (1,3,7,9-tetramethyluric acid) in southwest China. Theacrine has a variety of physiological activities such as sedation, hypnosis and antidepressant. Theacrine synthesis enzyme, the key gene for theacrine biosynthesis, had been cloned and studied. However, there were few reports on the regulation mechanism of theacrine metabolism. In order to obtain the transcription factors related to theacrine metabolism, kucha (GKC and LKC) and normal tea cultivar (YK10) were used as research materials. Purine alkaloid content and related gene expressions in the samples were detected by HPLC and RNA-seq, respectively. And the reliability of the transcriptome data were verified by quantitative real-time PCR (qRT-PCR). The results show that the contents of theacrine in GKC and LKC were 21.82 mg·g-1and 14.70 mg·g-1, respectively, while the content of theacrine in YK10 was not detected. In addition, the caffeine contents of GKC and LKC were both lower than 15.00 mg·g-1. Based on RNA-seq, 3 948 differentially expressed genes (DEGs) had the consistent expression trends in GKC vs YK10 and LKC vs YK10. These DEGs included 96 transcription factors belonging to 29 families. Among them, 30 candidate transcription factors might be the key genes involved in the regulation of theacrine metabolism, especially NAC and HD-ZIP family transcription factors such as,,,and.
Kucha, theacrine, RNA-seq, transcription factor
S571.1
A
1000-369X(2022)01-041-10
2021-05-10
2021-06-20
国家自然科学基金(U20A2045、32060699)、云南省重大科技专项(202002AE320001)、财政部和农业农村部:国家现代农业产业技术体系(CARS-19)、云南省茶学重点实验室开放基金项目(2020YNCX004)
刘玉飞,男,研究实习员,主要从事茶树资源改良研究,chaye18@163.com。*通信作者:chenlinbo2002@sina.com
(责任编辑:赵锋)

