基于UPLC技术解析金萱×紫娟F1分离群体代谢物的遗传变异
刘庆帅,璩馥榕,魏梦园,钟红,王熠,陈亮,金基强*
基于UPLC技术解析金萱×紫娟F1分离群体代谢物的遗传变异
刘庆帅1,2,璩馥榕1,2,魏梦园1,钟红1,2,王熠1,2,陈亮1,金基强1*
1. 中国农业科学院茶叶研究所/国家茶树改良中心/农业农村部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081
为创制高甲基化儿茶素茶树新种质,以金萱和紫娟为亲本构建了一个F1代分离群体,并通过建立一种超高效液相色谱法,对群体内各单株的代谢物含量及其遗传变异情况进行分析。研究发现,群体中多数代谢物含量分布符合正态偏陡分布,变异系数在20%~30%,且均存在一定数量的超亲个体,并从中筛选出9份高甲基化儿茶素等富含功能成分的优异单株。同时,结果显示多数代谢物含量在秋季高于春季,且儿茶素总量随叶片紫化程度加深而减少。本研究建立的超高效液相色谱法,为今后鉴定和筛选优异茶树种质资源和育种材料提供了一种更高效的测定方法;对金萱×紫娟F1分离群体生化组分的遗传变异研究也为今后高功能成分育种和通过正向遗传学发掘调控相关性状的基因提供了重要基础。
茶树;超高效液相色谱法;F1分离群体;代谢物;遗传变异
茶树是我国主要经济作物之一,富含多种生物活性物质,如茶氨酸、儿茶素、嘌呤生物碱、酚酸、水解单宁等,这些物质对茶树品质的形成具有重要意义[1-3]。研究发现,当儿茶素发生甲基化后形成以表没食子儿茶素3--(3--甲基)没食子酸酯(EGCG3″Me)为主的甲基化儿茶素,除了能够增加其亲脂性外,还具有更明显的抗过敏、抗氧化、抗癌症、抗肥胖等生理功能[4-6]。然而富含甲基化儿茶素的茶树种质资源并不多见,研究人员通过对国内200份茶树种质的EGCG3″Me含量研究发现,仅有6份种质的EGCG3″Me含量大于1%[7]。此外,吕海鹏等[8]在特异紫化茶树种质紫娟中也发现了较高含量的EGCG3″Me。Jin等[9]也在一类野生茶树白芽茶中检测到较高含量的EGCG3″Me(>8 mg·g-1)。对日本茶树品种红富贵的研究发现,不同季节其甲基化儿茶素含量有所差异,最高含量超过10 mg·g-1[10]。以往研究表明,EGCG3″Me的含量通常在适制乌龙茶品种中较高,因此为了创制高甲基化儿茶素的茶树资源,本研究以国家种质杭州茶树圃中的金萱和紫娟分别作为母本和父本,利用人工杂交的方式构建了一个富含甲基化儿茶素的F1分离群体。
对群体中代谢物的研究发现,群体中除甲基化儿茶素外还包含丰富的酚酸和水解丹宁等物质。近年来对茶树种质资源研究深入,一些栽培种中1,2,6-三没食子酰基葡萄糖(TGG)、小木麻黄碱(STR)和茶棓素(TH)的含量也相对较高[11-13]。有些野生茶树资源还富含如1,2,4,6-四没食子酰基葡萄糖(TeGG)和苦茶碱等特异代谢物[14-16]。这些物质不仅是茶汤中重要的滋味成分,而且具有良好的抗菌抗病毒等生理功能[17-18]。然而这些代谢物在以往的研究中多不被重视或被忽略,同时也缺乏一种有效的方法对其进行快速测定。因此,为更全面的对群体中代谢物的变异情况进行分析,需要建立一种能够分离并检测这些代谢物的方法。
综上所述,本研究为了筛选富含STR、TGG、EGCG3″Me等功能成分单株,在建立了一种能快速准确测定这些物质的UPLC技术基础上,对金萱×紫娟的F1代分离群体中各单株的生化组分及遗传变异情况进行了研究,并为今后采用正向遗传学发掘相关功能成分的基因及解析其分子遗传机制提供表型数据和材料。
1 材料与方法
1.1 试验仪器
Waters ACQUITY H-Class超高效液相色谱仪(配有1290 Infinity II高速泵,二极管阵列检测器,蒸发光散射检测器,工作站等)(美国Waters公司),RETSCH MM400混合冷冻混合研磨仪(德国Retsch),LABCONCO FreeZone台式冷冻干燥机(美国LABCONCO)。
1.2 化合物
表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素(EGC)、儿茶素(C)、表儿茶素(EC)购于上海甄准生物科技有限公司;TH、茶叶碱(TP)和1,3,7-三甲基尿酸(TMUA)购于购美国Sigma公司;EGCG3″Me和表儿茶素3--(3--甲基)没食子酸酯(ECG3″Me)购于日本Nagara Science公司;表没食子儿茶素4--(4--甲基)没食子酸酯(EGCG4″Me)、表儿茶素4--(4--甲基)没食子酸酯(ECG4″Me)购于北京绿百草科技发展有限公司;可可碱(TB)、苦茶碱(TCR)、STR购于上海源叶科技有限公司;咖啡碱(CAF)购于美国BioVision公司;TGG和1,2,4,6-四没食子酰基葡萄糖(TeGG)分别由中国农业科学院茶叶研究所韦康研究员和广东省农业科学院茶叶研究所乔小燕副研究员馈赠;乙腈、甲醇、甲酸等色谱纯试剂购于美国Thermofisher公司。
1.3 试验材料及样品提取
选取中国农业科学院茶叶研究所国家种质杭州茶树圃中金萱×紫娟的F1代分离群体132份单株为试验材料进行研究,其中按新梢第一叶颜色分为绿色、浅紫色、中紫色、深紫色(图1)。分别采摘2020年春季和秋季第一轮的一芽一叶新梢,迅速放入液氮中固定,利用LABCONCO冷冻干燥机处理4 d至茶叶样品干透,随后用RETSCH MM400研磨仪在25~30 r·s-1转速下研磨1~2 min将样品磨碎。准确称取(0.100 0±0.000 3)g磨碎的茶样加入10 mL的70%甲醇溶液(甲醇∶水=7∶3)超声30 min,期间每隔15 min上下摇晃5次,将提取液在4℃冰箱静置2 h后取上清液过0.22 μm有机膜,加入液相瓶中待测,每个样品均重复测定3次。
1.4 标准曲线的绘制及定量
由于TB在弱碱性条件才能溶解,而碱性条件会影响儿茶素类化合物的稳定性,因此需分别配置生物碱及多酚物质两种混合标准品。精确称量TB、TP、CAF、TCR、TMUA、TH、STR、TGG、TeGG、EGCG4″Me、EGCG3″Me、ECG4″Me、ECG3″Me的标准品分别溶于甲醇溶液配置成1 mg·mL-1的母液并绘制标准曲线。同时精确称取C(1.66 mg)、EC(1.87 mg)、EGC(2.44 mg)、ECG(1.38 mg)、GCG(1.50 mg)、EGCG(2.19 mg),溶于2 mL甲醇后配置成不同浓度梯度的标准溶液,绘制标准曲线。利用外标法对各代谢物进行定量。

注:DP:深紫色。MP:中紫色。LP:浅紫色。G:绿色。下同
1.5 色谱条件
1.5.1 色谱条件的选择
根据色谱试验,色谱柱选用美国Waters公司的ACQUITY UPLC HSS T3C18(1.8 µm,2.1 mm×100 mm)柱。检测波长为280 nm,色谱柱温度为41℃,流动相A为0.1%甲酸水溶液,流动相B为乙腈,流速为0.4 mL·min-1时,分离效率高,峰形较好。
1.5.2 方法学试验
仪器精密度测试:选用同一个标准溶液连续进样5次,根据峰面积计算相对标准偏差(Relative standard deviation,RSD)。重复性测试:称取同一个样品6份,按照样品溶液制备的方法分别测定各物质含量的峰面积,以EGCG、ECG、CAF为代表计算RSD。稳定性测试:量取同一个茶样品溶液,分别放置不同时间后进行测定,以CAF、EGCG、ECG为代表计算RSD。
1.6 数据处理
利用SPSS 20进行数据统计及分析,利用Kolmogorov-Smirnov法检验数据是否符合正态分布,并利用LSD和Duncan法进行假设检验。
2 结果与分析
2.1 超高效液相色谱方法的建立
2.1.1 色谱条件的优化
通过调整流动相的配比,最终选择洗脱梯度为0~6 min,97%A;6~9 min,90%A;9~10 min,87%A;10~14 min,80%A;14~15 min,76%A;15~16 min,97%A;16~18 min,97%A的条件,可获得最佳分离效果,混合标准样色谱图如图2所示。在之前的研究中,HPLC方法至少需要40 min才能将茶树中主要代谢物分离完毕[19]。本方法仅需要18 min就能将茶树中19种不同组分分离完毕,且每次所需溶剂从40 mL缩减至7.2 mL,时间短、效率高。
2.1.2 测定方法的线性关系与检出限
以标准样品质量(ng)对峰面积(mV·s)求出线性回归方程及线性范围,同时根据信噪比S/N=3,测得各代谢物的检出限。结果如表1所示,19种物质的回归方程的回归系数(2)均大于0.99,表明各个物质的回归模型均具有显著性。各组分检出限在0.09~3.56 ng,表明该测定方法对茶叶中19种代谢物的检测具有较高的灵敏度。
2.1.3 测定方法的精密度、重复性与稳定性
仪器精密度测试结果显示,各组分的RSD在0.39%~1.09%,表明仪器精密度良好。重复性和稳定性的测试结果显示(表2),CAF、EGCG和ECG 3种物质的RSD在0.19%~0.38%,表明样品的稳定性及重现性良好。
2.1.4 回收率测定
本研究采用标准加入法进行回收率测定,以茶叶中主要化合物为代表计算回收率,结果如表2所示,3种物质的回收率均在93.30%~94.81%,表明本方法回收率良好。
2.2 群体中各代谢物的总体变异情况
经测定发现,F1群体中EGCG4″Me、ECG4″Me、ECG3″Me、TCR、TMUN、TP和TeGG等7种代谢物的含量很低,因此主要对群体中其余的12种代谢物的变异情况进行统计,主要包含2种嘌呤生物碱(TB、CAF),7种儿茶素(C、EC、EGC、ECG、GCG、EGCG、EGCG3″Me),2种水解单宁(STR、TGG)和1种酚酸(TH),结果如表3所示。群体中嘌呤生物碱以CAF含量最高,春秋两季平均含量分别为35.12 mg·g-1和32.83 mg·g-1,TB在各单株间含量较低,平均含量约为5 mg·g-1。这两种物质含量均符合正态分布,其中TB含量呈正态偏陡分布,秋茶峰度和偏度较春茶小。群体中各类儿茶素物质的含量差异较大,其中EGCG是最丰富的儿茶素,春秋两季平均含量分别为93.94 mg·g-1和109.64 mg·g-1,其余儿茶素含量由高到低分别是ECG>EGC>EC>EGCG3″Me>C>GCG。其中C、ECG、EGC、EGCG含量符合正态分布,且多呈正态偏陡分布,而EC、GCG和EGCG3″Me含量不具有正态分布特征(<0.05)。为进一步了解群体中各代谢物含量的变异情况,通过计算F1群体中各代谢物的变异系数来代表群体中各代谢物的变异水平,结果如表3所示。群体中CAF的变异系数最小(<10%),EGCG3″Me的变异系数最高(>71%),其余大多数代谢物的变异系数均保持在20%~30%,多数代谢物的变异系数为秋季大于春季。
研究表明,对于12种代谢物而言,F1群体中均存在一定数量的超双亲个体。EGCG、CAF、EGCG3″Me和STR等4种代表性物质的含量分布如图3所示,其中CAF含量在群体中变异较小,仅有少部分单株含量高于双亲。但群体中EGCG、STR的含量在部分单株中呈现出明显的超亲优势,在春秋两季接近半数单株含量高于亲本。EGCG3″Me含量变异较大,含量最高为14.33 mg·g-1。其中春季有82个单株的EGCG3″Me含量高于双亲(3.41 mg·g-1);秋季有84个单株的EGCG3″Me含量显著高于金萱(4.43 mg·g-1),有24个单株的超过紫娟(8.55 mg·g-1);不仅如此,在F1群体中春季有19个单株的EGCG3″Me含量大于高甲基化儿茶素代表资源红富贵(6.52 mg·g-1),秋季有3个单株的含量高于红富贵(11.1 mg·g-1),春秋两季平均值含量高于红富贵(9.84 mg·g-1)的有9份单株,为高甲基化儿茶素优异新种质。
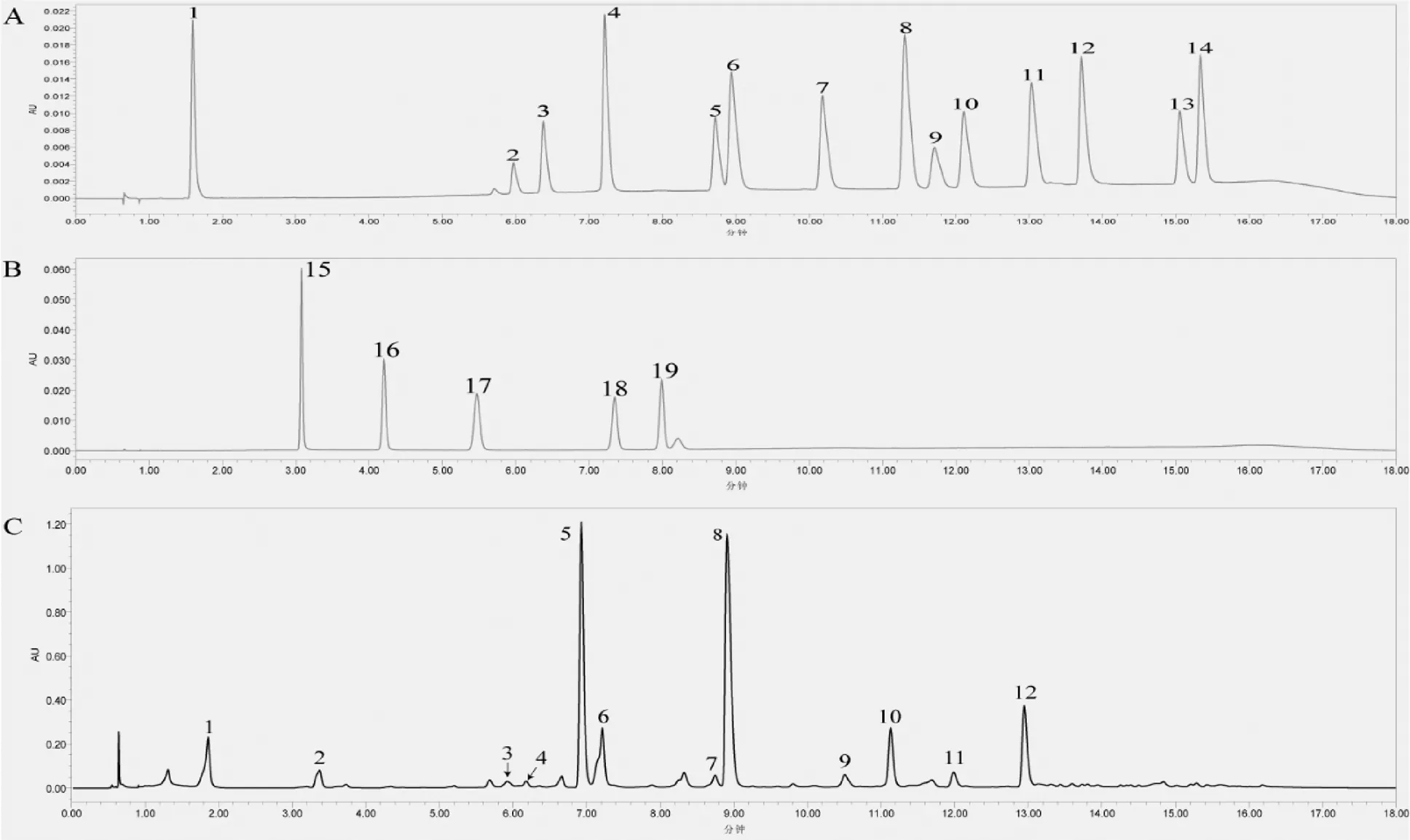
注:图A为14种多酚混标色谱图,1—14分别为茶棓素、表没食子儿茶素、儿茶素、小木麻黄碱、表儿茶素、表没食子儿茶素没食子酸酯、没食子儿茶素没食子酸、1,2,6-三没食子酰基葡萄糖、表没食子儿茶素4-O-(4-O-甲基)没食子酸酯、表没食子儿茶素3-O-(3-O-甲基)没食子酸酯、表儿茶素没食子酸酯、1,2,4,6-四没食子酰基葡萄糖、表儿茶素4-O-(4-O-甲基)没食子酸酯、表儿茶素3-O-(3-O-甲基)没食子酸酯;图B为5种嘌呤生物碱混标的色谱图,15—19分别为可可碱、茶叶碱、三甲基尿酸、苦茶碱、咖啡碱;图C为茶叶样品分离色谱图,分离物质1—12分别为茶棓素、可可碱、表没食子儿茶素、儿茶素、咖啡碱、小木麻黄碱、表儿茶素、表没食子儿茶素没食子酸酯、没食子儿茶素没食子酸、1,2,6-三没食子酰基葡萄糖、表没食子儿茶素3-O-(3-O-甲基)没食子酸酯、表儿茶素没食子酸酯
2.3 基于UPLC方法对群体季节性及叶色变异分析
F1群体中不同季节和叶色的代谢物存在差异(表3)。其中CAF含量在不同季节有显著性差异(<0.05),春季含量显著高于秋季。儿茶素作为茶树中最重要的成分之一受季节影响十分明显,除ECG外其他儿茶素秋茶含量均显著高于春茶。TGG和STR在春季的含量显著高于秋季,而TH在秋季的含量显著高于春季。研究发现,F1群体不同颜色的叶片中各代谢物的含量有所差异(表4),其中CAF、TH、EGCG3″Me在不同叶色间含量差异较小,TGG和STR两种代谢物在不同颜色叶片间有一定差异,但无明显规律。儿茶素类代谢物在不同颜色叶片中变异明显,其中C、ECG、EGC、EGCG的含量在不同叶色间差异显著,且随紫化程度加深而减少。本研究还进一步分析了总儿茶素含量与叶片颜色间的关系,结果如图4所示。整体上,在春秋两个季节绿色叶片中的总儿茶素含量明显高于紫色叶片,且随紫化程度的增加总儿茶素含量显著减少。以EGCG3″Me为标准,共筛选出9份高甲基化儿茶素的单株,其中绿色4份、浅紫色3份、中紫色2份,含量均高于甲基化儿茶素代表资源红富贵(表5)。
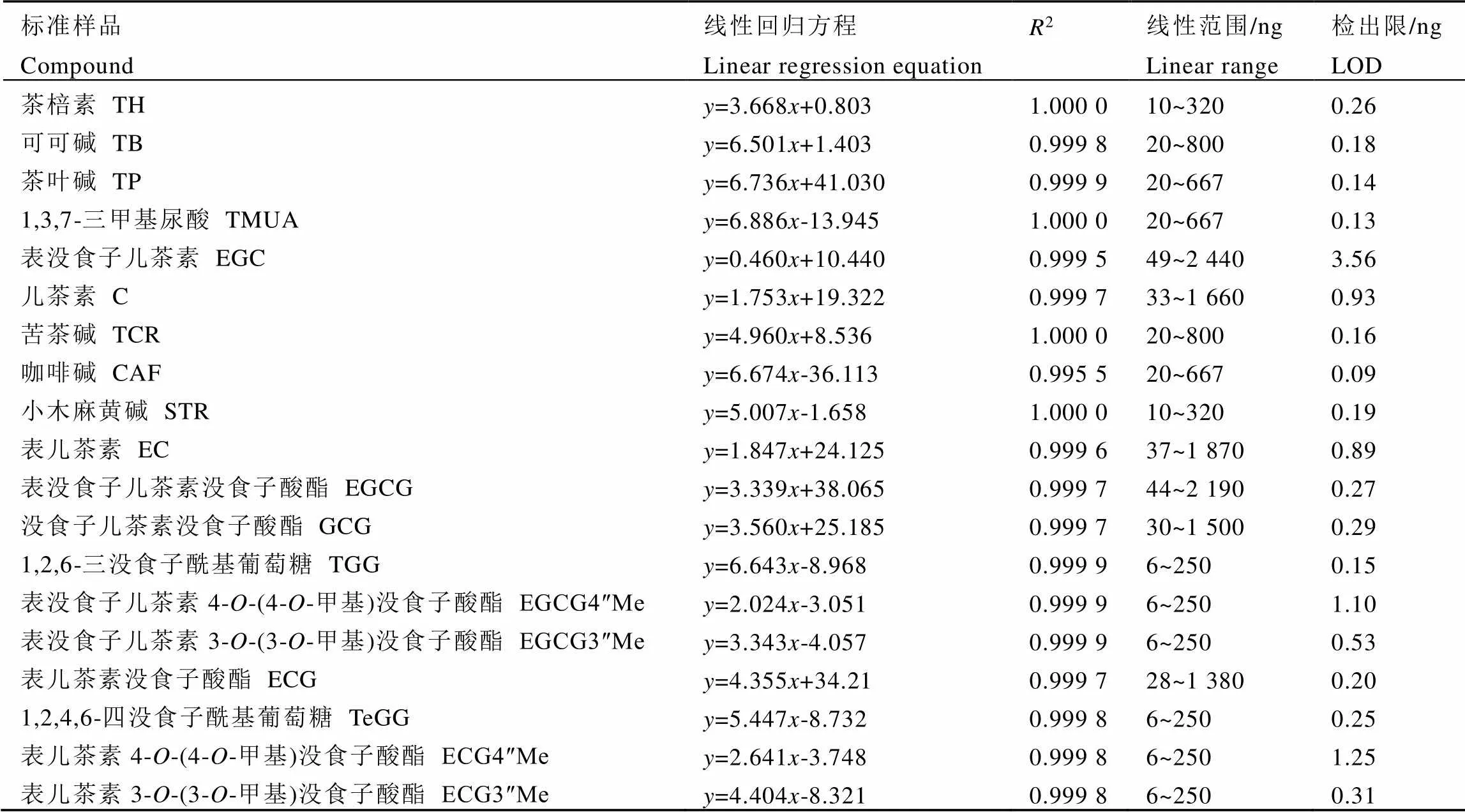
表1 茶叶中19种代谢物的线性方程及方法检出限
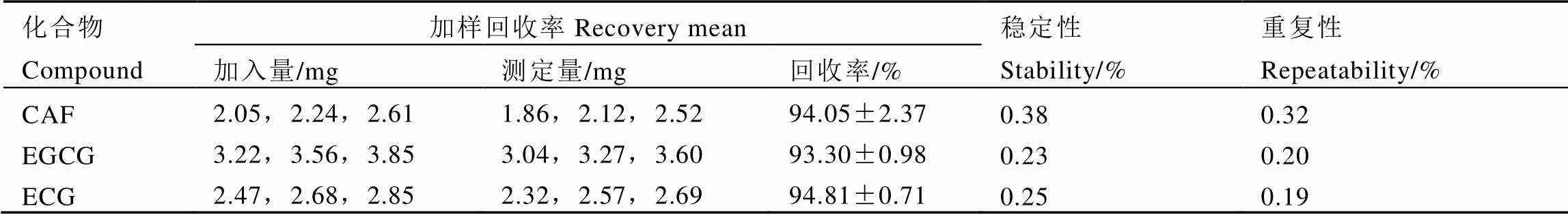
表2 茶叶主要化合物稳定性重复性及加样回收率的测定
注:表中数据为3次重复的平均值±标准差,下同
Note: Data are means±SD of three replicates, the same below
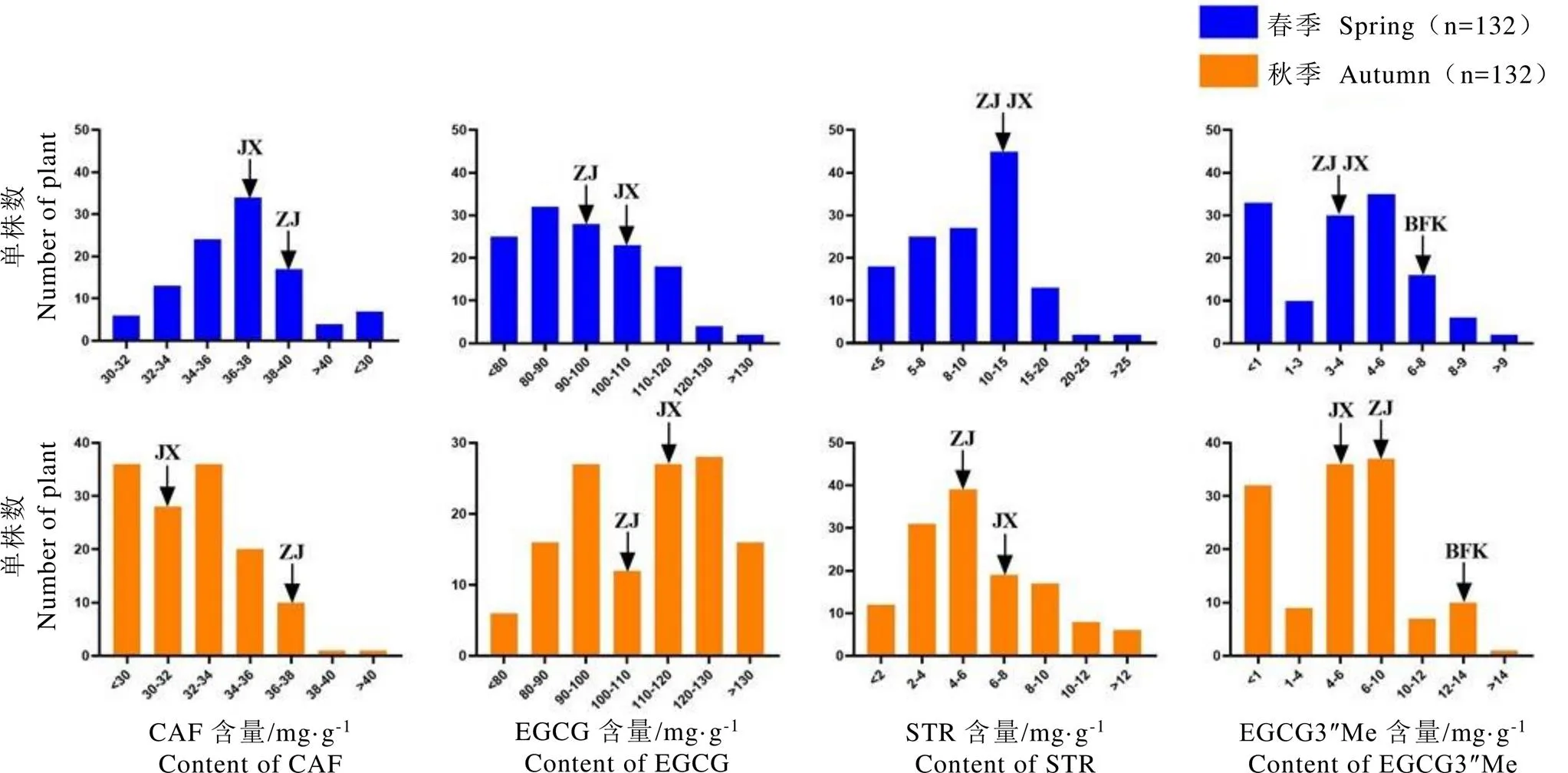
注:JX、ZJ分别为群体中的亲本金萱和紫娟,BFK为高甲基化儿茶素茶树资源红富贵
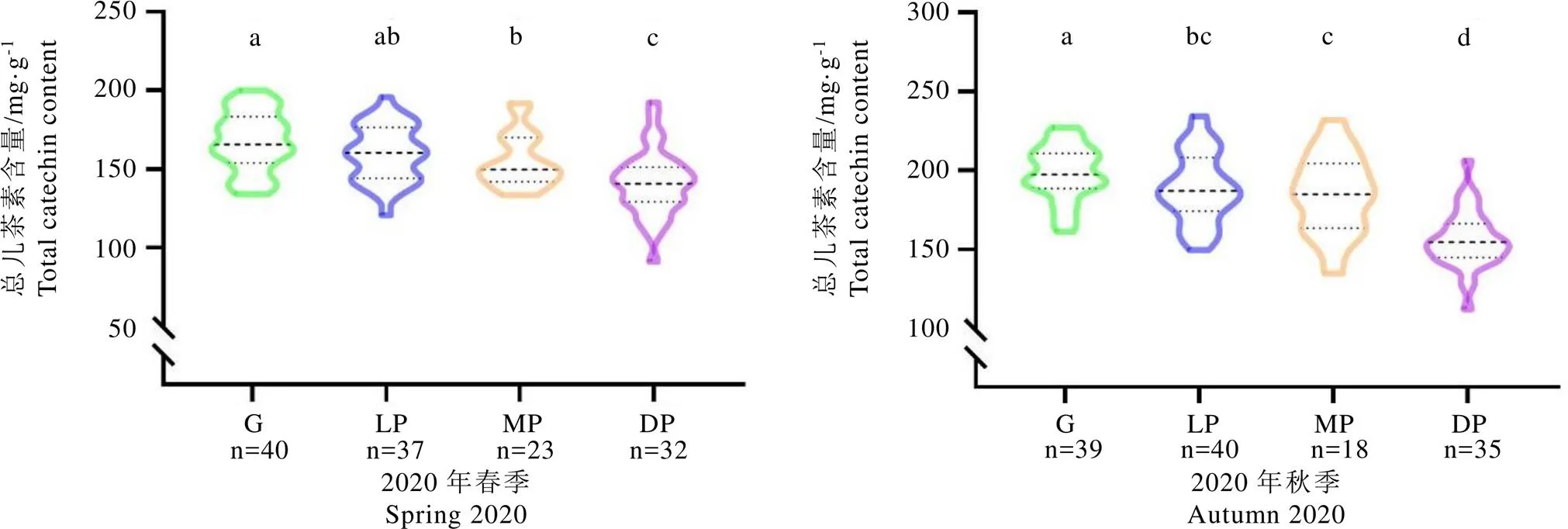
注:图上不同小写字母表示在P<0.05水平差异显著
表3 2020年亲本及F1群体各代谢物含量
Table 3 Metabolite contents of parents and F1population in 2020
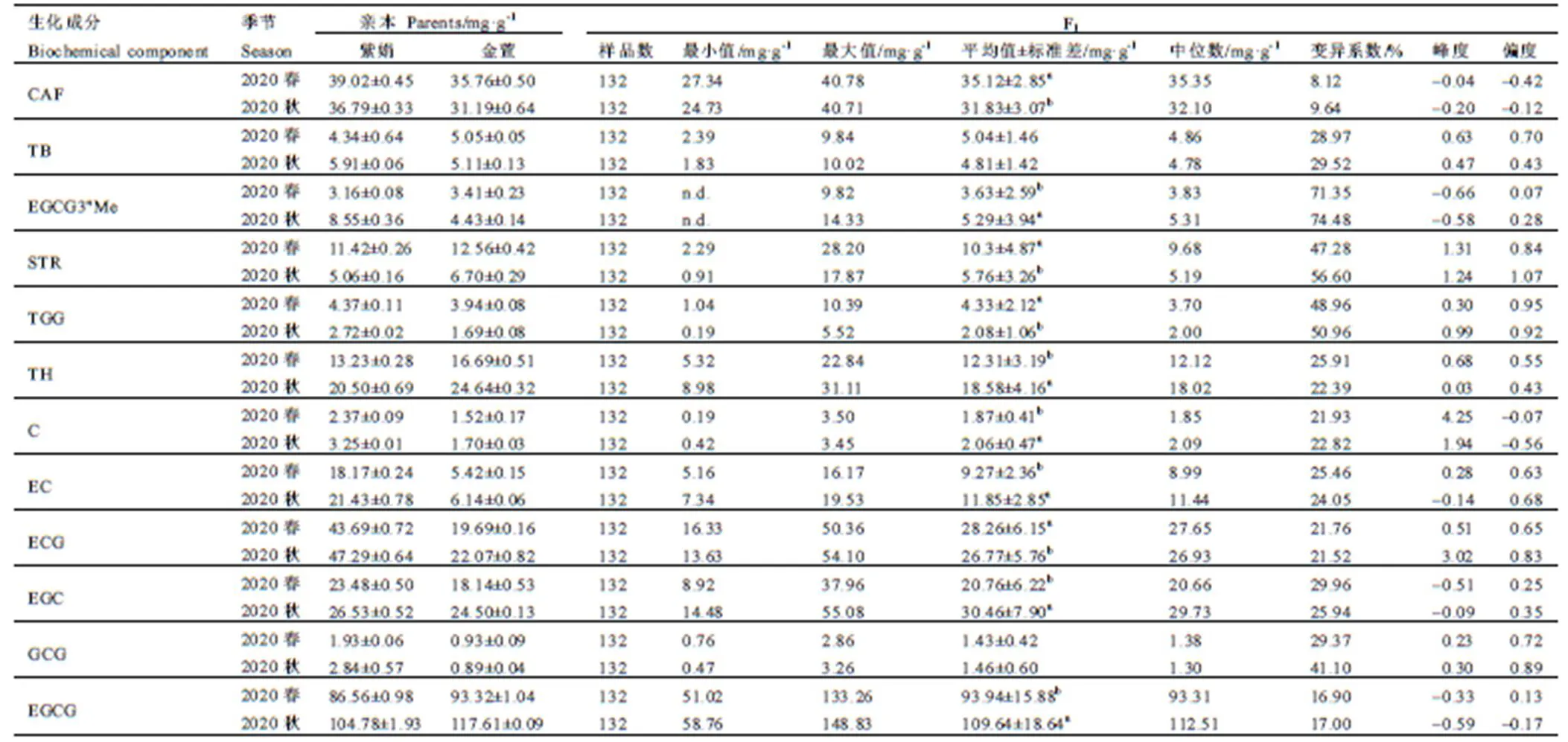
注:TH茶棓素;TB可可碱;EGC表没食子儿茶素;C儿茶素;CAF咖啡碱;STR小木麻黄碱;EC表儿茶素;EGCG表没食子儿茶素没食子酸酯;GCG没食子儿茶素没食子酸酯;ECG表儿茶素没食子酸酯;TGG三没食子酰基葡萄糖;EGCG3″Me表没食子儿茶素3--(3--甲基)没食子酸酯;n.d.指未检测出,下同。利用Kolmogorov-Smirnov法检验数据是否符合正态分布,不同季节中小写字母表示在<0.05水平差异显著
Note: TH, theogallin. TB, theobromine. EGC, epigallocatechin. C, catechin. TCR, theacrine. CAF, caffeine. STR, strictinin. EC, epicatechin. EGCG, epigallocatechin gallate. GCG, gallocatechin gallate. ECG, epicatechin gallate. TGG, 1,2,6-Tetra--galloyl-β-D-glucose. EGCG3″Me, 3″-methyl-epigallocatechin gallate. n.d. means not detected, the same below. Kolmogorov-smirnov method is used to test whether the data conform to normal distribution. Small letters in different seasons indicate significant difference at<0.05 level
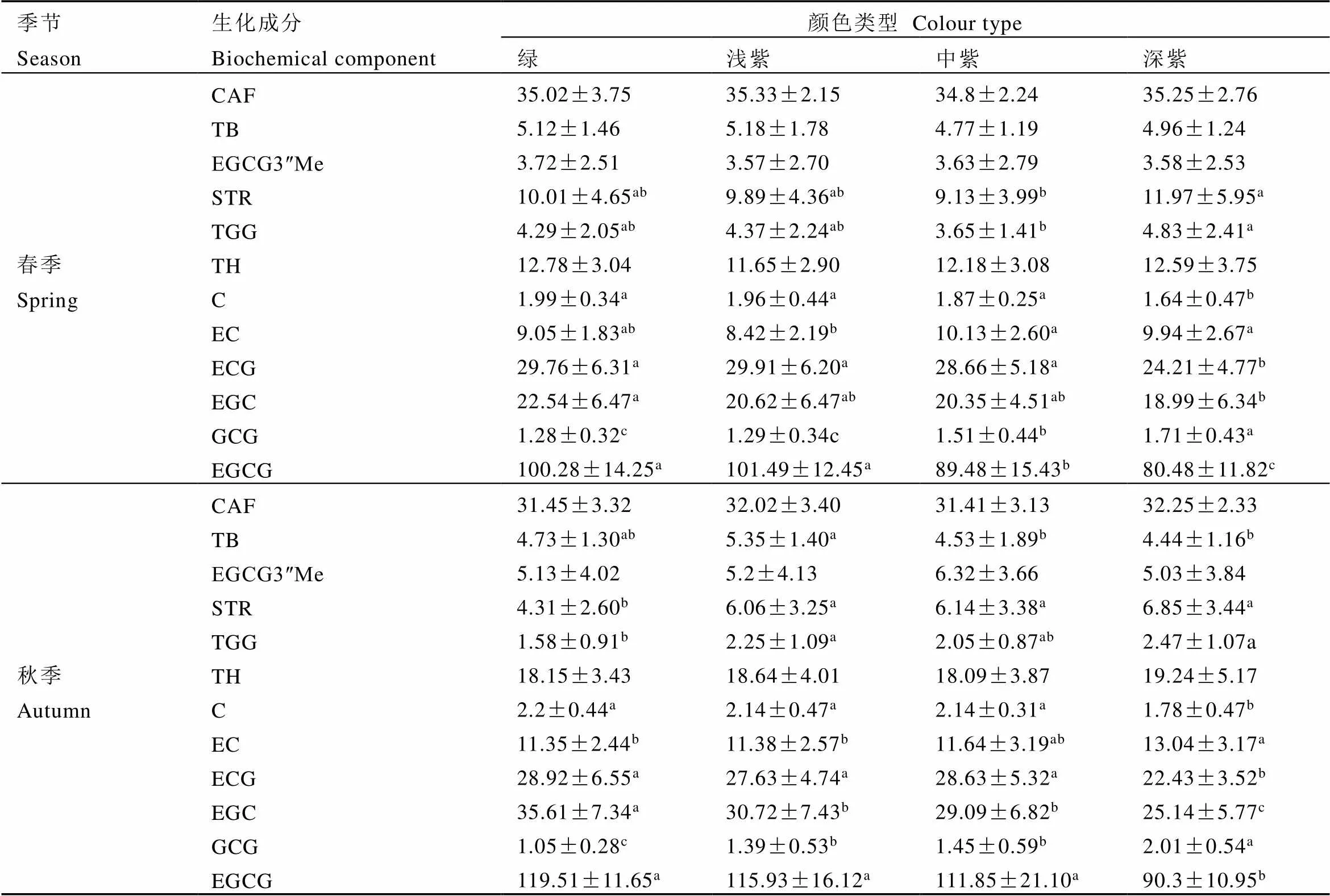
表4 2020年春秋两季4种颜色类型的代谢物含量
注:春秋季绿、浅紫、中紫、深紫的数量分别为40、37、23、32和39、40、18、35。同一季节同行中的小写字母表示在<0.05水平差异显著
Note: The quantities of green, light purple, medium purple and deep purple in spring and autumn are 40, 37, 23, 32 and 39, 40, 18, 35 respectively. Different lowercase letters in the same season indicate significant difference at<0.05
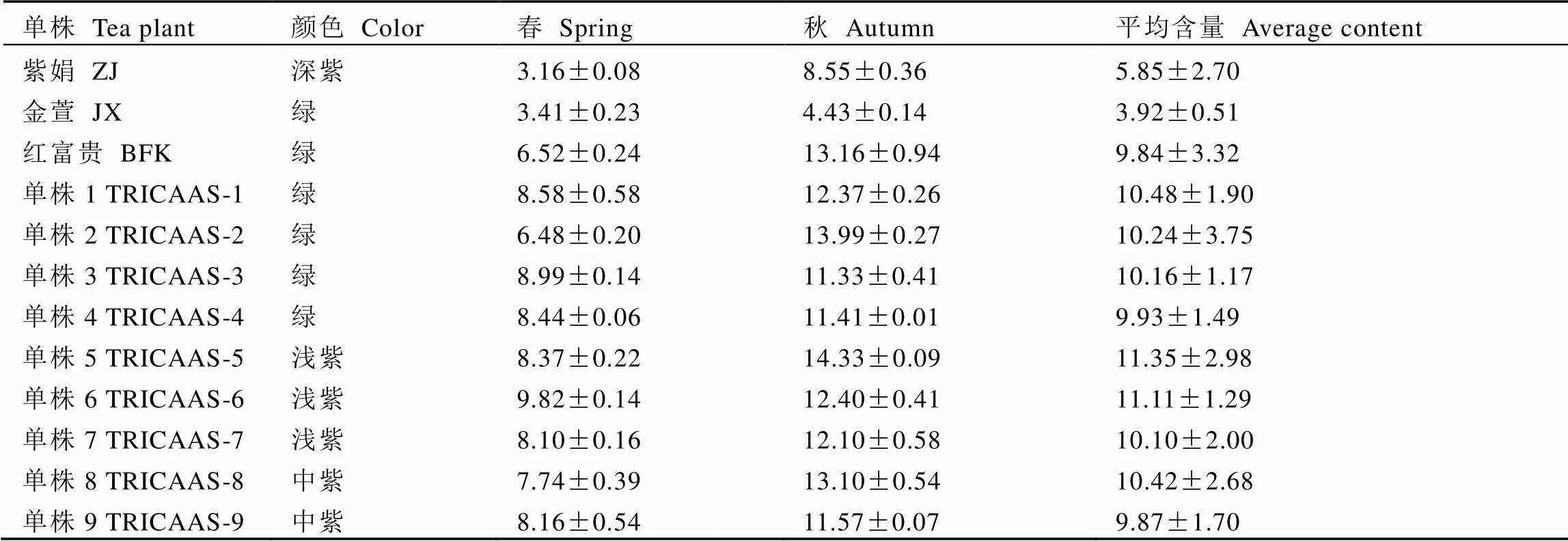
表5 2020年F1群体中优势单株的EGCG3"Me含量
3 讨论
我国是茶树种质资源最丰富的国家,这些茶树资源富含多种生物活性物质。然而在部分资源中有些物质虽然含量较高,但并未引起足够的重视。本研究建立了一种能够在18 min内分离茶叶中19种代谢物的超高效液相色谱法,稳定性和重复性试验结果表明其同时拥有较高的灵敏度和较好的重现性。该方法简单高效,能够在短时间内对茶叶中主要物质进行分离定量,不仅适用于栽培茶树常规组分的测定,同时还能对一些特异资源中所含甲基化儿茶素、TCR及TeGG等代谢物进行测定。
以金萱×紫娟的F1代分离群体为研究材料,利用该方法对群体中各组分进行分离及测定,研究表明群体中最丰富的代谢物是EGCG,其次是CAF,多数代谢物含量分布符合正态偏陡分布,秋季的峰度较春季高。对群体中各代谢物的变异情况研究显示,EGCG3″Me的变异水平最高,CAF的变异水平最低,其余多数物质变异系数多在20%~30%。各代谢物受季节变化影响明显,其中生物碱、TGG、STR的含量在春季显著高于秋季,而TH和大部分儿茶素的含量为秋季显著高于春季。导致这些代谢物呈现季节性变异可能与不同季节的环境因素有关(温度、湿度和光照)。有研究发现,与春季相比,秋季的光照时间长、强度大、光合作用效率高,因此富含更多儿茶素[20]。
甲基化儿茶素作为一种特殊的儿茶素,经证实其稳定性和吸收利用率远高于普通儿茶素。研究表明,茶树通常以-腺苷-甲硫氨酸(-adenosyl--methionine,SAM)作为甲基的供体,在甲基转移酶的催化下将甲基转移到儿茶素的酚羟基上,进而合成甲基化儿茶素[21]。目前已有研究人员利用含甲基化儿茶素的茶树品种克隆出甲基化儿茶素合成酶基因,通过原核表达的方式最终获得了甲基化儿茶素化合物[22-23]。对群体中各代谢物的研究发现,部分代谢物在群体中呈现明显的超亲优势,其中EGCG3″Me的含量变异最大,春秋两季有近半数资源的含量超过双亲。最终,本研究共筛选出9份高EGCG3″Me的优异单株,其平均含量超过高甲基化儿茶素的代表性品种红富贵,将为后续选育高甲基化儿茶素新品种提供材料基础。
茶树叶色是不同茶树品种间重要的差异性状,其中花青素的积累是芽叶呈紫色的主要因素[24]。本研究发现,F1群体中儿茶素的含量在不同叶色的单株间呈现出显著差异,随紫化程度增加而减少。这可能是由于在花青素与儿茶素合成的过程中需要相同的前体物质查尔酮,且都需要无色矢车菊素和无色飞燕草素的转化,二者在合成过程中存在一定的竞争关系所导致,最终在群体中呈现出一定的叶色变异特征[25]。
综上所述,为创制高甲基化儿茶素新种质,本研究以金萱和紫娟为亲本构建了一个F1代分离群体,基于超高效液相色谱技术,建立了一种能够在较短时间内分离茶树中19种不同代谢物的方法。分析发现,F1分离群体中多数代谢物符合正态分布,且受季节和不同叶色显著影响。多数代谢物的含量为秋茶高于春茶,总儿茶素含量随叶片紫化程度增加而减少。通过对群体中所有单株的甲基化儿茶素进行测定,共筛选出9份高甲基化儿茶素的超亲单株,为今后发掘高甲基化儿茶素的关键基因及品种选育奠定了重要基础。
[1] Yao M Z, Ma C L, Qiao T T, et al. Diversity distribution and population structure of tea germplasms in China revealed by EST-SSR markers [J]. Tree Genetics and Genomes, 2012, 8(1): 205-220.
[2] Meng X H, Li N, Zhu H T, et al. Plant resources, chemical constituents, and bioactivities of tea plants from the genussection[J]. Journal of Agricultural and Food Chemistry, 2018, 67(19): 5318-5349.
[3] Owuor P O, Chavanji A M. Caffeine contents of clonal tea; seasonal variations and effects of plucking standards under Kenyan conditions [J]. Food Chemistry, 1986, 20(3): 225-233.
[4] Jin J Q, Ma J Q, Ma C L, et al. Determination of catechin content in representative Chinese tea germplasms [J]. Journal of Agricultural and Food Chemistry, 2014, 62(39): 9436-9441.
[5] Kawase M, Wang R, Shiomi T, et al. Antioxidative activity of (-)-epigallocatechin-3-(3″--methyl)gallate isolated from fresh tea leaf and preliminary results on its biological activity [J]. Bioscience, Biotechnology and Biochemistry, 2000, 64(10): 2218-2220.
[6] Kurita I, Maeda-Yamamoto M, Tachibana H, et al. Antihypertensive effect of Benifuuki tea containing-methylated EGCG [J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 1903-1908.
[7] 吕海鹏, 谭俊峰, 林智. 茶树种质资源EGCG3"Me含量及其变化规律研究[J]. 茶叶科学, 2006, 26(4): 310-314.
Lv H P, Tan J F, Lin Z. Study on the content of EGCG3"Me in different tea germplasms and its changes [J]. Journal of Tea Science, 2006, 26(4): 310-314.
[8] 吕海鹏, 杨停, 梁名志, 等. “紫娟”茶中的EGCG3"Me成分研究[J]. 现代食品科技, 2014, 30(9): 286-296.
Lv H P, Yang T, Liang M Z, et al. Study of EGCG3"Me content in Zijuan tea [J]. Modern Food Science and Technology, 2014, 30(9): 286-296.
[9] Jin J Q, Jiang C K, Yao M Z, et al. Baiyacha, a wild tea plant naturally occurring high contents of theacrine and 3″-methyl-epigallocatechin gallate from Fujian, China [J]. Scientific Reports, 2020, 10(1): 9715. doi: 10.1038/s41598-020-66808-x.
[10] 山本万, 佐野満, 松田奈, 等. 茶の品種,摘採期と製造法によるエピガロカテキン3--(3--メチル)ガレート含量の変動[J]. 日本食品科学工学会誌, 2001, 48(1): 64-68.
Mari maeda-yamamoto, Mitsuakisano, Nahomi matsuda, et al. The Change of epigallocatechin-3--(3--methyl) gallate content in tea of different varieties, tea seasons of crop and processing method [J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2001, 48(1): 64-68.
[11] Li J H, Nesumi A, Shimizu K, et al. Chemosystematics of tea trees based on tea leaf polyphenols as phenetic markers [J]. Phytochemistry, 2010, 71(11): 1342-1349.
[12] 张颖君, 杨崇仁, 曾恕芬, 等. 白莺山古茶的化学成分分析与栽培茶树的起源[J]. 云南植物研究, 2010, 32(1): 77-82.
Zhang Y J, Yang C R, Zeng S F, et al. Chemical Analysis of Old Tea Trees in Bai-Ying-Shan mountain and the origin of cultivated tea [J]. Acta Botanica Yunnanica, 2010, 32(1): 77-82.
[13] Wei K, He H, Li H, et al. Gallotannin 1,2,6-tri--galloyl--D-glucopyranose: its availability and changing patterns in tea () [J]. Food Chemistry, 2019, 296: 40-46.
[14] Lu J L, Wang D M, Shi X G, et al. Determination of purine alkaloids and catechins in different parts ofvar.by HPLC-DAD/ESI-MS/MS [J]. Journal of the Science of Food and Agriculture, 2009, 89(12): 2024-2029.
[15] Wang S L, Chen J D, Ma J Q, et al. Novel insight into theacrine metabolism revealed by transcriptome analysis in bitter tea (Kucha,) [J]. Scientific Reports, 2020, 10: 6286. doi: 10.1038/s41598-020-62859-2.
[16] Dai X, Liu Y, Zhuang J, et al. Discovery and characterization of tannase genes in plants: roles in hydrolysis of tannins [J]. New Phytologist, 2020, 226(4): 1104-1116.
[17] Kaneko S, Kumazawa K, Masuda H, et al. Molecular and sensory studies on the umami taste of Japanese green tea [J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2688-2694.
[18] Shirmohammadli Y, Efhamisisi D, Pizzi A. Tannins as a sustainable raw material for green chemistry: a review [J]. Industrial Crops and Products, 2018, 126: 316-332.
[19] Maeda Yamamoto M, Ema K, Monobe M, et al. Epicatechin-3--(3″--methyl)-gallate content in various tea cultivars (L.) and its in vitro inhibitory effect on histamine release [J]. Journal of Agricultural and Food Chemistry, 2012, 60(9): 2165-2170.
[20] Yao L H, Caffin N, D'arcy B, et al. Seasonal variations of phenolic compounds in australia-grown tea () [J]. Journal of Agricultural and Food Chemistry, 2005, 53(16): 6477-6483.
[21] 费冬梅. 甲基化EGCG的酶法合成研究[D]. 北京: 中国农业科学院, 2011. Fei D M. Synthesis of methylated epigallocatechin gallate (EGCG) by-methyltransferase from[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011
[22] Zhang Y, Lv H P, Ma C Y, et al. Cloning of a caffeoyl-coenzyme A-methyltransferase fromand analysis of its catalytic activity [J]. Journal of Zhejiang University-science B, 2015, 16(2): 103-112.
[23] Kirita M, Honma D, Tanaka Y, et al. Cloning of a novel-methyltransferase fromand synthesis of-methylated EGCG and evaluation of their bioactivity [J]. Journal of Agricultural Food Chemistry, 2010, 58(12): 7196-7201.
[24] Hu J G, Zhang L J, Sheng Y Y, et al. Screening tea hybrid with abundant anthocyanins and investigating the effect of tea processing on foliar anthocyanins in tea [J]. Folia Horticulturae, 2020, 32(2): 279-290.
[25] Liu Y J, Zhao G F, Li X, et al. Comparative analysis of phenolic compound metabolism among tea plants in the sectionof the genus[J]. Food Research International, 2020, 135: 109276. doi: 10.1016/j.foodres.2020.109276.
The Genetic Variation of the Chemical Components of the ‘Jinxuan’בZijuan’ F1Segregating Population Based on UPLC
LIU Qingshuai1,2, QU Furong1,2, WEI Mengyuan1, ZHONG Hong1,2, WANG Yi1,2, CHEN Liang1, JIN Jiqiang1*
1. Tea Research Institute of the Chinese of Agricultural Sciences, National Center for Tea Improvement, Key Laboratory of Tea Biology and Resource Utilization, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agriculture Science, Beijing 100081, China
In order to innovate new germplasms with high methylated catechins, a F1segregating population was constructed with ‘Jinxuan’ and ‘Zijuan’ as parents. At the same time, an ultra-high performance liquid chromatography method was established to analyze the metabolite content and genetic variation of individual plants in the population. Our study found that most metabolites conformed to the normal and slightly steep distribution. The coefficient of variations were between 20% and 30%. There was a clear heterosis and several individual plants rich in methylated catechins were selected from the population. It also found that the contents of most metabolites in autumn were higher than those in spring, and the amount of total catechins decreased with the purple degree of leaves. The UPLC technology established in this study would provide a more efficient determination method for the future identification and screening of elite tea germplasms and breeding materials. The genetic variation of the chemical components of the ‘Jinxuan’ בZijuan’ F1segregating population identified in this study also provided an important foundation for the high functional component breeding and discovery of genes governing traits through forward genetics.
tea, ultra high performance liquid chromatography, F1population, metabolites, genetic variation
S571.1
A
1000-369X(2022)01-029-12
2021-10-09
2021-11-12
浙江省自然科学基金(LZ22C160008)、国家自然科学基金(31670685)、中国农业科学院科技创新工程(CAASASTIP-2017-TRICAAS)、财政部和农业农村部:现代农业产业技术体系(CARS-19)、中央科研院所基本科研业务费(1610212018008)
刘庆帅,男,硕士研究生,主要从事茶树资源育种与遗传改良研究。*通信作者:xyjjq@tricaas.com
(责任编辑:黄晨)

