茯砖茶改善2型糖尿病小鼠代谢紊乱的效果研究
代昕玥,葛炳钢,张旭雯,刘文武,段继春,傅冬和,3*
茯砖茶改善2型糖尿病小鼠代谢紊乱的效果研究
代昕玥1,2,葛炳钢1,2,张旭雯1,2,刘文武1,4,段继春5,傅冬和1,2,3*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 湖南省植物功能成分利用协同创新中心,湖南 长沙 410128;4. 湖南省农业科学院茶叶研究所,湖南 长沙 410125;5. 湖南德康茶业科技有限公司,湖南 长沙 410001
为探究茯砖茶能否通过调节肠道微生物群改善2型糖尿病(T2DM)的代谢紊乱,建立T2DM小鼠模型,给予400 mg·kg-1茯砖茶水提取物灌胃干预,观测T2DM小鼠的饮食量、饮水量、空腹体重、空腹血糖、糖耐量等日常指标,血清中胰岛素(INS)、总胆汁酸(TBA)、总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、白介素-1(IL-1)、肿瘤坏死因子-(TNF-)水平,以及胰腺、回肠的病理学变化,并对小鼠粪便进行了肠道菌群16 SrRNA测序。结果显示,茯砖茶显著改善了小鼠的糖脂代谢紊乱和炎症,明显修复了T2DM导致的胰腺和回肠损伤。茯砖茶能显著降低T2DM引起的疣微菌门相对丰度异常增加,恢复肠道微生物群多样性。茯砖茶能增加肠道厚壁菌门、、肠杆菌属、、双歧杆菌属、、、、及等有益菌,说明茯砖茶可通过增加肠道有益菌群,调节肠道菌群失调,进而改善T2DM的代谢紊乱。
茯砖茶;2型糖尿病;肠道菌群
2型糖尿病(Type 2 diabetes mellitus,T2DM)是一种以高血糖和代谢紊乱为特征的疾病[1],其发病率在不断上升,给医疗服务带来越来越大的负担。据糖尿病国际联盟(IDF)估计,到2045年,将有6.93亿人受到T2DM的影响[2]。T2DM会导致肠道菌群紊乱,持续的肠道菌群失调又将导致T2DM的恶性发展,因此,调节肠道菌群是防治T2DM的有效措施。在健康的肠道微生物群遭到破坏时,补充刺激消化道有益细菌生长的物质(益生元)是一种有效的治疗方法[3-4]。近年来,茶水提取物已被证实可作用于肠道菌群,可能具有益生元的潜力。绿茶茶汤可降低高脂小鼠肠道中厚壁菌门与拟杆菌门比例[5];青砖茶水提取物能增加正常小鼠肠道中乳酸菌、双歧杆菌等有益菌[6];普洱茶水提取物可显著改善非酒精性脂肪肝导致的肠道菌群紊乱[7];武夷岩茶水提取物可有效改善糖尿病导致的肠道菌群紊乱[8]。此外,乌龙茶、红茶和绿茶水提取物也可调节肥胖小鼠的肠道菌群紊乱,增加与降脂有关的有益菌群[9]。
茯砖茶(Fu brick tea)是一种具有多种活性成分的黑茶[10],其水提取物可改善T2DM小鼠糖脂代谢紊乱[11],并可有效调节高脂小鼠的肠道菌群紊乱[12]。已有研究报道茯砖茶在体外可促进肠道菌群有益菌生长[13],但鲜见关于茯砖茶对T2DM小鼠肠道菌群失调的研究。本研究拟通过高脂高糖饲料联合链脲佐霉素(Streptozocin,STZ)建立T2DM小鼠模型,通过茯砖茶干预,探讨茯砖茶是否能通过调节肠道菌群改善T2DM的代谢紊乱,为进一步研究茯砖茶改善T2DM提供更多证据,以期促进茯砖茶功能成分的开发利用。
1 材料与方法
1.1 材料
茯砖茶样品(2016年生产)由长沙德康生物科技有限公司提供;链脲佐霉素购自美国sigma公司;普通维持饲料及高脂高糖饲料(65%大小鼠维持饲料+10%猪油+20%蔗糖+2.5%胆固醇+1%胆酸钠+1%矿物质混合物+0.5%纤维素混合物)均购自北京博爱港生物技术有限公司。
1.2 仪器和设备
Hettich MIKRO-22R低温高速离心机、多功能酶标仪,美国Thermo公司;稳择易型血糖仪,强生医疗器材有限公司;病理切片机,上海徕卡仪器有限公司;石蜡包埋机,武汉俊杰电子有限公司。
1.3 茯砖茶成分检测及提取
茯砖茶粉碎过12目筛,用沸水浸提两次(茶水比1∶10),过滤合并滤液,减压真空浓缩后真空冷冻干燥,得到水提取物冻干粉。茯砖茶水提取物冻干粉的可溶性糖通过硫酸蒽酮法测定[14]、黄酮采用三氯化铝比色法测定[15]、多酚采用福林酚法测定[16]。茯砖茶冻干粉中可溶性糖含量为(22.27±1.33)%,多酚含量为(16.47±1.14)%,黄酮类化合物含量为(7.74±0.46)%。
1.4 动物实验设计
30只体质量为(13.0±2.0)g的3周龄昆明雄性小鼠,购自湖南斯莱克景达实验室动物有限公司。饲养环境温度为23~25℃,12 h明暗交替。所有小鼠均自由饮食,经过1周适应性喂养后,10只小鼠被随机分为正常对照组(Control),喂养普通饲料。其他20只小鼠被分为造模组,进行4周高脂高糖饮食(35%脂肪,50%碳水化合物,15%蛋白质)喂养。4周后,造模组小鼠在隔夜禁食16 h后,腹腔注射SZT溶液(120 mg·kg-1,柠檬酸缓冲液为溶剂,pH 4.2~4.5)。正常对照组小鼠注射等量的柠檬酸钠缓冲液。3 d后,通过尾静脉采血,用血糖仪检测禁食8 h后的血糖(FBG)。具有FBG≥11.1 mmol·L-1并维持3 d的小鼠被认为是T2DM小鼠[17]。将20只T2DM小鼠随机分为模型组(Model)和茯砖茶组(FBT)。对照组和模型组的小鼠每天灌胃补充0.3 mL蒸馏水。茯砖茶组小鼠每天灌胃茯砖茶水提取物(400 mg·kg-1),剂量参照文献[11-12](按黑茶每天推荐量10 g计算,本研究采用剂量相当于人体推荐饮茶量9倍)。T2DM小鼠在试验结束前一直以高脂高糖饮食喂养。在茯砖茶灌胃干预期间,每天记录饮水量和饮食量,每周记录体重和空腹血糖。经过4周茯砖茶干预后,采集小鼠粪便样本。所有小鼠在隔夜禁食后用4%水合氯醛麻醉解剖。收集血液、胰腺和回肠供进一步分析,并将胰腺和回肠组织固定在4%多聚甲醛中。
1.5 腹腔内葡萄糖耐受性测试(IPGTT)
在小鼠白天禁食8 h后,测定第0 h空腹血糖,然后通过腹腔注射剂量为2 g·kg-1的葡萄糖,在葡萄糖处理后0.5、1 h和2 h分别测定血糖值,并计算血糖曲线下面积(AUC)[18]。
1.6 生化指标检测
血液样品在4℃下,2 500 r·min-1离心10 min,收集血清。按照酶联免疫试剂盒(武汉华美生物工程有限公司)说明书要求,测定小鼠血清中白介素1(IL-1)、肿瘤坏死因子-(TNF-)、胰岛素(INS)含量;按照生化试剂盒(南京建成生物工程研究所)说明书分别测定小鼠血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂肪蛋白(LDL-C)、高密度脂肪蛋白(HDL-C)及总胆汁酸(TBA)含量。胰岛素抵抗指数(HOMA-IR)根据稳态模型评估计算,计算公式为:HOMA-IR=[空腹血清胰岛素含量×空腹血糖(FBG)]÷22.5。
1.7 病理切片制作
小鼠胰腺和回肠组织固定24 h,按以下步骤进行石蜡切片制作及苏木精-伊红(H&E)染色:(1)将组织在75%、80%、85%、90%、95%和100%浓度梯度酒精中脱水,然后放入醇苯溶液及二甲苯溶液,至组织呈透明状态;(2)将透明的组织浸蜡包埋切片,切片厚度为4 μm;(3)依次将切片放入二甲苯溶液和100%、95%、90%、85%、80%、75%浓度梯度酒精溶液中脱蜡,然后水洗;(4)苏木素染色:组织切片放入苏木素染液染色,水洗后放入盐酸酒精分化,然后流水冲洗;(5)伊红染色:将冲洗好的组织切片依次放入85%、90%、95%浓度梯度的酒精脱水,然后放入伊红染液中染色;(6)脱水封片:切片依次放入无水乙醇脱水,放入二甲苯中透明,中性树胶封片;(7)显微镜镜检,图像采集分析。
1.8 肠道菌群16 SrRNA测序
提取小鼠粪便样品总DNA后,根据保守区设计引物,上游引物序列为5'-CCTACGGG NGGCWGCCAG-3',下游引物序列为5'-GACTACHVGGGTATCTAATCC-3',在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina Novaseq 6000进行测序。高通量测序得到的原始图像数据文件,经碱基识别分析转化为原始测序序列。测序由北京百迈客生物科技有限公司完成。
1.9 数据分析
16 S rRNA测序数据使用BMKCloud(www.biocloud.net)进行分析。数值通过平均数±平均标准偏差(SD)或平均数表示,数据使用单因素方差分析(ANOVA)和邓肯检验进行分析比较各组之间的差异,<0.05表示具有统计学意义。所有其他分析均使用SPSS 23.0软件。
2 结果与分析
2.1 茯砖茶对T2DM小鼠糖代谢的改善作用
T2DM小鼠血糖的测定结果如表1和图1所示。与对照组相比,T2DM小鼠体重显著减少,饮食量和饮水量显著增加(<0.05),空腹血糖也显著增加(<0.05),表现出明显的“三多一少”症状;IPGTT结果显示,T2DM小鼠糖耐量显著受损,胰岛素抵抗指数显著提高(<0.05)。胰腺病理结果显示,T2DM小鼠胰岛出现了严重的萎缩变形及炎性浸润。与模型组相比,茯砖茶干预显著改善了T2DM小鼠“三多一少”的症状(<0.05)。此外,在茯砖茶干预下,T2DM小鼠胰岛素抵抗指数和糖耐量得到了改善(<0.05),胰岛萎缩变形和炎性浸润的程度减轻。这些结果表明,茯砖茶有效改善了小鼠T2DM的症状,抑制了T2DM病理指标的发展。
2.2 茯砖茶对T2DM小鼠血清TBA及血脂的影响
各组小鼠的血清TBA和血脂指标的测定结果如表2所示,与对照组相比,模型组血清TBA水平显著升高,而茯砖茶组血清TBA水平与模型组相比显著降低(<0.05),与对照组无显著差异。与对照组相比,模型组血脂异常,TG、TC、LDL-C含量显著升高,HDL-C含量显著降低(<0.05);与模型组相比,茯砖茶干预后的T2DM小鼠血脂的各项指标都得到了显著的改善(<0.05)。结果说明,茯砖茶在一定程度改善了T2DM小鼠脂质代谢紊乱。
2.3 茯砖茶对T2DM小鼠炎性因子及回肠黏膜损伤的影响
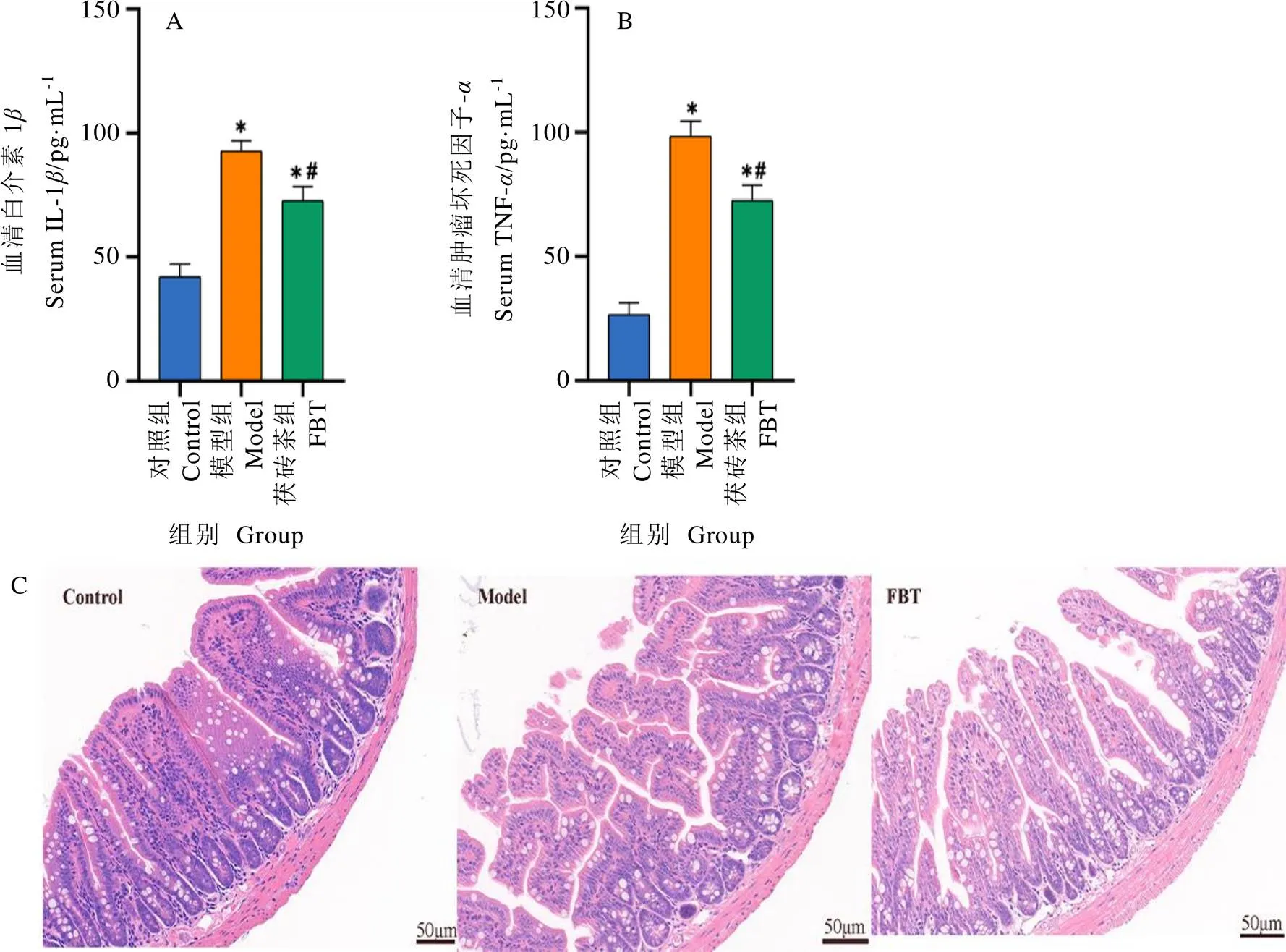
茯砖茶对T2DM小鼠炎性因子的影响结果如图2-A和2-B所示,回肠病理学变化如图2-C所示。T2DM导致血清炎性因子IL-1和TNF-水平显著升高,与模型组相比,茯砖茶显著降低了炎性因子水平(<0.05)。回肠病理结果显示,T2DM导致部分回肠绒毛脱落断裂,黏膜完整性遭到破坏,而茯砖茶干预减轻了回肠黏膜损伤,保护了其结构完整性。说明茯砖茶缓解了机体炎症,修复了回肠黏膜损伤。

表1 4周干预期内各组小鼠日常指标记录
注:*表示与对照组相比,差异显著(<0.05);#表示与模型组相比,差异显著(<0.05)
Note: * represents a significant difference compared to the control group,<0.05. # represents a significant difference compared to the model group,<0.05
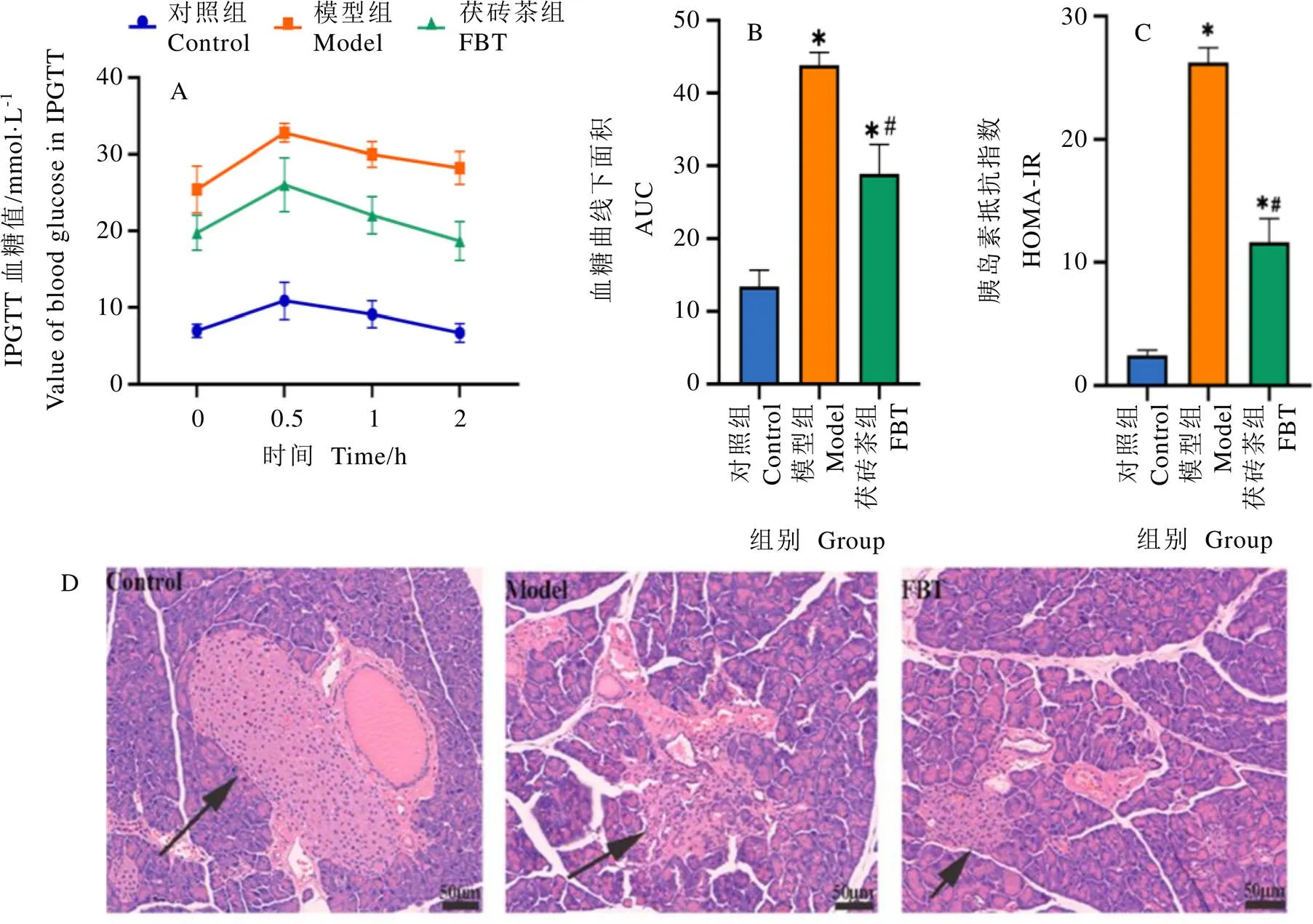
注:A 为IPGTT血糖曲线;B为血糖曲线下面积;C为胰岛抵抗指数;D为小鼠胰腺病理学变化(黑色箭头表示胰岛);*表示与对照组相比,差异显著(P<0.05);#表示与模型组相比,差异显著(P<0.05)
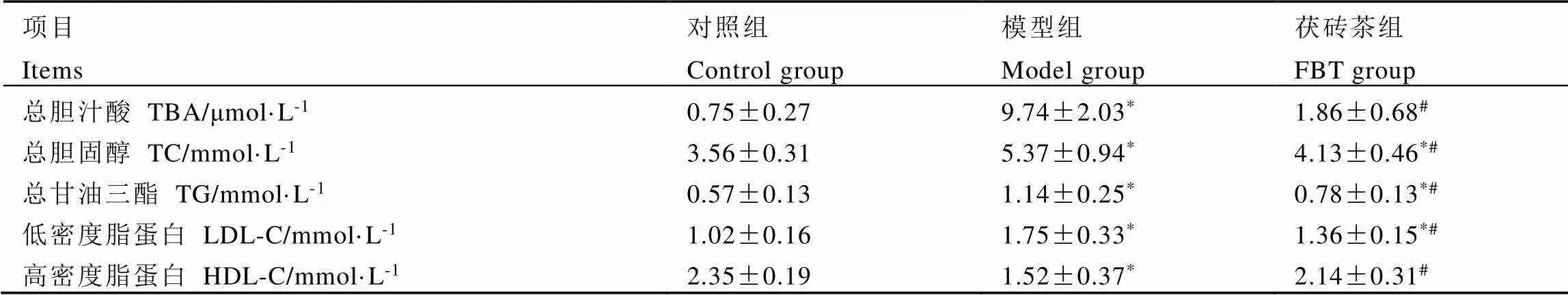
表2 4周干预后小鼠总胆汁酸和血脂指标的含量
注:*表示与对照组相比,差异显著(<0.05);#表示与模型组相比,差异显著(<0.05)
Note: * represents a significant difference compared to the control group,<0.05. # represents a significant difference compared to the model group,<0.05
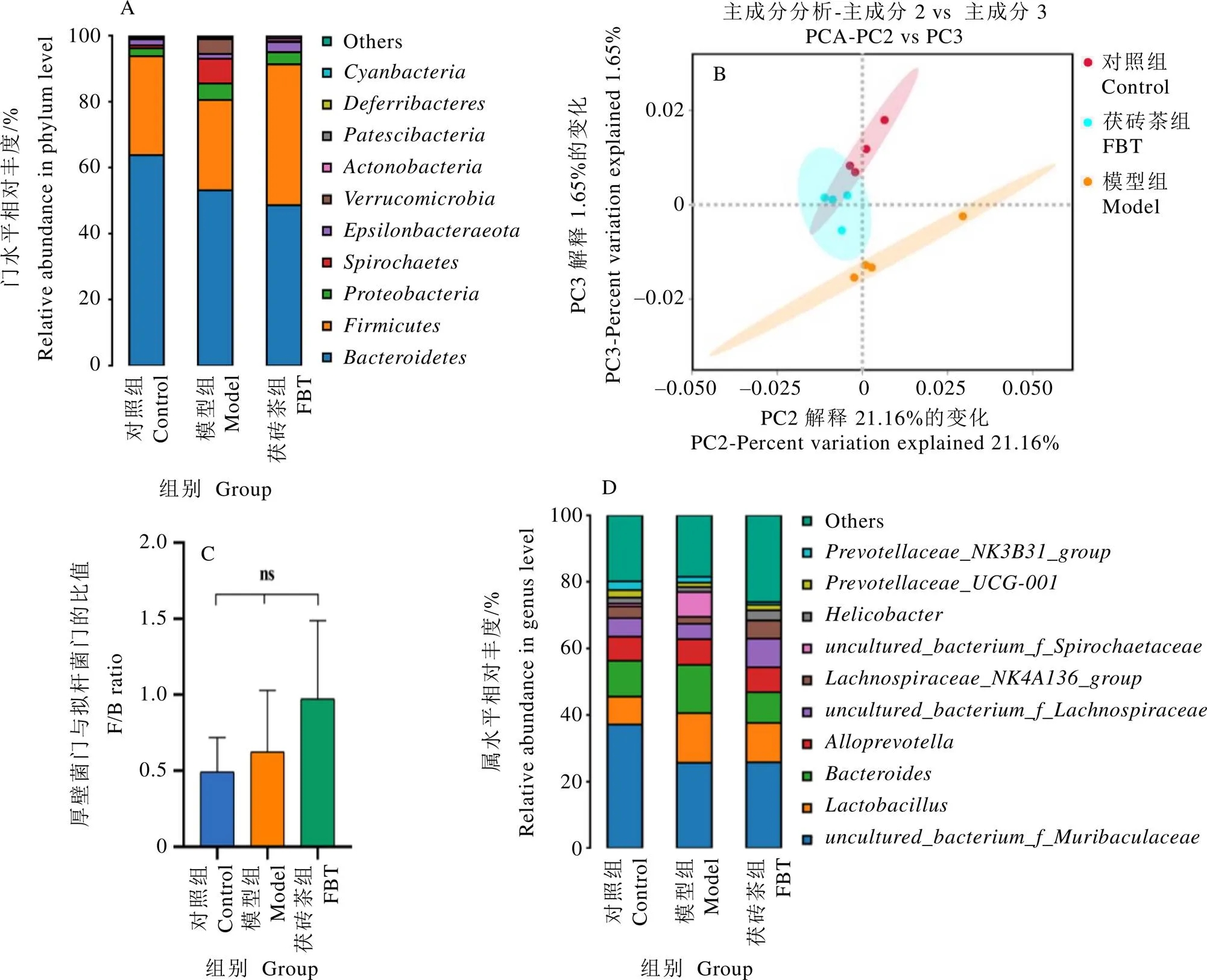
2.4 茯砖茶对T2DM小鼠肠道菌群的调节作用
2.4.1微生物多样性分析
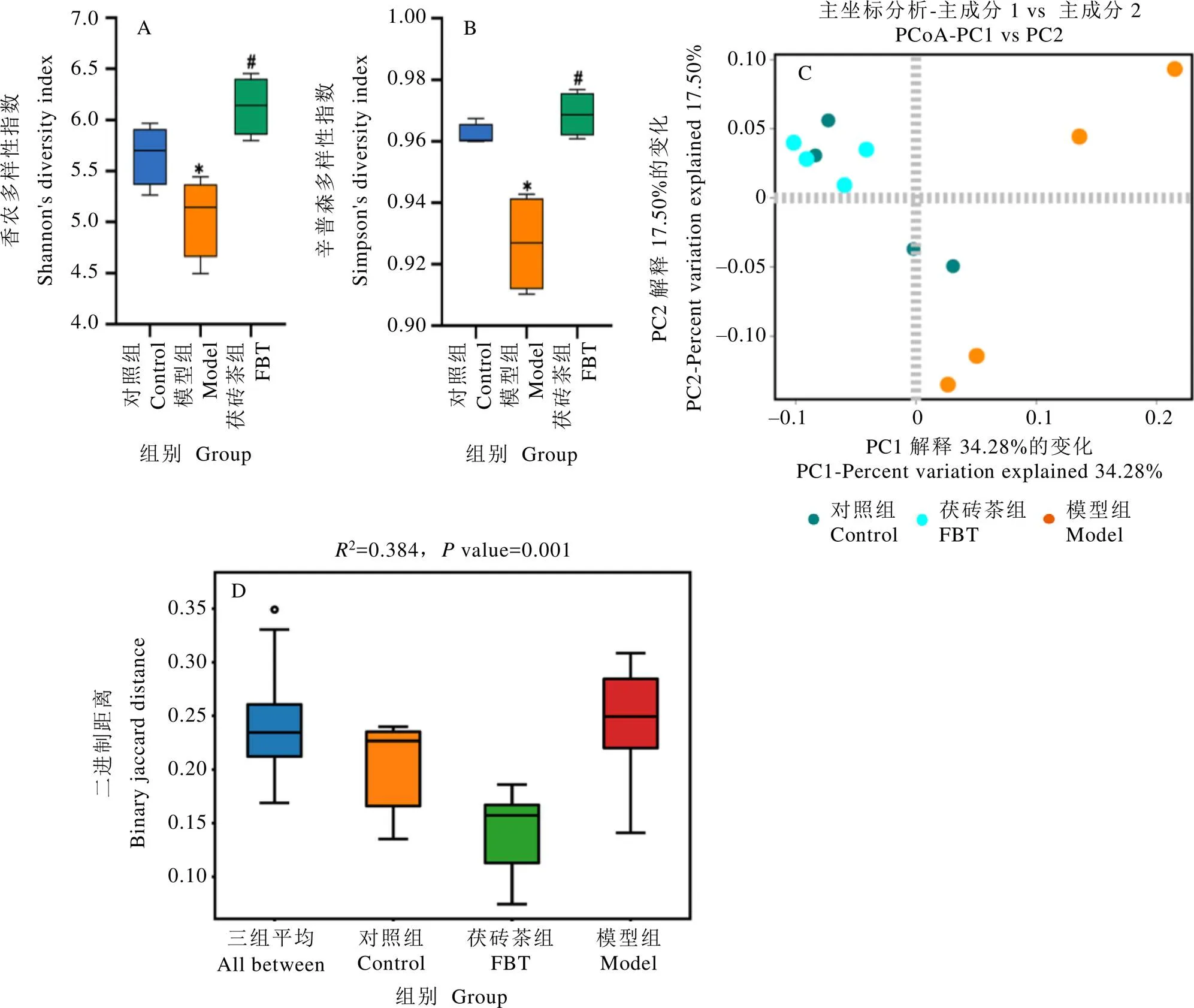
通过对小鼠粪便进行肠道细菌16 S rRNA高通量测序分析,研究茯砖茶对T2DM引起的肠道菌群失调的调节作用。基于香农指数和辛普森指数评估肠道微生物群落的多样性(图3-A和3-B)。与对照组相比,模型组香农指数和辛普森指数显著降低(<0.05),表明微生物群落多样性较低。相对于模型组,茯砖茶处理显著提高了香农指数和辛普森指数(<0.05),甚至略高于对照组,但无显著差异。基于主坐标分析(Principal co-ordinates analysis,PCoA)和相似性分析探究肠道微生物群落的多样性(图3-C和3-D),发现T2DM模型组的肠道微生物群与对照组明显不同,茯砖茶干预后小鼠肠道菌群较接近对照组。这表明茯砖茶可基本恢复由T2DM诱导的低肠道微生物群落多样性,促进失调肠道微生物群良性发展。
注:*表示与对照组相比,差异显著(P<0.05);#表示与模型组相比,差异显著(P<0.05)
2.4.2物种分类及差异性分析
为了解肠道微生物群的具体变化,绘制了在门水平上的丰度分布图(图4-A)。与Cao等[19]研究结果相似,拟杆菌门()、厚壁菌门()是小鼠肠道微生物群的主要优势菌门。T2DM在门水平上引起了肠道微生物群组成和结构的较大变化。模型组拟杆菌门比对照组相对丰度减少约10%,厚壁菌门的相对丰度变化不大,螺旋体菌门(),疣微菌门()相对丰度随着拟杆菌门的减少而升高(图4-A和表3)。与模型组相比,茯砖茶组厚壁菌门相对丰度增加约13%,疣微菌门丰度显著降低。厚壁菌门与拟杆菌门(F/B)的比值在T2DM患者中通常会降低[20]。本研究结果表明,与对照组和模型组相比,茯砖茶组的F/B值升高,但不存在显著差异(图4-C)。总之,T2DM导致了肠道菌群失调,而茯砖茶干预改善了肠道菌群的紊乱,使肠道微生物组成更接近于对照组小鼠(图4-B)。
如图4-D所示,丰度分布图显示了排名前十的属。通过多元统计ANOVA分析发现,T2DM导致疣微菌门的阿克曼菌属()的相对丰度显著增加(表3)。有报道称阿克曼属是有益菌属,但其过量定植于肠道,可能会引起肠道黏膜受损,进而加重肠道菌群失调[21]。与模型组相比,茯砖茶组的阿克曼属、的相对丰度显著降低,、、巨单胞菌属()、等菌属的丰度显著增加。
注:表示与对照组相比,差异显著(P<0.05);#表示与模型组相比,差异显著(P<0.05);º表示离群值
2.4.3 LEfSe组间显著性差异分析
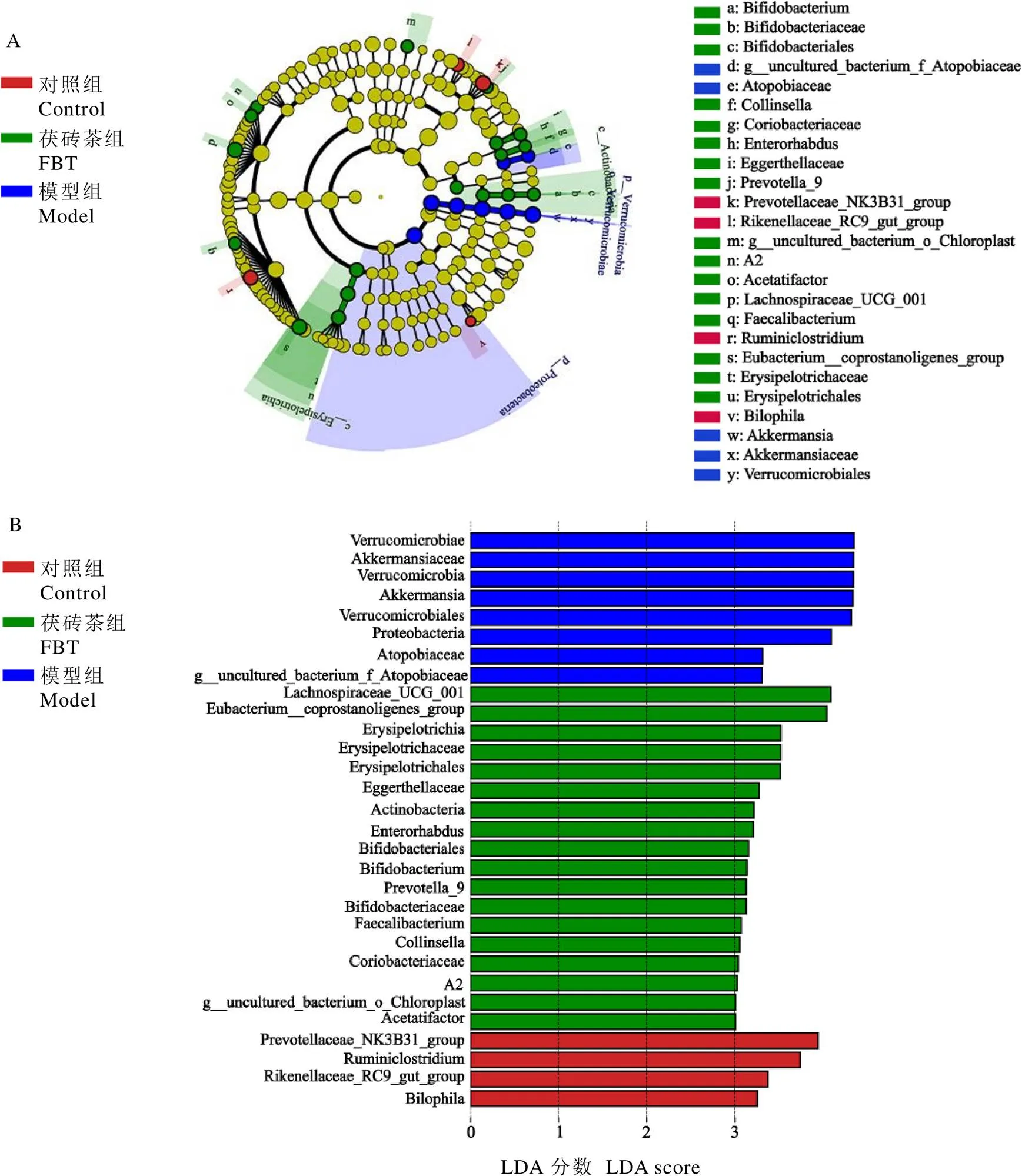
通过LEfSe(LDA≥3)分类级别为门到属,阐明茯砖茶干预后细菌的具体变化(图5)。茯砖茶的生物标志物包括放线菌纲()、双歧杆菌科()、双歧杆菌目()、双歧杆菌属()、肠杆菌属()、柯林斯菌属()、红蝽杆菌科()及,拟杆菌门,厚壁菌门毛螺菌科A2、、,厚壁菌门瘤胃球菌、,厚壁菌门丹毒丝菌纲()、丹毒丝菌科()、丹毒丝菌目(),及。
注:ns表示无显著差异(P>0.05);*表示与对照组相比,差异显著(P<0.05);#表示与模型组相比,差异显著(P<0.05)
3 讨论
研究表明,茯砖茶可改善T2DM小鼠糖脂代谢紊乱,并具有剂量依赖性[11-12]。本研究发现,剂量为400 mg·kg-1的茯砖茶水提取物有效改善了T2DM引起的糖脂代谢紊乱及炎症,对T2DM代谢紊乱的改善可能与调节肠道菌群有关。
3.1 茯砖茶可调节肠道微生物群落组成,改善T2DM小鼠肠道菌群失调
如和多样性分析所示,茯砖茶改变了T2DM小鼠的肠道菌群组成,改善了T2DM所导致的低微生物多样性,使微生物群落组成接近对照组。如图4-A和5-A所示,T2DM模型组疣微菌门异常增加,与Salguero等[22]研究结果一致。该菌门唯一鉴定出的菌属为阿克曼菌属,全称为嗜黏蛋白阿克曼菌,以肠道黏蛋白作为唯一碳源生长[23]。其过量定植于肠道会导致肠道黏蛋白的过度消耗,导致肠道损伤[24]。其产物丙酸盐的过量将导致胰岛素抵抗和葡萄糖不耐受[25],增加患T2DM风险[26]。因此,茯砖茶可能通过降低T2DM小鼠中异常表达的肠道菌群丰度,基本恢复正常的菌群组成,改善T2DM小鼠肠道菌群失调,进而抑制T2DM病情的发展。
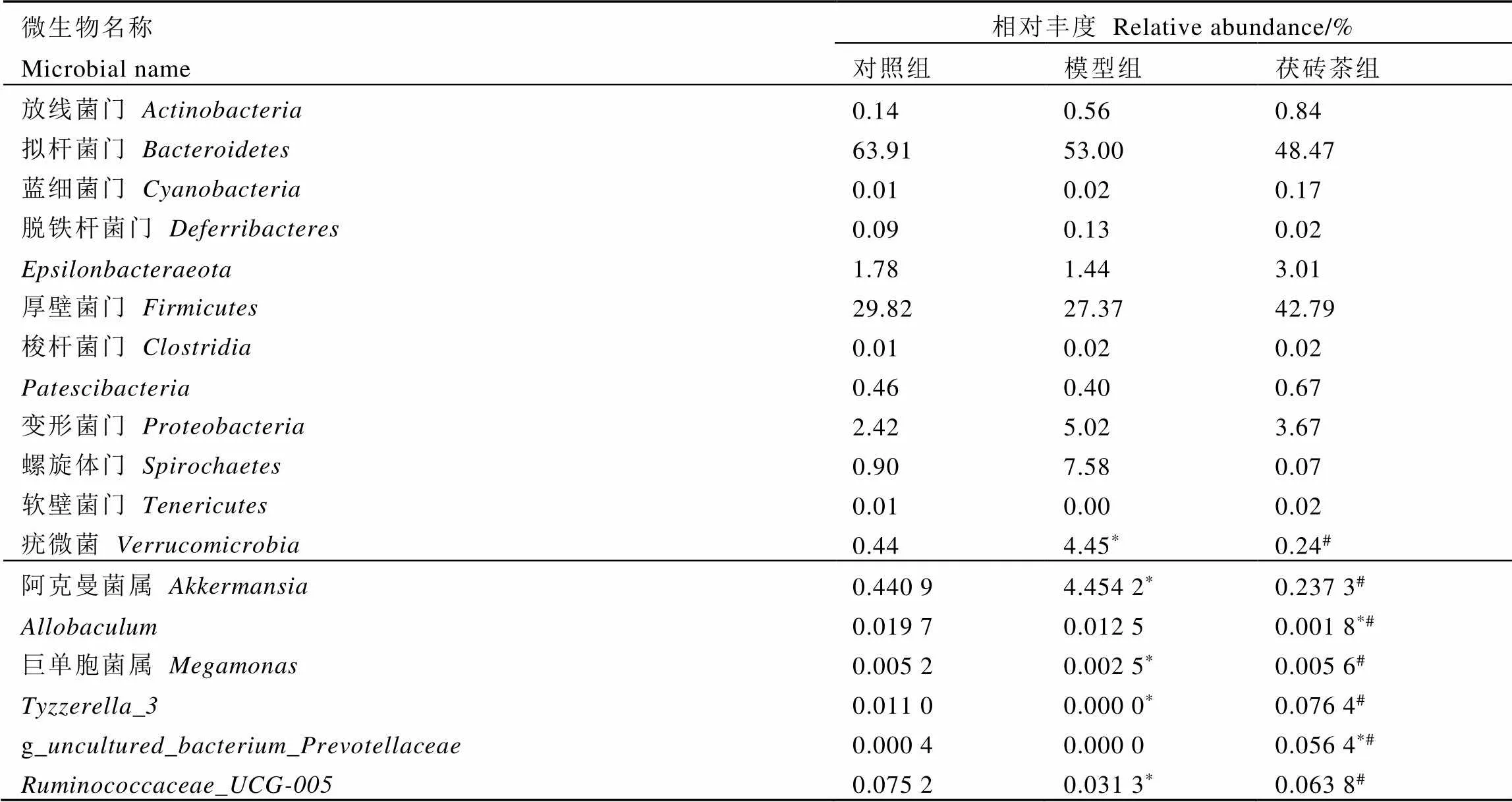
表3 基于门和属水平的多元统计ANOVA分析
注:*表示与对照组相比,差异显著(<0.05);#表示与模型组相比,差异显著(<0.05)
Note: * represents a significant difference compared to the control group,<0.05. # represents a significant difference compared to the model group,<0.05
3.2 茯砖茶可能通过增加有益菌属,改善T2DM小鼠代谢紊乱
茯砖茶通过增加有益菌属,以减轻T2DM诱导的肠道菌群失调,基本恢复了肠道健康,进而改善T2DM代谢紊乱。本研究显示,T2DM导致了普雷沃氏菌属、巨单胞菌属的丰度降低,这与已有报道一致[27-29]。茯砖茶干预显著逆转了这种变化,初步表明了其可能有作为益生元的潜力。
本研究发现茯砖茶干预可显著改善T2DM导致的体重下降,这可能与肠道菌群厚壁菌门相对丰度的增加有关。部分T2DM患者出现体重减轻的情况,这主要由于其血糖不能得到良好利用,转而利用脂肪,导致其机体消瘦。厚壁菌门具有比拟杆菌更高的食物热量摄取的能力[30],可以补充机体消耗的脂肪,使机体能量循环趋于正常。在模型组中没有观察到F/B指数下降,这可能是由于小鼠个体差异,本研究使用的正常小鼠的肠道菌群的最优势菌为拟杆菌门,与其他研究的厚壁菌门为最优势菌不同。与模型组相比,茯砖茶组的厚壁菌门丰度增加了约15%,这可能是茯砖茶改善T2DM小鼠体重减轻的原因之一。
LEfSe分析表明,在茯砖茶富集的有益菌群中,产丁酸细菌增多,如、和[31]。研究表明,T2DM患者肠道菌群失调,产丁酸的细菌会减少。丁酸盐具有抗炎和免疫调节功能,有益于肠道黏膜完整性[32]。肠黏膜的破坏会加剧肠道菌群紊乱,最终导致机体代谢紊乱。因此适当的促进丁酸盐产生,有益于肠黏膜结构完整和抗炎。但在本研究中,T2DM小鼠肠道中阿克曼菌属的异常增加,可能会促进产丁酸盐细菌丰度增加[23]。茯砖茶干预显著降低了阿克曼菌属的丰度,可能促进了另一些产丁酸的有益菌增加,只提供适量的丁酸盐,使肠道菌群的代谢逐渐恢复正常。此外,茯砖茶富集的丰度增加可能及时补充了阿克曼菌属过度消耗的黏蛋白,保护了肠道黏膜结构[33]。这表明茯砖茶富集的有益菌群,可能有利于改善机体炎症与肠道黏膜损伤。本研究结果显示,茯砖茶减轻了由T2DM导致的炎症及回肠黏膜损伤,初步验证了这一推论。
研究也发现茯砖茶富集了一些与胆汁酸代谢相关的菌群,如[34][35][36]、双歧杆菌属[37]、[38]和[39]。胆汁酸的产生和代谢需要肠道菌群的参与。肠道菌群紊乱将干扰胆汁酸代谢,从而导致代谢紊乱[40]。胆汁酸可调节脂质代谢,可能是肠道菌群调节T2DM脂质代谢紊乱的途径之一[41]。茯砖茶可能通过促进这些有益菌生长,减轻T2DM导致的脂质代谢紊乱。本研究发现,茯砖茶干预改善了T2DM小鼠血脂水平,且总胆汁酸水平与对照组无显著差异,这一结果与此推断相符。
注:A为LEfSe分析进化分枝图;B为LDA值分布的直方图(LDA≥3)
茯砖茶还富集了一些潜在的有益菌,如[42],[43]等。然而,茯砖茶也富集了[44]等与T2DM风险呈正相关的菌群,这也提示茯砖茶作为饮料,其作用是有限的,但符合试验结果。
综上所述,茯砖茶具有作为益生元的潜力,其干预可能通过增加有益菌群调节T2DM导致的肠道菌群失调,进而改善T2DM及其相关代谢紊乱,这为进一步研究茯砖茶改善T2DM及其代谢紊乱提供了新的证据。同时,本研究也存在不足之处,小鼠个体差异较大,T2DM病症复杂,本研究仅能代表部分2型糖尿病症状。
[1] Chen L, Magliano D J, Zimmet P Z. The worldwide epidemiology of type 2 diabetes mellitus-present and future perspectives [J]. Nature Reviews Endocrinology, 2012, 8(4): 228-236.
[2] Cho N H, Shaw J E, Karuranga S, et al. IDF diabetes atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045 [J]. Diabetes Research and Clinical Practice, 2018, 138: 271-281.
[3] Martin R, Langella P. Emerging health concepts in the probiotics field: streamlining the definitions [J]. Frontiers in Microbiology, 2019, 10: 1047. doi: 10.3389/fmicb.2019.01047.
[4] Zhao L P, Zhang F, Ding X Y, et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes [J]. Science, 2018, 359(6380): 1151-1156.
[5] 郭虹雯, 许翔雨, 陈莹婕, 等. 绿茶茶汤对肥胖相关肠道菌群的影响[J]. 茶叶科学, 2016, 36(4): 354-362.
Guo H W, Xu X Y, Chen Y J, et al. Effect of green tea infusions on obesity-associated gut microbiota [J]. Jornal of Tea Science, 2016, 36(4): 354-362.
[6] 唐飞, 艾于杰, 张善明, 等. 不同年份青砖茶改善小鼠胃肠道功能的研究[J]. 华中农业大学学报, 2018, 37(1): 82-88.
Tang F, Ai Y J, Zhang S M, et al. Effect of storage time of dark brick tea on improving gasintestinal function in mice [J]. Journal of Huazhong Agricultural University, 2018, 37(1): 82-88.
[7] 路晓杰, 刘久茜, 曹永国, 等. 普洱熟茶提取物对实验性非酒精性脂肪肝鼠脂代谢指标及肠道菌群的调节作用[J]. 中国兽医学报, 2018, 38(4): 751-758.
Lu X J, Liu J X, Cao Y G, et al. Pu-er extrat modulating lipid metabolism and gut microbiota in fatty liver disease mice [J]. Chinese Journal of Veterinary Science, 2018, 38(4): 751-758.
[8] 马玉仙, 蒋慧颖, 曾文治, 等. 武夷岩茶对糖尿病大鼠肠道菌群的调节作用[J]. 福建农林大学学报(自然科学版), 2019, 48(1): 22-27.
Ma Y X, Jiang H Y, Zeng W Z, et al. Regulatory effect of Wuyi rock tea on intestinal bacteria in diabetic rat [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2019, 48(1): 22-27.
[9] Liu Z B, Chen Z C, Guo H W, et al. The modulatory effect of infusions of green tea, oolong tea, and black tea on gut microbiota in high-fat-induced obese mice [J]. Food & Function, 2016, 7(12): 4869-4879.
[10] 傅冬和, 刘仲华, 黄建安, 等. 茯砖茶加工过程中主要化学成分的变化[J]. 食品科学, 2008, 29(2): 64-67.
Fu D H, Liu Z H, Huang J A, et al. Variations of components of Fuzhuan tea during processing [J]. Food Science, 2008, 29(2): 64-67.
[11] 黄颂, 刘仲华, 黄建安, 等. 茯茶水提物对Ⅱ型糖尿病小鼠糖代谢紊乱的干预作用[J]. 茶叶科学, 2016, 36(3): 250-260.
Huang S, Liu Z H, Huang J A, et al. Intervention effects of Fuzhuan brick tea water extract on glucose metabolism disorder in a mouse model of type Ⅱdiabetes mellitus [J]. Jornal of Tea Science, 2016, 36(3): 250-260.
[12] Liu D, Huang J, Luo Y, et al. Fuzhuan brick tea attenuates high-fat diet-induced obesity and associated metabolic disorders by shaping gut microbiota [J]. Journal of Agricultural and Food Chemistry, 2019, 67(49): 13589-13604.
[13] 侯爱香, 颜道民, 孙静文, 等. 绿茶、红茶和茯砖茶水提物对肠道微生物体外发酵特性的影响[J]. 茶叶科学, 2019, 39(4): 403-414.
Hou A X, Yan D M, Sun J W, et al. Effects of green, black and Fu brick tea aqueous extracts on the characteristics of intestinal microbiota duringfermentation [J]. Jornal of Tea Science, 2019, 39(4): 403-414.
[14] 王黎明, 夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学, 2005, 26(7): 185-188.
Wang L M, Xia W S. Determination of TPS by improvement of anthrone-sulfuric acid method [J]. Food Science, 2005, 26(7): 185-188.
[15] Uaman H, Ullah M A, Jan H, et al. Interactive effects of wide-spectrum monochromatic lights on phytochemical production, antioxidant and biological activities ofcallus cultures [J]. Molecules, 2020, 25(9): 2201. doi: 10.3390/molecules25092201.
[16] 游见明, 曹新志. 福林酚法测定茶树中茶多酚的分布水平[J]. 湖北农业科学, 2013, 52(10): 2417-2419.
You J M, Cao X Z. Analysis on the distribution of tea polyphenol in tea tree by Folin-Ciocalteaut method [J]. Hubei Agricultural Science, 2013, 52(10): 2417-2419.
[17] Bhate A, Parker D J, Bebee T W, et al. ESRP2 controls an adult splicing programme in hepatocytes to support postnatal liver maturation [J]. Nature Communications, 2015, 6: 8768. doi: 10.1038/ncomms9768.
[18] 栗志文, 王媛媛, 王根辈, 等. 普洱茶提取物与绿茶提取物降糖功效的研究[J]. 茶叶科学, 2014, 34(5): 428-434.
Li Z W, Wang Y Y, Wang G B, et al. Study of the hypoglycemic effect of Pu′er tea and green tea extracts [J]. Jornal of Tea Science, 2014, 34(5): 428-434.
[19] Cao Y, Yao G, Sheng Y, et al. JinQi jiangtang tablet regulates gut microbiota and improve insulin sensitivity in type 2 diabetes mice [J]. Journal of Diabetes Research, 2019: 1872134. doi: 10.1155/2019/1872134.
[20] Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes [J]. Nature, 2012, 490(7418): 55-60.
[21] Ouyang J, Lin J, Isnard S, et al. The bacterium: a sentinel for gut permeability and its relevance to HIV-related inflammation [J]. Frontiers in Immunology, 2020, 11: 645. doi: 10.3389/fimmu.2020.00645.
[22] Salguero M V, Alobaide M A I, Singh R, et al. Dysbiosis of gram-negative gut microbiota and the associated serum lipopolysaccharide exacerbates inflammation in type 2 diabetic patients with chronic kidney disease [J]. Experimental and Therapeutic Medicine, 2019, 18(5): 3461-3469.
[23] Derrien M, Vaughan E E, Plugge C M, et al.gen. nov., sp. nov., a human intestinal mucin-degrading bacterium [J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(5): 1469-1476.
[24] Derrien M, Belzer C, De Vos W M.and its role in regulating host functions [J]. Microbial Pathogenesis, 2017, 106: 171-181.
[25] Tirosh A, Calay E S, Tuncman G, et al. The short-chain fatty acid propionate increases glucagon and FABP4 production, impairing insulin action in mice and humans [J]. Science Translational Medicine, 2019, 11(489): eaav0120. doi: 10.1126/scitranslmed.aav0120.
[26] Shams S, Foley K A, Kavaliers M, et al. Systemic treatment with the enteric bacterial metabolic product propionic acid results in reduction of social behavior in juvenile rats: contribution to a rodent model of autism spectrum disorder [J]. Developmental Psychobiology, 2019, 61(5): 688-699.
[27] Murri M, Leiva I, Miguel Gomez-Zumaquero J, et al. Gut microbiota in children with type 1 diabetes differs from that in healthy children: a case-control study [J]. BMC Medicine, 2013, 11: 46. doi: 10.1186/1741-7015-11-46.
[28] Zhang H, Dibaise J K, Zuccolo A, et al. Human gut microbiota in obesity and after gastric bypass [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(7): 2365-2370.
[29] Groer M W, Luciano A A, Dishaw L J, et al. Development of the preterm infant gut microbiome: a research priority [J]. Microbiome, 2014, 2(1): 38. doi: 10.1186/2049-2618-2-38.
[30] Castaner O, Goday A, Park Y M, et al. The gut microbiome profile in obesity: a systematic review [J]. International Journal of Endocrinology, 2018, 2018: 4095789. doi: 10.1155/2018/4095789.
[31] Louis P, Flint H J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine [J]. Fems Microbiology Letters, 2009, 294(1): 1-8.
[32] Asarat M, Apostolopoulos V, Vasiljevic T, et al. Short-chain fatty acids regulate cytokines and Th17/Treg cells in human peripheral blood mononuclear cells[J]. Immunological Investigations, 2016, 45(3): 205-222.
[33] Van Herreweghen F, Van Den Abbeele P, De Mulder T, et al.colonisation of the distal colon byis largely mucin and pH dependent [J]. Beneficial Microbes, 2017, 8(1): 81-96.
[34] Ren D W, Li L, Schwabacher A W, et al. Mechanism of cholesterol reduction to coprostanol byATCC 51222 [J]. Steroids, 1996, 61(1): 33-40.
[35] Pfeiffer N, Desmarchelier C, Blaut M, et al.gen. nov., sp nov., a novel bacterium isolated from the intestine of an obese mouse [J]. Archives of Microbiology, 2012, 194(11): 901-907.
[36] Zhao C, Qu Q, Yang F, et al. Monascus ruber fermented Panax ginseng ameliorates lipid metabolism disorders and modulate gut microbiota in rats fed a high-fat diet [J]. Journal of Ethnopharmacology, 2021, 278: 114300. doi: 10.1016/j.jep.2021.114300.
[37] Ruiz L, Margolles A, Sanchez B. Bile resistance mechanisms inand[J]. Frontiers in Microbiology, 2013, 4: 396. doi: 10.3389/fmicb.2013.00396.
[38] Wen K, Tao L, Tao Z, et al. Fecal and serum metabolomic signatures and microbial community profiling of postmenopausal osteoporosis mice model [J]. Frontiers in Cellular and Infection Microbiology, 2020, 10: 535310. doi: 3389/fcimb.2020.535310.
[39] Wegner K, Just S, Gau L, et al. Rapid analysis of bile acids in different biological matrices using LC-ESI-MS/MS for the investigation of bile acid transformation by mammalian gut bacteria [J]. Analytical and Bioanalytical Chemistry, 2017, 409(5): 1231-1245.
[40] Jia W, Xie G X, Jia W P. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis [J]. Nature Reviews Gastroenterology & Hepatology, 2018, 15(2): 111-128.
[41] Thomas C, Pellicciari R, Pruzanski M, et al. Targeting bile-acid signalling for metabolic diseases [J]. Nature Reviews Drug Discovery, 2008, 7(8): 678-693.
[42] Han Y, Zhao M, Ouyang K H, et al. Sulfated modification, structures, antioxidant activities and mechanism ofpolysaccharides protecting dendritic cells against oxidant stress [J]. Industrial Crops and Products, 2021, 164: 113353. doi: 10.1016/j.indcrop.2021.113353.
[43] Chen J, Huang C L, Wang J J, et al. Dysbiosis of intestinal microbiota and decrease in paneth cell antimicrobial peptide level during acute necrotizing pancreatitis in rats [J]. Plos One, 2017, 12(4): e0176583. doi: 10.1371/journal.pone.0176583.
[44] Kang X, Zhao L B, Lu X G, et al. Characteristics of gastric microbiota in GK rats with spontaneous diabetes: a comparative study [J]. Diabetes Metabolic Syndrome and Obesity: Targets and Therapy, 2020, 13: 1435-1447.
Effect of Fu Brick Tea on Improving Metabolic Disorders in Type 2 Diabetes Mice
DAI Xinyue1,2, GE Binggang1,2, ZHANG Xuwen1,2, LIU Wenwu1,4, DUAN Jichun5, FU Donghe1,2,3*
1. Key Lab of Tea Science of Ministry of Education, Hunan Agricultural University, Changsha 410128, China; 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 3. Hunan Collaborative Innovation Center for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 4 Tea Research Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China; 5. Hunan Dekang Tea Technology Co., Ltd, Changsha 410001, China
To investigate whether Fu brick tea (FBT) water extract can attenuate metabolic disorders in Type 2 Diabetes (T2DM)by regulating gut microbiota,a T2DM mouse model was established with streptozocin and 400 mg·kg-1FBT water extract administration. Diet, and water consumption, body weight, fasting glucose and glucose tolerance in mice were observed. Serum levels of insulinINS, total bile acid (TBA), total cholesterol (TC), triglycerides (TG), low-density lipoprotein cholesterol (LDL-C), high-density lipoprotein cholesterol (HDL-C), interleukin-1beta (IL-1) and tumor necrosis factor-alpha (TNF-) were examined. Histopathological changes of ileum and pancreas were also observed. Furthermore, fecal samples were analyzed by 16 SrRNA gene sequencing. The results show that FBT reduced the serum lipid metabolism levels, blood glucose, and inflammatory cytokines. Simultaneously, FBT treatment significantly ameliorated pathological changes in the pancreas and ileum. Moreover, the diversity, structure and composition of T2DM-disrupted gut microbiota were restored by the supplementation of FBT. T2DM-induced increase in the relative abundance ofwas remarkably restored by FBT. FBT increased the growth of many key beneficial bacteria, including,,,,,,,and. Collectively, the study showed that FBT might alleviate dysbacteriosis and metabolic disorders in T2DM by increasing beneficial flora.
Fu brick tea, type 2 diabetes mellitus, gut microbiota
S571.1;R587.1
A
1000-369X(2022)01-063-13
2021-08-31
2021-09-17
国家重点研发计划(2018YFC1604403)、国家自然科学基金(32002095、32172217)
代昕玥,女,硕士研究生,主要从事茶叶功能成分利用相关研究,974644744@qq.com。*通信作者:40086713@qq.com
(责任编辑:黄晨)

