miR-199b-5p靶向Klotho对脂多糖诱导的大鼠肾小管上皮细胞损伤的影响
雷伟 李爽 陈海涛 王军
急性肾损伤(acute kidney injury,AKI)是脓毒症引起的多器官衰竭的主要并发症之一,并伴有高死亡率[1]。肾小管上皮细胞凋亡是脓毒性AKI的重要病理机制[2,3]。脂多糖(lipopolysaccharide,LPS)是一种来自革兰氏阴性菌的内毒素,是与脓毒症相关AKI发展的主要因素[4]。LPS诱导的AKI模型已被普遍认为可用以研究肾组织损伤和肾小管细胞凋亡的病理生理学[5,6]。因此,研究LPS诱导肾小管上皮细胞损伤的分子机制,对开发新的修复肾小管上皮细胞的药物具有重要意义。研究发现,Klotho基因在肾小管具有广泛的生物学作用,包括调节肾脏钙磷代谢平衡、抗炎、抗氧化应激、抗凋亡等;参与多种肾脏疾病的发生发展,可作为AKI的潜在生物标志物和治疗靶点[7]。MicroRNA-199b-5p(miR-199b-5p)是一种小的非编码RNA,可靶向Klotho的3’UTR,早前已发现miR-199b-5p在多种癌症中高表达[8];糖尿病肾病(diabetic nephropathy,DN)患者血清miR-199b-5p水平升高,而Klotho蛋白水平降低,下调miR-199b-5p可上调Klotho,减轻DN肾小管损伤[9]。研究显示脓毒症患者血细胞miR-199b-5p水平升高,可作为脓毒症和脓毒性休克的潜在早期指标[10]。本研究通过LPS诱导建立了大鼠肾小管上皮细胞损伤模型,分析miR-199b-5p和Klotho的表达变化,并进一步阐明其在肾小管上皮细胞损伤中的作用。
1 材料与方法
1.1 材料 NRK-52E(大鼠肾小管上皮细胞,武汉普诺赛生命科技有限公司,货号:CP-R062);LPS、Lipofectamine 3000转染试剂(Sigma-Aldrich,货号:L5293、L3037);胎牛血清、DMEM培养基、胰蛋白酶(美国Gbico公司);miR-199b-5p inhibitor及其阴性对照(inhibitor-NC)由上海GenePharma合成;sh-Klotho及其阴性对照质粒(sh-NC)购自美国Santa Cruz Biotechnology公司;大鼠白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)(ml002859)ELISA试剂盒(上海酶联生物科技有限公司,货号:ml102828、ml002859);超氧化物歧化酶(SOD)(WST-1法)、丙二醛(MDA)(TBA法)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)(比色法)测定试剂盒(南京建成生物工程研究所,货号:A001-3-2、A003-1-2、A005-1-2);活性氧(ROS)检测试剂盒(荧光探针DCFH-DA)、Annexin V-FITC细胞凋亡检测试剂盒、细胞裂解液、BCA蛋白浓度测定试剂盒(碧云天生物科技有限公司,货号:S0033S、C1062L、P0013、P0010S);Trizol试剂、反转录试剂盒、SYBR®Premix Ex TaqTM试剂盒(日本TaKaRa公司,货号:RR420A、RR037A、RR390A);兔抗Klotho(ab203576)、Bcl-2(ab196495)、Bax(ab32503)、Caspase-3(ab184787)、β-actin(ab8227)、山羊抗兔IgG H&L (HRP)(ab205718)均购自英国abcam公司。细胞培养箱(美国Thermo Fisher Scientific公司);ABI Prism 7300型荧光定量PCR系统(美国应用生物系统公司);IX73倒置荧光显微镜(日本Olympus公司);iMark680多功能酶标仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养:NRK-52E细胞在含有10%胎牛血清、100 U/ml青霉素和100 mg/ml链霉素的DMEM培养基中,于37℃、5% CO2培养箱中进行培养。每2天换液1次,待细胞融合为一层时进行传代,取处于对数生长期的细胞进行实验。
1.2.2 细胞分组与处理:实验分为正常对照组(NC组):正常培养的NRK-52E细胞,不进行LPS处理和任何转染;LPS组:进行LPS处理的NRK-52E细胞;inhibitor-NC组:转染miR-199b-5p inhibitor阴性对照并进行LPS处理的NRK-52E细胞;miR-199b-5p沉默组:转染miR-199b-5p inhibitor并进行LPS处理的NRK-52E细胞;sh-NC组:转染sh-Klotho阴性对照质粒并进行LPS处理的NRK-52E细胞;sh-Klotho组:转染sh-Klotho质粒并进行LPS处理的NRK-52E细胞;miR-199b-5p沉默+sh-NC组:miR-199b-5p inhibitor和sh-Klotho阴性对照质粒共转染并进行LPS处理的NRK-52E细胞;miR-199b-5p沉默+sh-Klotho组:miR-199b-5p inhibitor和sh-Klotho共转染并进行LPS处理的NRK-52E细胞。转染按照Lipofectamine 3 000转染试剂说明进行,转染后将细胞在37℃、5% CO2培养箱中继续培养;转染48 h后,弃去原培养基,更换为不含胎牛血清的DMEM培养基培养24 h,然后将细胞用含100 μg/ml LPS的DMEM培养基处理。
1.2.3 实时荧光定量PCR(RT-qPCR)检测细胞中miR-199b-5p、Klotho mRNA表达水平:用Trizol试剂从细胞中提取总RNA。然后,用反转录试剂盒将1 μg总RNA逆转录为cDNA。以对miR-199b-5p和Klotho表达特异的引物进行cDNA的荧光定量PCR,评估miR-199b-5p和Klotho mRNA的表达水平。RT-qPCR程序如下:酶在94℃下活化5 min,94℃变性20 s,60℃退火30 s,72℃延伸20 s,40个循环。U6和β-actin分别作为对照基因量化miR-199b-5p和Klotho mRNA的表达。miR-199b-5p和Klotho mRNA的相对表达水平用2-ΔΔCT方法计算。见表1。

表1 RT-qPCR引物序列
1.2.4 酶联免疫吸附法(ELISA)检测细胞培养上清液中IL-6、TNF-α水平:收集各组细胞培养上清液,按照试剂盒说明书操作,检测TNF-α、IL-6的水平。
1.2.5 荧光探针DCFH-DA法检测细胞中ROS含量:将各组细胞以2×104个/孔的密度均匀接种至24孔板,37℃、5% CO2下培养过夜,然后与含有10 μmol/L DCFH-DA的DMEM培养在37℃下避光孵育30 min。DCFH-DA被细胞内酯酶转化为DCFH,DCFH在适当的氧化剂存在下被氧化成高荧光二氯荧光素(DCF)。PBS洗涤3次并置于暗处。随后荧光显微镜下于485 nm激发和538 nm发射波长检测荧光信号强度。
1.2.6 氧化应激指标检测:收集各组细胞,加入RIPA裂解液裂解细胞,超声破碎,静置后在4℃条件下以12 000 g离心15 min,取上清液为总蛋白溶液。BCA法测量蛋白浓度后,根据试剂盒说明书检测细胞上清液中GSH-Px、SOD活性和MDA含量。
1.2.7 流式细胞术测定细胞凋亡率:经LPS处理后的各组细胞,以2×104个/孔接种于6孔板中,培养48 h,弃培养液,用冷PBS洗涤2次,然后重悬于1×结合缓冲液中。随后,取100 μl细胞悬液,将5 μl FITC Annexin V和5 μl PI添加到细胞悬液中。然后在室温下避光孵育15 min。最后,加入400 μl 1×Binding Buffer,并在1 h内通过流式细胞术分析细胞凋亡率。
1.2.8 Western blot检测细胞中Klotho和Bcl-2、Bax、Caspase-3蛋白表达:根据“1.2.6”的方法收集细胞,并裂解细胞。在4℃下以12 000 g离心15 min后用BCA法检测蛋白质浓度。每个样品取30 μg蛋白质在10% SDS-PAGE电泳上分离,然后转移到PVDF膜上,并与稀释的一抗(Klotho、Bcl-2、Bax、Caspase-3、β-actin,1∶1 000)在4℃下孵育过夜,孵育之前在5%脱脂牛奶中封闭1 h。洗涤后,将膜与辣根过氧化物酶偶联的二抗(1∶4 000)室温孵育1 h。然后使用ECL对条带进行可视化。β-actin作为内参蛋白,通过与内参蛋白的灰度比,得出目的蛋白的相对表达水平。
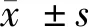
2 结果
2.1 8组细胞中miR-199b-5p和Klotho的表达 与NC组比较,LPS组细胞中miR-199b-5p升高(P<0.05),Klotho的mRNA和蛋白表达显著降低(P<0.05);与LPS组比较,miR-199b-5p沉默组细胞中miR-199b-5p表达显著降低(P<0.05),Klotho的mRNA和蛋白表达显著升高(P<0.05),而sh-Klotho组细胞中Klotho的mRNA和蛋白表达均降低(P<0.05);与miR-199b-5p沉默组比较,miR-199b-5p沉默+sh-Klotho组细胞中Klotho的mRNA和蛋白表达显著降低(P<0.05);与sh-Klotho组比较,miR-199b-5p沉默+sh-Klotho组细胞中miR-199b-5p表达显著降低(P<0.05),Klotho的mRNA和蛋白表达均匀升高(P<0.05)。见图1,表2。
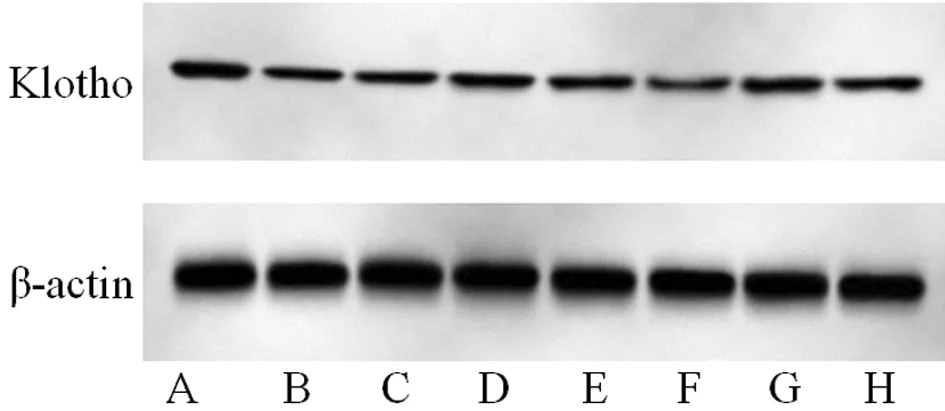
图1 8组细胞中Klotho蛋白表达;A NC组;B LPS组;C inhibitor-NC组;D miR-199b-5p沉默组;E sh-NC组;F sh-Klotho组;G miR-199b-5p沉默+sh-NC组;H miR-199b-5p沉默+sh-Klotho组
2.2 8组细胞上清液中IL-6、TNF-α比较 与NC组比较,LPS组TNF-α、IL-6水平显著升高(P<0.05);与LPS组比较,miR-199b-5p沉默组TNF-α、IL-6水平显著降低(P<0.05),而sh-Klotho组TNF-α、IL-6水平显著升高(P<0.05);与miR-199b-5p沉默组比较,miR-199b-5p沉默+sh-Klotho组TNF-α、IL-6水平显著升高(P<0.05);与sh-Klotho组比较,miR-199b-5p沉默+sh-Klotho组TNF-α、IL-6水平显著降低(P<0.05)。见表3。

表2 8组细胞中miR-199b-5p和Klotho的表达
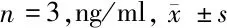
表3 8组细胞上清液中IL-6、TNF-α水平比较
2.3 8组细胞凋亡率比较 与NC组比较,LPS组细胞凋亡率显著升高(P<0.05);与LPS组比较,miR-199b-5p沉默组细胞凋亡率显著降低(P<0.05),而sh-Klotho组显著升高(P<0.05);与miR-199b-5p沉默组比较,miR-199b-5p沉默+sh-Klotho组细胞凋亡率显著升高(P<0.05);与sh-Klotho组比较,miR-199b-5p沉默+sh-Klotho组细胞凋亡率显著降低(P<0.05)。见表4,图2。
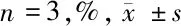
表4 8组细胞凋亡率
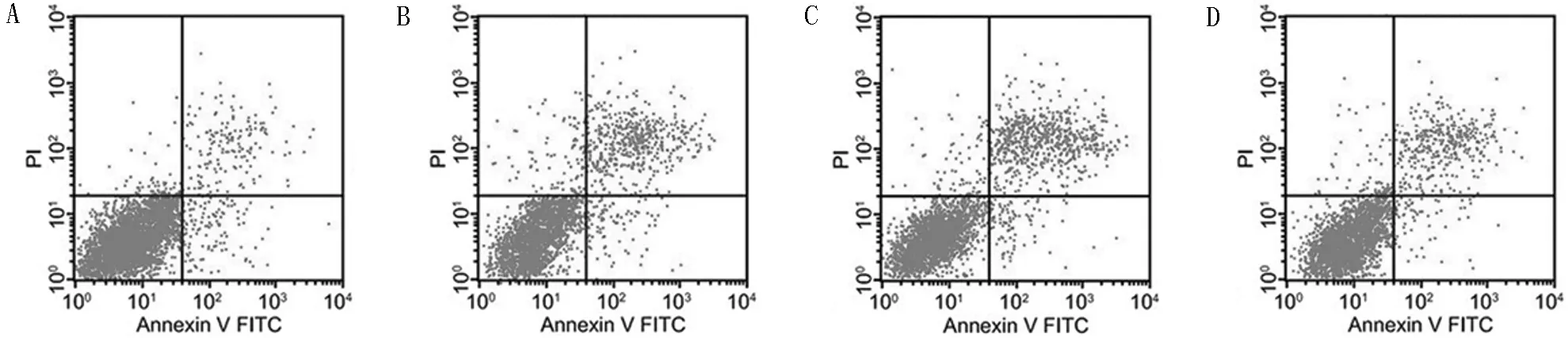
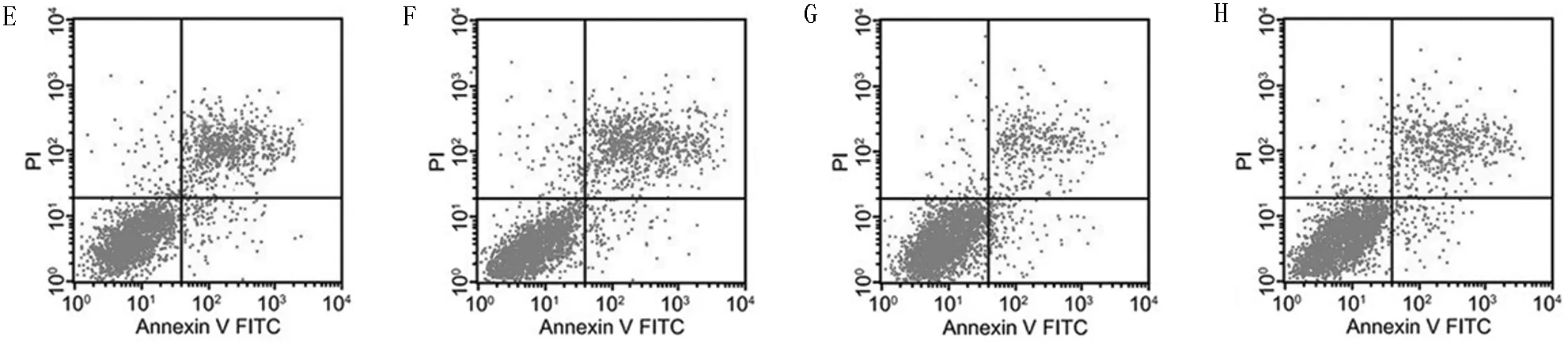
图2 8组细胞凋亡情况(流式细胞术);A NC组;B LPS组;C inhibitor-NC组;D miR-199b-5p沉默组;E sh-NC组;F sh-Klotho组;G miR-199b-5p沉默+sh-NC组;H miR-199b-5p沉默+sh-Klotho组
2.4 8组细胞中ROS含量比较 与NC组(1.00±0.00)比较,LPS组细胞中ROS的荧光强度(3.36±0.45)显著增强,差异有统计学意义(P<0.05);与LPS组比较,inhibitor-NC组(3.40±0.38)和sh-NC组(3.39±0.40)细胞中ROS的荧光强度差异无统计学意义(P>0.05),miR-199b-5p沉默组(2.04±0.23)显著降低,差异有统计学意义(P<0.05),而sh-Klotho组(4.43±0.41)显著增强,差异有统计学意义(P<0.05);与miR-199b-5p沉默组比较,miR-199b-5p沉默+sh-Klotho组细胞中ROS的荧光强度(2.86±0.37)显著增强,差异有统计学意义(P<0.05);与sh-Klotho组比较,miR-199b-5p沉默+sh-Klotho组细胞中ROS的荧光强度(3.11±0.39)显著降低,差异有统计学意义(P<0.05)。见图3。
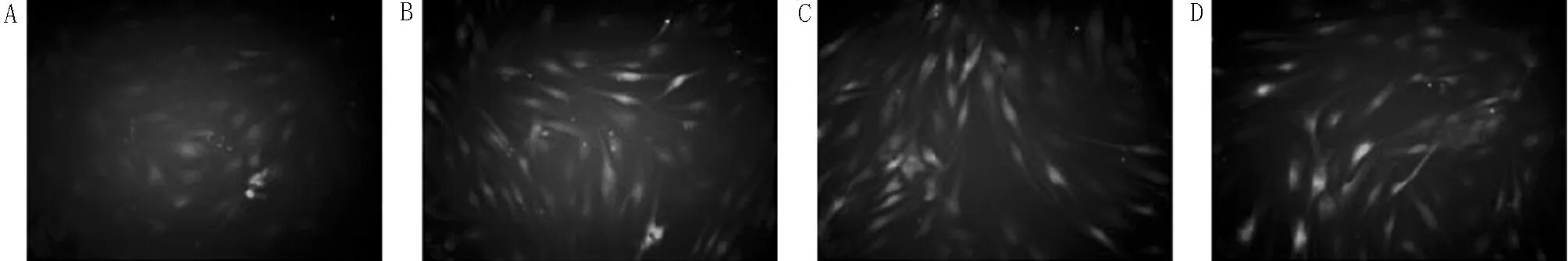
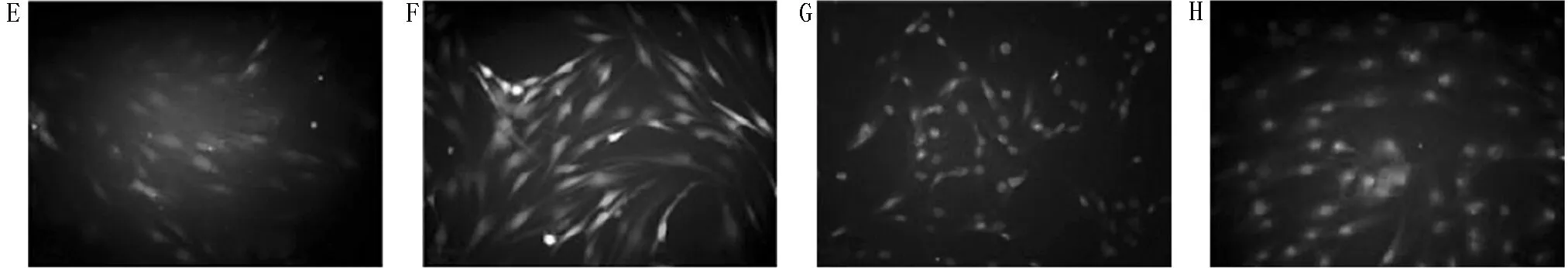
图3 8组细胞中ROS含量(DCFH-DA荧光探针法×200);A NC组;B LPS组;C inhibitor-NC组;D miR-199b-5p沉默组;E sh-NC组;F sh-Klotho组;
G miR-199b-5p沉默+sh-NC组;H miR-199b-5p沉默+sh-Klotho组
2.5 8组细胞中GSH-Px、SOD活性和MDA含量比较 与NC组比较,LPS组细胞中MDA含量显著升高(P<0.05),GSH-Px、SOD活性显著降低(P<0.05);与LPS组比较,miR-199b-5p沉默组细胞中MDA降低(P<0.05),GSH-Px、SOD活性显著升高(P<0.05),而sh-Klotho组MDA含量升高(P<0.05),GSH-Px、SOD活性降低(P<0.05);与miR-199b-5p沉默组比较,miR-199b-5p沉默+sh-Klotho组细胞中MDA含量显著升高(P<0.05),GSH-Px、SOD活性降低(P<0.05);与sh-Klotho组比较,miR-199b-5p沉默+sh-Klotho组细胞中MDA含量显著降低(P<0.05),GSH-Px、SOD活性显著升高(P<0.05)。见表5。

表5 8组细胞中MDA含量和GSH-Px、SOD活性
2.6 8组细胞中Bcl-2、Bax、Caspase-3蛋白表达 与NC组比较,LPS组细胞中Bax、Caspase-3表达升高(P<0.05),Bcl-2表达降低(P<0.05);与LPS组比较,miR-199b-5p沉默组细胞中Bax、Caspase-3表达降低(P<0.05),Bcl-2表达升高(P<0.05),而sh-Klotho组细胞中Bax、Caspase-3表达升高(P<0.05),Bcl-2表达降低(P<0.05);与miR-199b-5p沉默组比较,miR-199b-5p沉默+sh-Klotho组细胞中Bax、Caspase-3表达升高(P<0.05),Bcl-2表达降低(P<0.05);与sh-Klotho组比较,miR-199b-5p沉默+sh-Klotho组细胞中Bax、Caspase-3表达降低(P<0.05),Bcl-2表达显著升高(P<0.05)。见图4,表6。
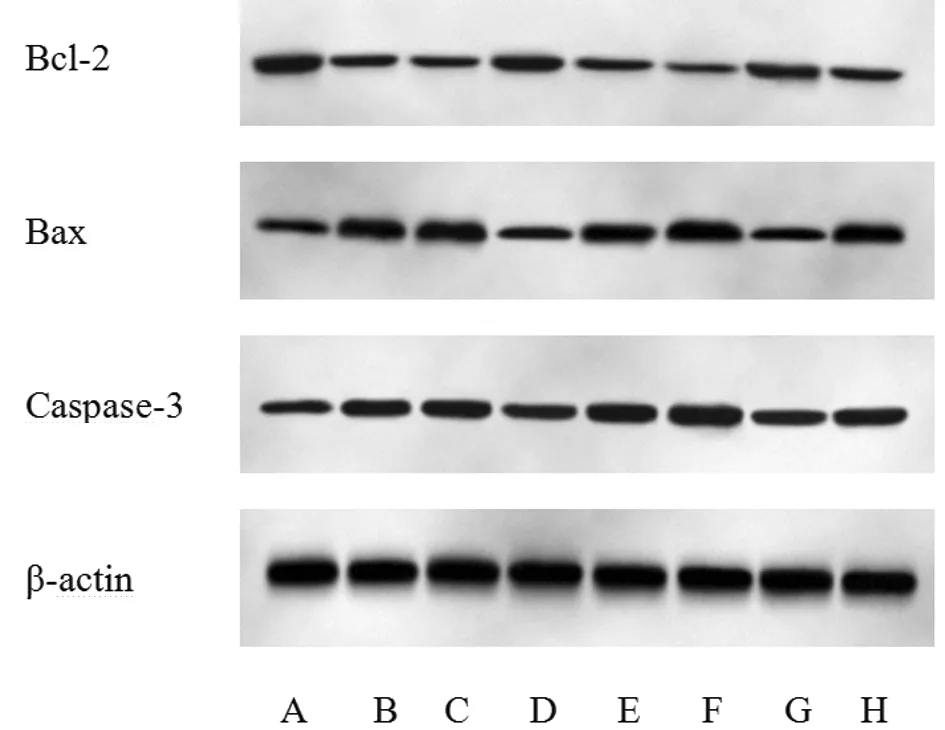
图4 8组细胞中Bcl-2、Bax、Caspase-3蛋白表达;A NC组;B LPS组;C inhibitor-NC组;D miR-199b-5p沉默组;E sh-NC组;F sh-Klotho组;G miR-199b-5p沉默+sh-NC组;H miR-199b-5p沉默+sh-Klotho组

表6 8组细胞中Bcl-2、Bax、Caspase-3蛋白表达
3 讨论
LPS可激活存在于免疫细胞和肾小管上皮细胞膜中的Toll样受体4(TLR4),引发促炎细胞因子的过度释放、氧化应激和肾小管细胞凋亡[4]。越来越多证据支持氧化应激在脓毒症引起AKI的发生和进展中起关键作用。氧化应激导致LPS攻击后线粒体ROS的过度产生和早期线粒体功能障碍,通过促凋亡细胞色素C释放到细胞质中并激活半胱天冬酶级联反应触发细胞凋亡[11]。抗细胞凋亡蛋白Bcl-2,通过阻断细胞色素C从线粒体中释放来抑制细胞死亡,从而阻止下游Caspase(Caspase-3、-9、-7)激活[12]。Klotho基因位于染色体13q12上,其编码130 kDa跨膜蛋白,据报道,Klotho在肾脏中的表达最高,可通过增加内源性抗氧化能力防止器官损坏和细胞凋亡[13]。Klotho缺乏的最常见原因是AKI和慢性肾脏病,另一项研究报告称,Klotho缺乏可能与终末期肾病患者的氧化应激和炎症增强有关[14]。Tsai等[15]的研究显示LPS可通过与肾小球系膜细胞中的NF-κB相互作用抑制Klotho表达。本研究中,我们观察到LPS诱导的肾小管上皮细胞损伤中Klotho的mRNA和蛋白表达水平显著降低;此外,本研究发现沉默Klotho后LPS诱导的肾小管上皮细胞中ROS、MDA和TNF-α、IL-6水平均升高,而GSH-PX和SOD活性降低,细胞凋亡增加;说明Klotho表达的降低增强了LPS诱导的肾小管上皮细胞氧化应激和炎症损伤。提示Klotho表达的降低是LPS诱导的肾小管上皮细胞凋亡的重要因素。
MicroRNA(miRs)是一系列内源性非编码RNA(18~25个核苷酸),能够负向调节基因表达,控制几乎所有细胞功能,包括分化、增殖、衰老和凋亡。Klotho在AKI中的表达受MicroRNA的调控[16]。研究发现Klotho是miR-199b-5p的靶基因,miR-199b-5p的激活抑制了Klotho的3’UTR活性,在高糖培养的系膜细胞中,高糖诱导增加了miR-199b-5p的表达,伴随着Klotho mRNA和蛋白表达的显著降低,抑制miR-199b-5p或外源性添加Klotho可抑制高糖培养的系膜细胞的炎症和纤维化,miR-199b-5p可作为DN的新治疗靶点[10];表明miR-199b-5p可能参与了AKI中Klotho的调控。
在本研究中,LPS显著增加了肾小管上皮细胞中miR-199b-5p的表达水平,而沉默miR-199b-5p后,Klotho mRNA和蛋白表达升高,细胞的抗氧化能力增强,凋亡减少;且在沉默miR-199b-5p的基础上,采用sh-Klotho转染下调Klotho后细胞抗氧化能力降低,凋亡增加。这提示,LPS导致ROS的过度产生和抗氧化酶的消耗,导致氧化应激、miR-199b-5p的激活和Klotho的下调;下调miR-199b-5p使Klotho的表达增加,细胞的抗氧化能力增强,从而减少细胞凋亡。这表明miR-199b-5p对Klotho的靶向调控作用可能是LPS诱导肾小管上皮细胞损伤的一种潜在机制。
综上所述,miR-199b-5p在LPS诱导的大鼠肾小管上皮细胞损伤中的表达升高,沉默miR-199b-5p可能通过靶向上调Klotho的表达,增强细胞的抗氧化能力,从而减少肾小管上皮细胞凋亡。

