产科抗磷脂综合征的临床诊治现状研究
李燕茹 彭静 陈卓
650100 昆明市第一人民医院产科,云南昆明
抗磷脂综合征(APS)是由体内多种抗磷脂成分与磷脂结合蛋白抗体介导的以反复动静脉血栓和(或)病态妊娠(妊娠早期流产和中晚期死胎)为特征的获得性易栓性疾病[1]。APS 主要有两大表现:反复血栓形成、妊娠早期流产和中晚期死胎,伴有抗磷脂抗体(APL)持续高效价阳性,上述症状可以单独或多个共同存在。其他表现还包括血小板减少、溶血性贫血、网状青斑、心瓣膜赘生物及舞蹈症等。
产科抗磷脂综合征(OAPS)与风湿免疫科APS的在免疫学、病理学、实验室指标等方面均有明显差异。内科、风湿免疫科的APS 以血栓发生为主,OAPS 不以血栓为首发症状,仅有2.5%~5%的血栓发生率,而是以病理妊娠为首发症,临床往往以早发型子痫前期(<34周)、早产、死胎、胎盘功能不良、HPLLE综合征、血小板减少等就诊。如用经典的APS 诊断标准,会导致部分OAPS患者被漏诊,且延误治疗。病态妊娠的产科表现:早期反复流产(胚胎停育)、中期死胎、早发型子痫前期(<34 周)胎盘功能不全(羊水少、胎儿宫内窘迫、胎儿宫内生长受限、胎心监护异常、脐动脉舒张期断流)等。
APS基础研究综述
APL是诊断APS的重要依据,是引起流产和不孕的最主要自身抗体,其中以标准APL 三项最有临床相关性,即抗心磷脂抗体、抗β2-糖蛋白抗体、狼疮抗凝物,也就是典型APL 三项[2]。除了典型APL 三项,还有一些非典型APL可以协助诊断APS,这些非典型APL包括:抗磷脂酰丝氨酸、抗蛋白C抗体、抗蛋白S抗体等[3]。OAPS临床症状常见但非特异性,最终诊断取决于APL 阳性。OAPS 诊断至少要有一项APL阳性和一项临床诊断标准。实验室诊断标准要求中至高滴度的APL 三项;要持续至少间隔12 周的2 次或多次阳性结果;抗体高滴度和多抗体阳性诊断准确率高[4]。
APL 不但出现在APS、OAPS,与反复流产和病理产科相关,而且约5%健康人可出现APL 阳性,其他免疫系统疾病患者也有较高阳性率。狼疮抗凝物(LA)阳性和APS 患者,产科结局不良。APL 阳性可见于多种疾病如梅毒和艾滋病、Lyme 病、传染性单核细胞增多症、结核,且分别有93%、39%、20%、20%的APL 阳性率。某些药物比如酚噻嗪、普鲁卡因酰胺、氯丙嗪、肼苯哒嗪、苯妥英钠、奎宁普萘洛尔、口服避孕药可至APL 阳性;某些肿瘤,如黑色素瘤、肺癌、淋巴瘤、白血病、肾母细胞瘤也可以出现,APL 阳性和抗β2糖蛋白抗体阳性。
APL 可通过抗β2糖蛋白抗体和(或)LA 结合靶向磷脂分子,损伤血管内皮,形成血栓,导致局部组织的血供障碍,进而导致靶器官的各种损坏[5]。APS 累及子宫时,主要表现为孕期胎盘血管血栓形成,胎盘梗死、胎盘血供不足、宫内缺氧、胎儿心律异常、羊水过少、早产或流产。APS 在反复流产患者中占5%~20%,是反复流产最重要的病因之一。APS 出现病理妊娠概率51.0%~68.4%,LA 与临床事件的相关性最好,抗β2糖蛋白抗体与血栓形成相关性高。
APS的临床研究综述
特殊类型APS 包括:OAPS、非标准(非典型)OAPS、难治性OAPS、灾难性APS。典型OAPS 和非典型OAPS的诊断见图1。
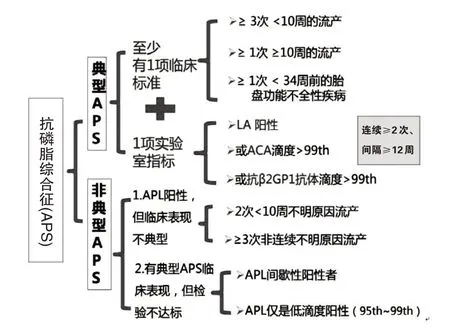
图1 抗磷脂综合征诊断标准
典型的APS流产多发生于妊娠10周之后,B超检查已见到胎心搏动,但亦可能发生的更早,与APL的滴度无关[6]。
2011年中国APS 诊断和治疗指南将APS 分为原发性、继发性和恶性、难治性产科APS[7]。⑴原发性APS:是指符合APS 诊断标准,且无其他自身免疫病或其他诱导APS 产生的疾病,如感染、恶性肿瘤、血液透析或药物等。原发性APS 病因不明,可能与遗传、感染等有关。⑵继发性APS:多为自身免疫性疾病基础上发生的APS:如系统性红斑狼疮、类风湿性关节炎、干燥综合征等结缔组织疾病。原发性APS 和继发性APS 的血栓等临床表现相似。⑶恶性APS:也称灾难性APS,临床罕见,表现为短期内进行性广泛血栓,并形成造成多器官衰竭甚至死亡。1%的APS 患者可发展为恶性APS。⑷难治性产科APS[8]:①典型的OAPS;②既往妊娠发生了与APL 阳性中高滴度,在联合多种抗凝剂(阿司匹林和低分子肝素)治疗后仍然发生了流产、死胎、早发型子痫前期等病理产科事件;③不良妊娠。
确诊APS 患者再次妊娠的建议:随访5年以上,以排除继发于系统性红斑狼疮或其他自身免疫性疾病。既往有系统性红斑狼疮病史者,需要病情稳定1年以上(至少0.5年),停用细胞毒免疫抑制剂,糖皮质激素停药或小剂量维持用药,(<15 mg/d),无重要脏器受累,方可妊娠。
OAPS 的治疗:OAPS 治疗目的与用药原则:抗凝抗免疫、预防血栓、防止流产、对症治疗。根据患者的不同临床表现、不同孕周,病情严重程度和对治疗药物的反应,制定恰当的孕前、孕期、产后个体化的治疗方案。OAPS 孕妇需要产科和风湿科共同管理,孕前、孕期、产后酌情选用抗凝剂、糖皮质激素、免疫抑制剂及对症治疗。服羟氯喹前常规做眼底检查,以后每半年复查眼底。
OAPS 孕前处理原则:①孕10 周前的反复流产:仅APL异常者,备孕期开始每天口服小剂量阿司匹林50~100 mg,或联合应用羟氯喹,0.1 g,2次/d;APL阳性同时有其他自身抗体异常,备孕前1~3个月口服阿司匹林+羟氯喹。②孕10 周后发生的大孕周胎死宫内:一项或多项APL 异常者,备孕前1~3个月开始服阿司匹林50~100 mg/d+羟氯喹0.1 g,2次/d;排卵后注射低分子肝素(LMWH)100 IU/(kg·d),未孕停药,孕后改为200 IU/(kg·d)。
OAPS和非标准OAPS的孕前治疗方案相同。
产科APS 孕期处理原则:孕12~28 周或全孕期口服阿司匹林50~100 mg/d;全孕期口服羟氯喹0.2~0.4 mg/d,产后酌情停服羟氯喹;酌情使用甲泼尼龙4~8 mg/d,或强的松5~10 mg,6∶00~8∶00顿服,孕12~28 周停药;全孕期注射LMWH 200 IU/(kg·d),产后继续注射6~12周;孕期检查多种自身抗体异常或合并其他自身免疫性疾病,阿司匹林+羟氯喹+LMWH,酌情加用环孢素或他克莫司;环孢素2~3 mg/(kg·d),他克莫司0.03~0.06 mg/(kg·d)[9-10]。
非标准产科APS 孕期处理原则:孕12~28 周或全孕期口服阿司匹林50~100 mg/d;口服羟氯喹,0.1 g,2 次/d;酌情服甲泼尼龙4 mg/d,或强的松5 mg,6∶00~8∶00 口服,孕8~12 周停药;注射LMWH 200 IU/(kg·d);孕后每个月复查APL 三项,APL 持续阳性或间断阳性,参照典型OAPS 治疗,全孕期及产后注射LMWH;连续2~3 个月复查APL 阴性,酌情停LMWH 和羟氯喹,继续口服阿司匹林;停药后复查APL 再次出现阳性,改为全孕期注射LMWH[11-12]。
既往大孕周死胎的孕期处理原则:曾经有孕>10 周形态学正常的胚胎停育,尤其是中晚孕不明原因的胎死宫内,无论孕期APL 连续或间断阳性或阴性,孕后均应参照典型APS 抗凝治疗[13]。
OAPS 产后抗凝治疗:APS 孕妇产后3 个月内发生血栓的风险极大,产后12~24 h在排除产后出血的情况下,开始注射LMWH 200 IU/(kg·d);注射7~10 d复查D-二聚体,D-二聚体正常后LMWH 素减量,100 IU/(kg·d),酌情持续注射6~12 周;如果可能,在产后2~3 周把LMWH 改为华法林。
APS 若得不到治疗,再次妊娠的活产率约10%;单用小剂量阿司匹林治疗,活产率约50%;联合LMWH等治疗,活产率约70%[14]。
总 结
APS 患者的妊娠给产科、风湿免疫科、心血管内科、肾内科、血液科、感染科、ICU、生殖科、神经内科等多学科专业带来了严峻的挑战。产科面对自身免疫性疾病患者的增多,应拓展临床思维,加强学习,与其他学科密切协作配合,准确评估和密切监测这类患者,做好孕前尽早诊断评估,决定妊娠时机,重视规范全疗程联合药物治疗,有病情恶化者及时终止妊娠,加强孕中、产后的母胎管理,最大限度减少母胎不良结局。

