探讨高病毒载量HBeAg阳性慢性乙型肝炎患者应用替诺福韦和恩替卡韦治疗效果研究
陈青林
222100 赣榆区人民医院消化内科,江苏连云港
由乙肝病毒(HBV)复制等因素诱发的慢性乙型肝炎(CHB)属于临床十分常见的一种慢性传染性疾病,如不加以重视和治疗,不仅会加重肝功能损害,引发肝硬化、肝腹水等疾病,而且还会增高肝癌的发病率,进而严重威胁患者的生存安全。研究指出,高乙肝病毒载量(HBV-DNA)是导致CHB 患者合并肝硬化、肝癌等危重疾病的关键因素[1]。为了有效抑制病毒的反复复制,延缓疾病进展,减少相关并发症,临床通常会对CHB 患者进行抗病毒治疗。余力等[2]认为,在高病毒载量乙肝病毒e 抗原(HBeAg)阳性CHB 治疗中应用核苷类似物,如替诺福韦、恩替卡韦等,能够使患者获得一定的药物疗效。鉴于此,选取高病毒载量HBeAg 阳性CHB 患者68 例作为观察对象,经分组治疗和讨论,旨在探究替诺福韦、恩替卡韦等药物在临床中的治疗效果,现报告如下。
资料与方法
2019年10月-2021年8月收治高病毒载量HBeAg阳性CHB 患者68 例,随机分为对照组与试验组,各34例。对照组男23例,女11例;年龄23~64岁,平均(45.96±4.82)岁;病程4~21年,平均(10.89±5.74)年。试验组男24例,女10例;年龄20~64岁,平均(46.02±4.77)岁;病程3~22年,平均(10.91±5.68)年。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:①满足《病毒性肝炎防治方案》中关于“高病毒载量HBeAg阳性CHB”的诊断标准[3];②年龄18~65 岁;③具有良好的治疗依从性;④HBV-DNA 107copies/mL;⑤患者及家属均签署知情同意书。
排除标准:①精神病、糖尿病以及甲亢等疾病;②已接受核苷酸类药物治疗;③甲型或丙型肝炎重叠感染;④经免疫调节药物治疗;⑤孕期或哺乳期的妇女。
方法:①对照组选择采用恩替卡韦片,应在餐前或餐后至少2 h 遵医嘱口服恩替卡韦片,1 次/d,0.5 mg/次,不间断治疗48周。②试验组选择采用富马酸替诺福韦二吡呋酯片,1次/d,300 mg/次,口服,不受饮食影响,不间断治疗48周。
观察指标:比较两组患者治疗前、治疗1个月后以及治疗3个月后的丙氨酸氨基转移酶(ALT)复常情况,ALT 复常标准为≤40 IU/L。与此同时,医护人员还应比较两组患者的血清HBV-DNA 水平、HBV-DNA 转阴率以及HBeAg 血清学应答率。经检测,患者的HBV-DNA<500 copies/mL 表示为阴性;患者的HBeAg血清学应答水平(S/Co)≥1表示为阳性。
统计学处理:数据应用SPSS 23.0软件处理;计数资料以[n(%)]表示,采用χ2检验;计量资料以(±s)表示,采用t检验;P<0.05为差异有统计学意义。
结 果
两组患者在不同时间段内的ALT 复常情况比较:试验组治疗1 个月及3 个月后的血清ALT 水平均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者在不同时间段内的ALT复常情况比较(±s,U/L)
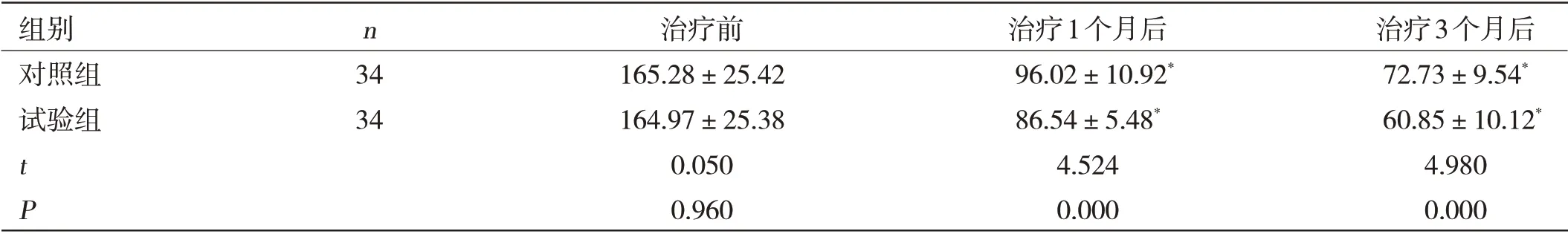
表1 两组患者在不同时间段内的ALT复常情况比较(±s,U/L)
组别 n 治疗前 治疗1个月后 治疗3个月后对照组 34 165.28±25.42 96.02±10.92* 72.73±9.54*试验组 34 164.97±25.38 86.54±5.48* 60.85±10.12*t 0.050 4.524 4.980 P 0.960 0.000 0.000
两组患者在不同时间段内的血清HBV-DNA水平比较:试验组治疗1 个月及3 个月后的血清HBV-DNA水平均明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者在不同时间段内的血清HBV-DNA水平比较(±s,IgIU/mL)
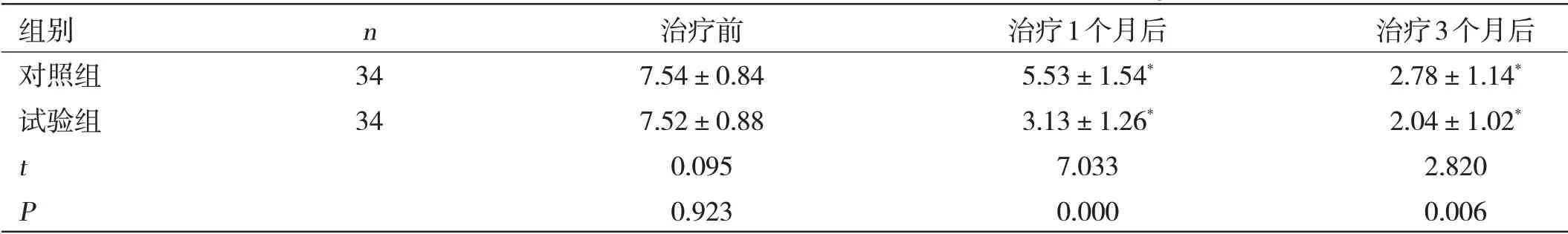
表2 两组患者在不同时间段内的血清HBV-DNA水平比较(±s,IgIU/mL)
注:与本组治疗前比较,*P<0.05
组别 n 治疗前 治疗1个月后 治疗3个月后对照组 34 7.54±0.84 5.53±1.54* 2.78±1.14*试验组 34 7.52±0.88 3.13±1.26* 2.04±1.02*t 0.095 7.033 2.820 P 0.923 0.000 0.006
两组患者在不同时间段内的HBV-DNA 转阴率与HBeAg 血清学应答率比较:试验组治疗3 个月后的HBV-DNA 转阴率明显高于对照组,差异有统计学意义(P<0.05);两组治疗1 个月及3 个月后的HBeAg 血清学应答率比较,差异无统计学意义(P>0.05)。见表3。
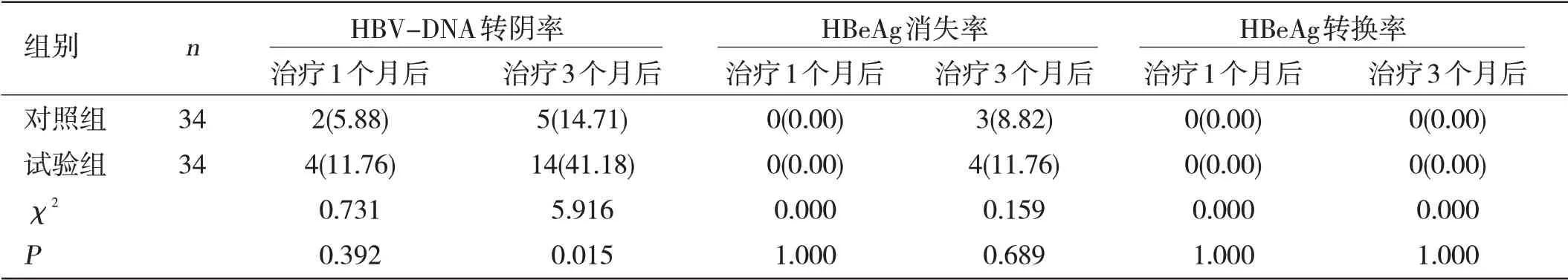
表3 两组患者在不同时间段内的HBV-DNA转阴率与HBeAg血清学应答率比较[n(%)]
讨 论
CHB 是严重的危害公众身体健康的疾病之一,也是临床中常见且具有传染性的疾病。随着卫生公共事业的不断发展,人们对于乙型肝炎认知程度以及传染途径的了解均有提升,可以在日常生活中养成良好的习惯。除此之外,通过接种乙型肝炎疫苗也可以有效预防CHB 的发生[4]。虽然采取相应的防控措施,但是在我国仍旧有较多患者因CHB 引发肝硬化、肝癌,因此重视对此疾病的临床治疗,有效延缓病情的发展,避免疾病的传播有着重要意义[5]。
CHB病程时间较长且常超过半年或者是发病日期不规律而出现慢性肝炎症状。在临床中主要表现为乏力、畏食以及腹胀、恶心等症状。肝变大且质地较硬,出现压痛感,病情较为严重者可能会出现慢性肝病面容、肝掌、肝功能异常等现象,依据临床的主要表现可将其分为轻度、中度和重度CHB。CHB 的出现不仅会引起肝硬化、肝功能衰竭等危重病证,甚至还会诱发肝癌,严重威胁患者生命安全。对CHB 患者来讲,HBeAg 阳性是发生HBV 复制的主要标志,如果HBeAg 转变为阴性,则标志HBV 复制减少,传染性相对减弱。合理应用抗病毒治疗,既能明显减低上述不良情况的发生风险,又能使CHB 患者完成HBeAg 转换,进而延缓病情进展,但是,与普通HBeAg 阳性CHB 患者相比,高病毒载量HBeAg 阳性CHB 患者在抗病毒治疗期间容易出现耐药性较高、应答不佳等问题,增加疾病复发概率的同时,还会进一步提高治疗难度。因此,临床应积极探寻治疗高病毒载量HBeAg 阳性CHB 的有效方案。
恩替卡韦是鸟嘌呤核苷类似物的抗病毒药物,总体的抗病毒作用相对较好,对于HBV 多聚酶具有一定抑制作用,起效时间较快,耐药性较低患者在用药过程中安全性较高,作为CHB患者抗病毒治疗的首选。高病毒载量HBeAg 阳性CHB 患者服用恩替卡韦后,虽然能够明显减低HBV 活性,有效抑制HBV-DNA 的合成,但始终无法取得满意的HBeAg 血清学应答率。替诺福韦作为一种新型的核苷酸类逆转录酶抑制剂,可以有效对抗多种病毒,在临床应用中可以有效改善机体中肝功能的各项指标,有效避免乙肝病毒对患者肝功能造成更大的影响,临床治疗安全性较高。因此,将替诺福韦用于治疗高病毒载量HBeAg 阳性CHB,不仅能迅速、持续地抑制HBV复制,阻碍患者耐药性的提升,而且可以使患者获得较为理想的HBV-DNA 转阴率,进一步改善患者肝功能。本研究结果显示,试验组治疗1 个月及3 个月后的血清ALT 水平、血清HBV-DNA水平均明显低于对照组,试验组治疗3 个月后HBV-DNA 转阴率明显高于对照组,由此说明,替诺福韦、恩替卡韦等药物对高病毒载量HBeAg阳性CHB 患者均具有良好效果,但就病毒抑制作用而言,替诺福韦更优于恩替卡韦。ALT 属于肝细胞中存在的一种酶,如果肝细胞出现损伤,血液中的ALT 水平会出现升高,因此测定ALT 可以有效观察患者的肝功能损伤程度。两组治疗1个月及3 个月后的HBeAg 血清学应答率比较,无显著差异,考虑其原因可能与进行随访的时间有较大关系。
综上所述,临床治疗高病毒载量HBeAg 阳性CHB 时均可使用替诺福韦、恩替卡韦等药物,但与恩替卡韦相比,替诺福韦的安全性及有效性更为突出,可被当作治疗该类疾病的首选药物。

