CHD1L对胃癌细胞增殖、侵袭及转移的影响
李迪诺,李谌
(1.锦州医科大学附属第一医院胃外科;2.锦州医科大学附属第一医院分子检测中心,辽宁 锦州 121000)
胃癌是全球第二大常见的恶性肿瘤[1]。原癌基因的激活、抑癌基因的缺失等在胃癌的发生发展中扮演重要角色[2]。
CHD1L(chromodomain helicase/adenosine triphosphatase DNA binding protein 1-Like,CHD1L)位于人类1号染色体的长臂的1q21区,由53152个碱基对组成,包含23个外显子、一个编码长度为897个氨基酸的蛋白质开放阅读结构和一个保守区域[3-4]。
CHD1L过表达会导致染色质过度松弛,使DNA碱基发生错配现象,导致癌症的演变[5-6],过度表达CHD1L显著促进结肠癌细胞增殖、侵袭和迁移,沉默CHD1L基因可降低前列腺癌细胞的侵袭迁移能力[7],下调CHD1L mRNA表达水平肝癌细胞增殖能力、迁移和侵袭能力明显下降[8];靶向CHD1L通过PI3K/Akt/MMP信号通路可以抑制乳腺癌细胞的侵袭[9];但能否促进胃癌细胞的增殖、凋亡、侵袭转移未有相关研究,本文通过研究胃癌生物学行为过程中CHD1L信号通路调控机制,探究其潜在价值。
1 材料与方法
1.1 实验材料
人胃粘膜上皮细胞株GES-1和胃癌细胞株SGC-7901、MKN-45、MGC-823、MGC-803来源于国家中心细胞库,胃癌MGC-823细胞株中的CHD1L表达含量较高,可以用于后续试验。
慢病毒pLVshRNA-Puro构建由美国Clon-tech公司完成、Western Blot测定相关试剂与耗材、细胞增殖活性、凋亡检测相关试剂与耗材购自美国Invitrogen公司、细胞侵袭试验所需试剂与耗材由Millipore公司提供。
1.2 实验方法
1.2.1 慢病毒shRNA序列构建
GENEBANK数据库对CHD1L mRNA全序列进行搜索,利用在线设计软件(http://www.exiqon.com/),设计特异性shRNA序列(CHD1L-shRNA-1、CHD1L-shRNA-2、CHD1L-shRNA-3)。将pLVshRNA-Puro片段(NotⅠ和EcoRⅠ双酶切处理)与5’端磷酸化,互补片段退火处理后的合成片段连接,命名为pLVshRNA-Puro-CHD1L,阴性对照组命名为pLVshRNA-Puro-NC,利用大肠杆菌K-12的衍生菌DH5α制备阳性克隆质粒,经测序鉴定后将阴性对照质粒和干扰质粒进行包装后保存于-80 ℃冰箱内。
1.2.2 慢病毒感染MGC-823细胞
将MGC-823细胞接种于6孔板中(2×105个/孔),分别取3组0.5 mL浓缩病毒和阴性对照感染MGC-823细胞48 h后,将嘌呤霉素加到继续培养24 h后的细胞中,使其最终浓度为0.25 μg/mL,48 h后会形成细胞克隆,扩大培养单克隆细胞集落。
1.2.3 沉默CHD1L干扰序列的筛选
MGC-823细胞被慢病毒感染后提取其总蛋白,Western Blot计算CHD1L蛋白和β-actin蛋白积分光密度(integrated optical density,IOD),筛选出沉默率最大的干扰组序列。
1.2.4 Western Blot测定胃癌细胞相关蛋白的表达
利用沉默率最大的慢病毒感染MGC-823细胞后,Western Blot测定与胃癌细胞p53、p21、Nur77、ARHGEF9的表达。
1.2.5 CHD1L沉默对胃癌细胞增殖与凋亡的影响
1.2.5.1 MTT测定CHD1L沉默对胃癌细胞增殖的影响
96孔细胞培养板中接种200 μL稀释好的MGC-823细胞(1×103个/孔),利用MTT细胞活力测定法,对细胞生长增殖抑制率进行测定与统计学分析。
抑制率(%)=(1-干扰组OD/对照组OD)×100%
1.2.5.2 流式细胞测定CHD1L沉默对胃癌细胞凋亡的影响
MGC-823被慢病毒感染48 h后,经胰酶消化、PBS重悬漂洗、离心,继续常规培养,24 h后胰酶消化成单细胞悬液,利用Attune NxT流式细胞仪测定CHD1L沉默对胃癌细胞凋亡的影响。
1.2.6 CHD1L沉默对胃癌上皮细胞-间充质转化的影响
将MGC-823细胞各分为两部分(5×105个/毫升)。Transwell小室侵袭在培养48 h后对迁移的细胞数、细胞划痕愈合测定方法对细胞间距离的均值进行测定和统计学分析,探讨其对胃癌上皮细胞-间充质转化的影响。
抑制率=(对照组-干扰组)/对照组×100%
1.2.7 统计学方法

2 结 果
2.1 慢病毒感染胃癌细胞介导CHD1L基因沉默细胞株的建立
慢病毒感染MGC-823细胞48 h后,荧光蛋白表达率约为50%,随着传代次数的增加(3代、15代、25代),荧光蛋白表达率能稳定的保持在95%左右,说明慢病毒可稳定与靶细胞的基因组进行整合,见图1。

A:CHD1L-shRNA-1组;B:CHD1L-shRNA-2组;C:CHD1L-shRNA-3组;D:阴性对照组
2.2 胃癌细胞CHD1L蛋白的表达情况
与阴性对照组相比,CHD1L-shRNA-1、CHD1L-shRNA-2、CHD1L-shRNA-3干扰下胃癌细胞CHD1L蛋白表达量均下降,具有统计学意义(P=0.013、P=0.035、P=0.027),CHD1L-shRNA-1基因沉默效果最好,可进行后续的实验,见图2~3。
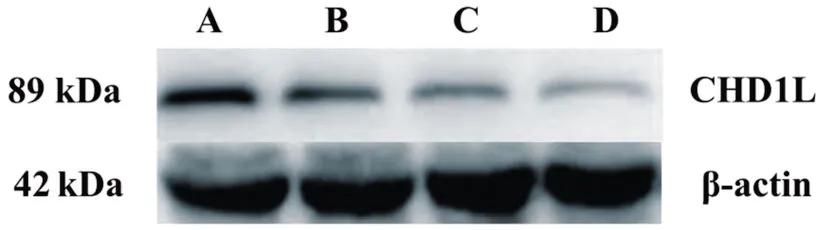
A:NC对照组β-actin与CHD1L蛋白表达;B:CHD1L-shRNA-3组β-actin与CHD1L蛋白表达;C:CHD1L-shRNA-2组β-actin与CHD1L蛋白表达;D:CHD1L-shRNA-1组β-actin与CHD1L蛋白表达
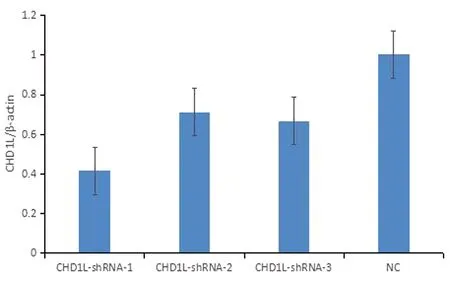
图3 Western Blot免疫印迹检测CHDIL蛋白表达
2.3 CHD1L沉默对胃癌细胞相关蛋白表达的影响
CHD1L-shRNA-1干扰下的胃癌细胞p53蛋白质表达量比对照上调31.24%,具有统计学意义(P=0.041);Nur77蛋白质表达量比对照上调52.36%,具有统计学意义(P=0.026);p21表达水平提高了48.37%(P=0.030);ARHGEF9蛋白质表达量比对照上调49.78%,具有统计学意义(P=0.019),CHD1L沉默对与肿瘤发生发展有抑制作用的效应分子产生促进作用,见图4。
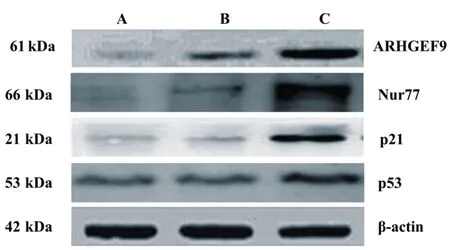
A:阴性对照组不同蛋白表达情况;B:空白对照组不同蛋白表达情况;C:CHD1L-shRNA-1组不同蛋白表达情况
2.4 MTT测定CHD1L沉默对胃癌细胞增殖的影响
与对照组相比,MGC-823细胞的增殖过程被抑制,作用时间的不断延长,MGC-823细胞的抑制率也不断增加,具有统计学意义(P<0.05),见图5。
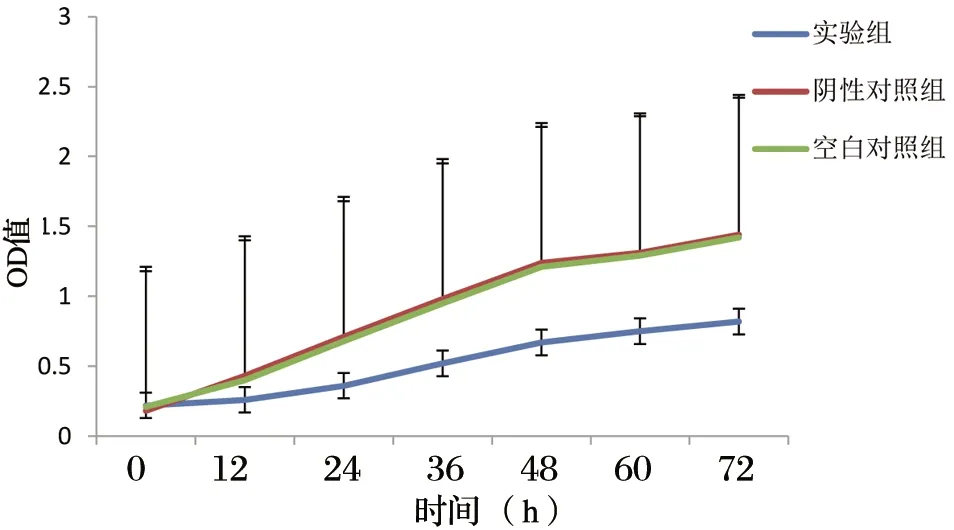
图5 CHD1L沉默时间对胃癌细胞细胞活力变化的影响
2.5 流式细胞术测定CHD1L沉默对胃癌细胞凋亡与周期分布的影响
CHD1L-shRNA-1与对照组细胞相比凋亡趋势明显(P=0.025),说明CHD1L沉默可以诱导MGC-823细胞凋亡;与对照组相比,MGC-823细胞中CHD1L被沉默后S、G1期细胞数量分别呈现明显的减少、增多趋势,细胞周期明显被阻滞在G1期,具有统计学意义(P=0.028、P=0.016),见图6~9。
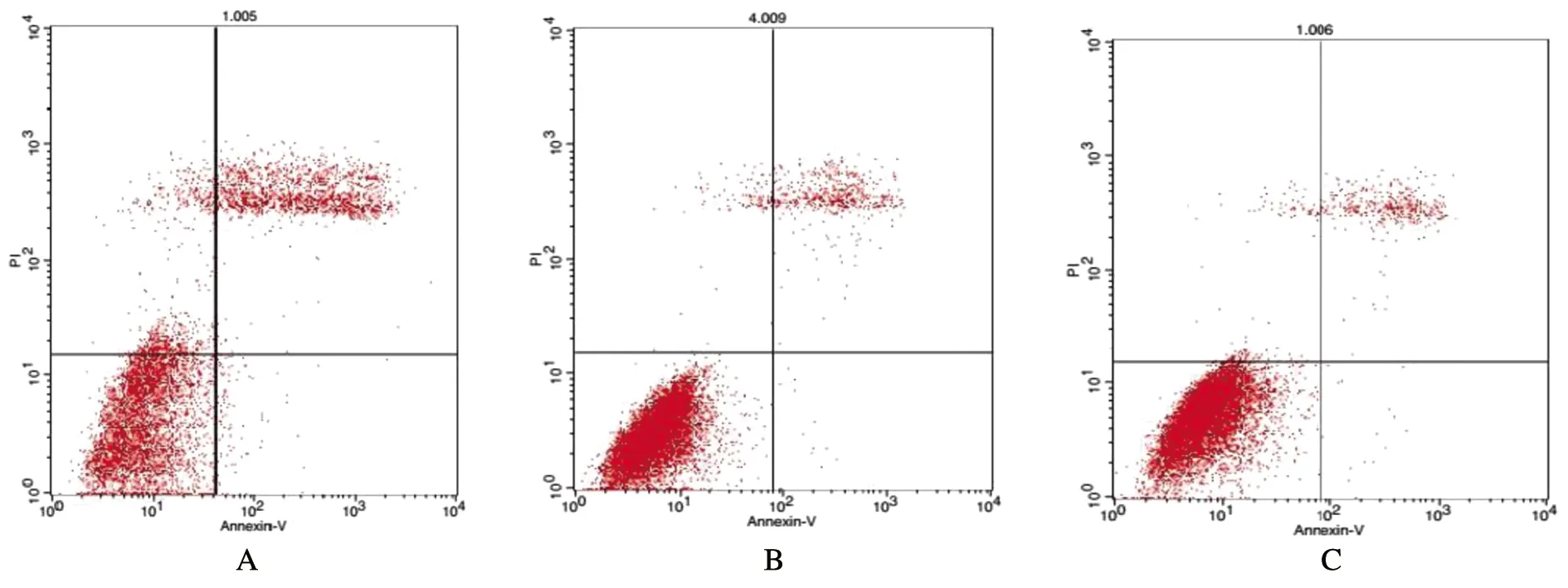
A:CHD1L-shRNA-1实验组胃癌细胞凋亡情况;B:阴性对照组胃癌细胞的凋亡情况;C:空白对照组胃癌细胞的凋亡情况
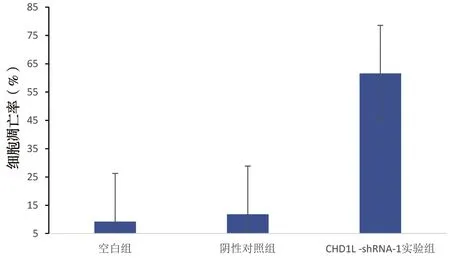
图7 CHD1L沉默后胃癌细胞凋亡率

A:CHD1L-shRNA-1实验组胃癌细胞分布周期;B:阴性对照组胃癌细胞分布周期;C:空白对照组胃癌细胞分布周期
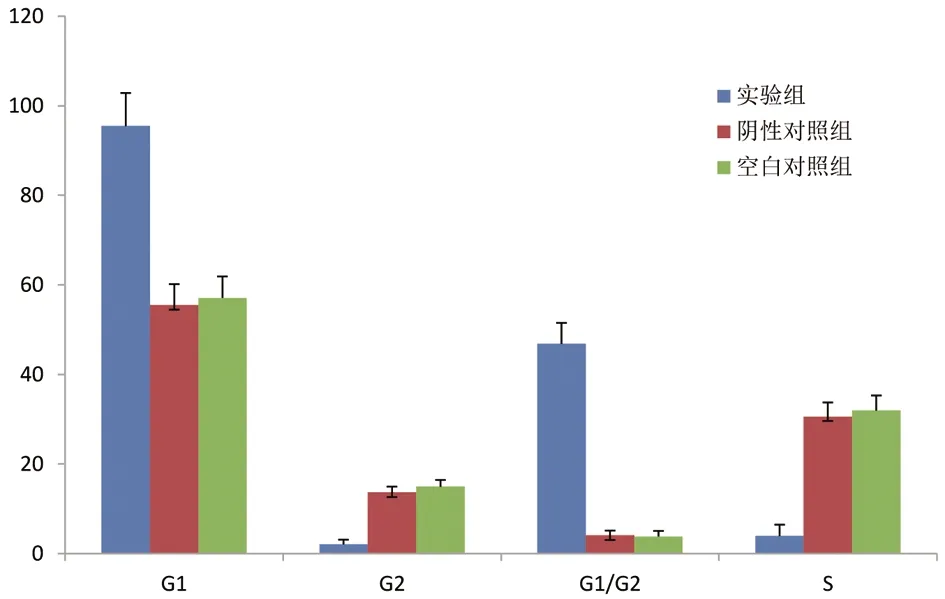
图9 CHD1L沉默后胃癌细胞周期分布
2.6 CHD1L沉默对胃癌上皮细胞-间充质转化的影响
2.6.1 CHD1L沉默对胃癌细胞侵袭的影响
CHD1L沉默48 h后,实验组比阴性对照组穿膜细胞数量明显减少(P=0.042),抑制率为59.55%,说明沉默CHD1L能显著抑制MGC-823细胞的侵袭力,见图10 和表1。
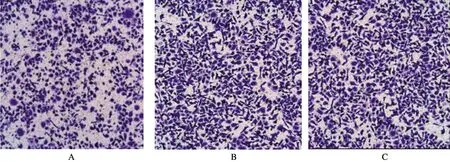
A:CHD1L-shRNA-1实验组胃癌细胞侵袭情况;B:阴性对照组胃癌细胞侵袭情况;C:空白对照组胃癌细胞侵袭情况
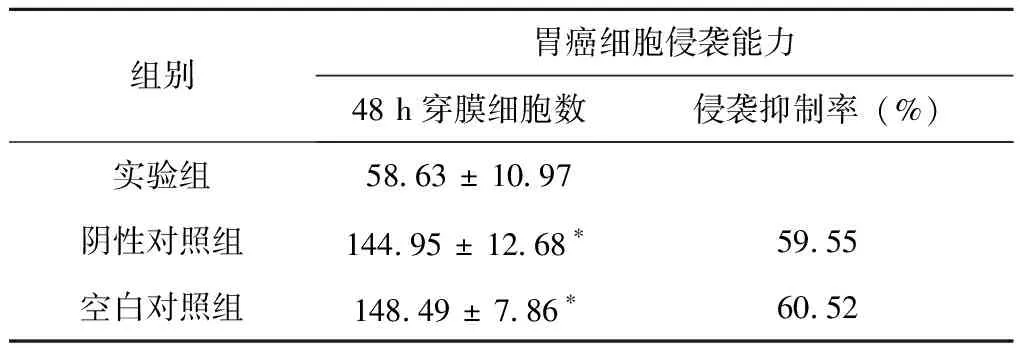
表1 CHD1L沉默后穿膜胃癌MGC-823细胞数量比对
2.6.2 CHD1L沉默对胃癌细胞迁移的影响
CHD1L沉默24 h后,阴性对照组和空白对照组细胞划痕已基本长满,而实验组细胞之间还存在一定距离的间隙;与空白对照组和阴性对照组相比,实验组MGC-823细胞迁移距离缩短为(0.54±0.34)μm,具有统计学意义(P=0.029),说明CHD1L沉默后MGC-823细胞水平运动距离明显降低,有效抑制胃癌细胞的迁移,见图11。
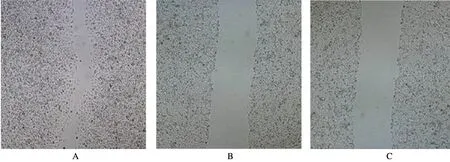
A:CHD1L-shRNA-1实验组胃癌细胞迁移情况;B:阴性对照组胃癌细胞迁移情况;C:空白对照组胃癌细胞迁移情况

表2 CHD1L沉默后后胃癌MGC-823细胞迁移距离
3 讨 论
CHD1L属于SNF-2类家族成员中发挥致癌作用的唯一基因[10]。鼻咽癌和乳腺癌患者中,CHD1L过表达可能会成为重要的预后标志物[11];在肺腺癌患者中,肿瘤转移与过表达CHD1L密切相关[12]。在肝癌患者中,发现CHD1L的扩增和过表达[13]。沉默CHD1L后MGC-823细胞增殖过程被抑制,推测沉默CHD1L后,一些抑癌基因表达水平显著提高实现对肿瘤细胞DNA合成的抑制,说明CHD1L可能为临床基因治疗提供新的靶点。
在细胞外的调节细胞生长、分化、凋亡等信号刺激下,诱导孤儿受体超家族Nur77与CHD1L结合后,能使其具有抗细胞凋亡的能力[14-16],本实验发现CHD1L沉默可以诱导胃癌MGC-823细胞凋亡,推测CHD1L沉默后其转录水平发生变化,阻碍了Nur77从细胞核到线粒体的移动[17]。
生长肿瘤细胞上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤的侵袭和转移过程发挥至关重要的作用[18]。本实验发现:在迁移距离和穿膜细胞数量方面实验组明显减少,具有统计学意义(P<0.05);ARHGEF9在信号通路和肌动蛋白细胞骨架调节方面起关键作用[19],ARHGEF9是通过免疫共沉淀CHD1L相关的基因克隆所得,推测CHD1L沉默可以上调ARHGEF9和Cdc42-GTP表达水平,抑制了再生化的肌动蛋白形成伪足样结构的步骤,对胃癌细胞的远处转移和侵袭过程进行抑制。

