miR-4282对肝癌细胞侵袭、迁移能力的影响
王汇锋,陈洁,赵咫龙
(1.锦州医科大学附属第三医院普外科,辽宁 锦州 121000;2广西医科大学附属肿瘤医院肝胆外科,广西 南宁 530000)
原发性肝癌(以下简称肝癌)是恶性肿瘤中发病率高居前列。2020年有研究统计,在全球多个国家和地区,东亚地区肝癌发病率和死亡率占2018年新发及死亡患者的一半以上,而中国的5年发病率位于日本和美国后居第三[1]。另有统计,在185个国家常见癌症的统计中,肝癌的发病率居第6位,死亡率居第4位[2]。迄今为止,针对肝癌的诊断和预后评估临床上仍主要依靠影像学及AFP等肿瘤标志物,因此开发新的标志物逐渐成为肝癌研究的热点之一。因此,对肝癌分子机制的研究十分重要,可以从机制方向打开对肝癌新的认识,并寻求新的发现。而且,机制研究将为揭示肝癌的发生发展提供依据,并为其诊断、临床治疗及预后评价提供理论依据及选择支持。
MicroRNA是一类长度为22~28个核苷酸的非编码单链RNA分子,它们可参与转录后基因的表达调控。研究证实miRNA对肿瘤的生长、迁移、分化等功能变化存在一定的影响[3]。因此,对于miRNA的研究有助于揭示肿瘤的发生发展机制,为判断预后和临床治疗提供依据。针对miRNA和肝癌,一直有相关研究报道,miRNA的异常表达影响肝癌的发生发展[4-5],并且已有文献显示miR-4282与其他肿瘤相关[6-8],但其与肝癌的关系尚不清楚。因此,本研究主要就miR-4282与肝癌细胞之间的关系进行实验。
1 材料与方法
1.1 实验对象
人肝癌细胞系SMMC-7721(上海生命科学院细胞库)在完全培养基[DMEM(Gibco)、胎牛血清(Gibco)和青霉素/链霉素],37 ℃,5% CO2中培养。
1.2 方法
1.2.1 瞬时转染:准备miR mimics和inhibitor(锐博)分别按说明书配置后加入含120 μL Opti-MEM(Gibco)的离心管中混匀,其中mimics取50 nM,inhibitor取100 nM。静置5 min,加入5 μL LipofectamineTM6000(Lipo6000TMTransfection Reagent; Beyotime)混匀,静置20 min后将混合液均匀轻柔加入孔板中,再加300 μL Opti-MEM,培养6 h后补足培养基,48 h后收集细胞进行实验。
1.2.2 实时荧光定量PCR:(1)采用Trizol(Invitrogen)法按说明书操作提取各组细胞的总RNA;(2)miRNA逆转录和qRT-PCR分别按照miRcute Plus miRNA First-Strand cDNA Synthesis Kit(TIANGEN)和miRcute Plus miRNA qPCR Detection Kit(TIANGEN)说明书操作完成;(3)mRNA逆转录和qRT-PCR按照PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TAKARA)和FastStart Universal SYBR Green Master(ROX)(Roche)说明书操作完成;(4)所有qRT-PCR应用STEPONE PLUS(ABI)完成,采用2-△△CT法处理结果。
GRB2:Forward:5’-CTTAGCAAACAGCGGCACGA-3’;Reverse:5’-TACTTCCCGGCTCCATCTCG-3’
β-actin:Forward:5’-CACCTTCTACAATGAGCTGCGTGTG-3’;Reverse:5’-ATAGCACAGCCTGGATAGCAACGTAC-3’
1.2.3 Transwell迁移实验:上室内加入200 μL DMEM重悬的4×104个细胞,下室加入600 μL完全培养基。培养24 h后擦去上室细胞,甲醇固定30 min,0.1%结晶紫染色1 h后拍照计数。
1.2.4 Transwell侵袭实验:实验前12 h将Matrigel∶DMEM=1∶8的混合液滴入上室后置于培养箱内。实验前弃上室液体,用200 μL DMEM重悬5×104个细胞并加入上室,下室加入600 μL完全培养基。培养24 h后擦去上室细胞,甲醇固定30 min,0.1%结晶紫染色1 h后拍照计数。
1.2.5 细胞划痕实验:准备新孔板并在背面用记号笔划一道直线,接种细胞后过夜,孔板中细胞饱和度达80%以上视为接种满意,随后用无菌枪头在细胞生长区垂直记号笔划一直线,加入无血清培养基,48 h后添加5%含血清培养基。分别在0、24、48、72、96 h时间点以孔板背面直线和划痕相交处拍照,以保证每次拍照于同一视野处。细胞迁移率(MR),MR(%)=[(L0-SLtime point)/L0]×100%。
1.2.6 3’-UTR荧光素酶报告基因测定:将人GRB2 mRNA 3’-UTR序列克隆到pMIRGLO中制备GRB2 3’-UTR载体,PCR合成GRB2 3’-UTR突变结合位点。根据 LipofectamineTM2000 Transfection Reagent(Life Technologies)进行转染,质粒每孔转染 100 ng,miRNA 每孔转染100 nM,转染后48 h按照Dual-Luciferase Reporter Assay System(Promega)说明书进行双荧光素酶检测,结果取海肾荧光值与萤火虫荧光值比值。
1.2.7 蛋白提取和Western Blot:收集实验细胞置于冰上,用RIPA(Biotopped)∶PMSF(Solarbio)=100∶1新制裂解液裂解15 min后,12 000 rpm 4 ℃离心15 min,取上清液即为蛋白并用BCA试剂盒(CWBIO)测蛋白浓度。取各组蛋白应用10% SDS-PAGE分离胶及5% SDS-PAGE浓缩胶进行电泳直至分离胶末端,100 V恒压转膜90 min,5%脱脂奶粉封闭120 min,一抗4 ℃孵育过夜,二抗孵育2 h,ECL试剂盒显色,拍照。GAPDH一抗(Cell Signaling Technology),Ras一抗(Abcam)。
1.3 统计学方法及生物信息学

2 结 果
2.1 转染效率验证
qRT-PCR验证miR-4282 mimics和inhibitor的转染情况,mimics表达量(28.326±2.301)高于NC(1.052±0.0854),t=16.196,P=0.004。inhibitor表达量(0.287±0.037)低于NC(1.075±0.193),t=27.320,P=0.001,见图1。
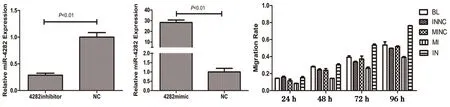
A B C
2.2 miR-4282表达量变化后迁移能力的变化
通过细胞划痕实验,结果如表1所示,上调组愈合率增长减慢,下调组愈合率增长迅速,见图1C、图2。miR-4282上调后迁移细胞多于对照组[(8±3)vs(30±4),F=46.784,P=0.000],miR-4282下调后低于对照组[(45±5)vs(31±9),F=11.824,P=0.000],空白组(30±8),见图3。

图2 细胞划痕对比图(照片)
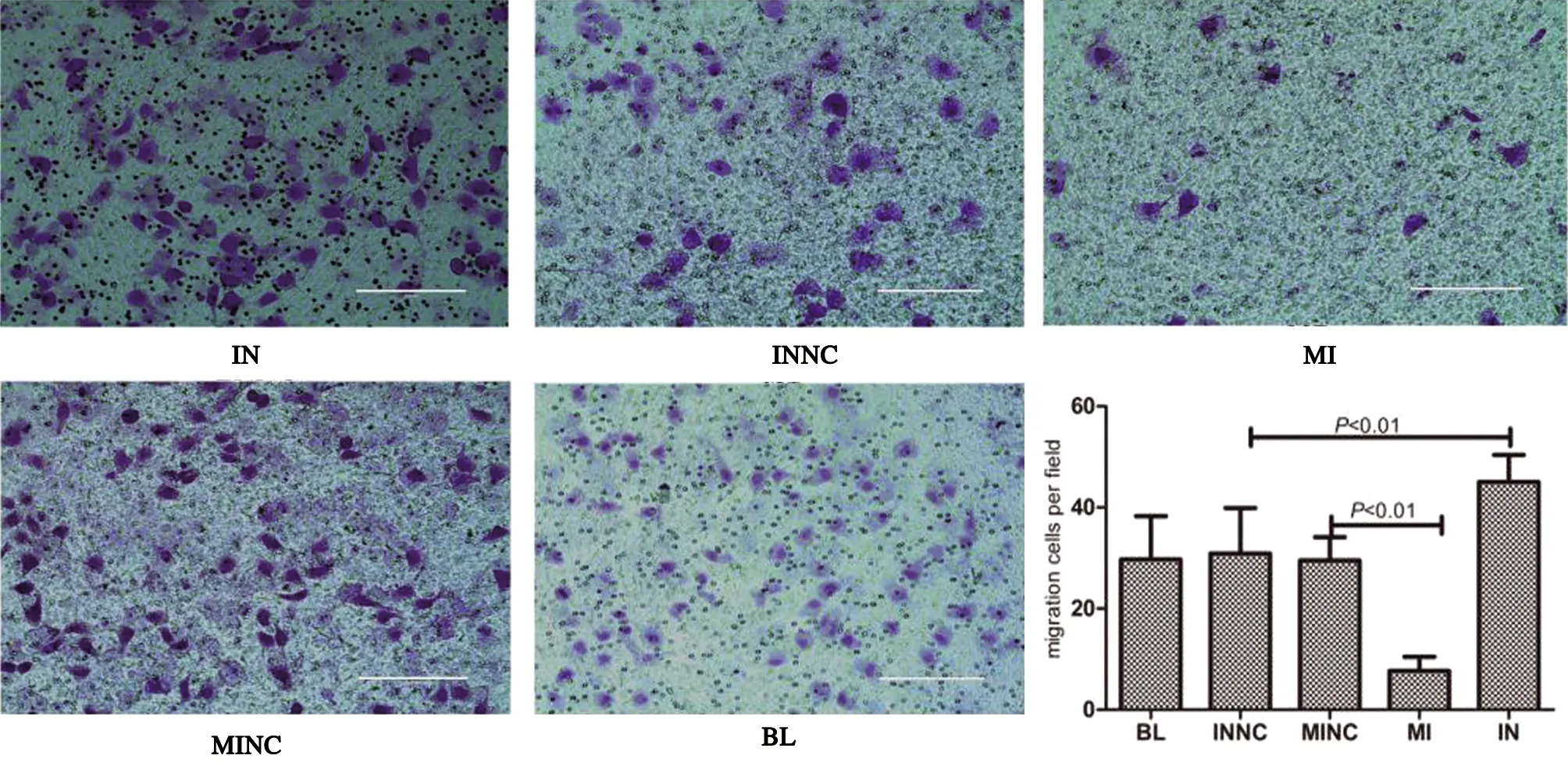
图3 Transwell迁移实验对比图及统计

表1 miR-4282表达量变化后愈合率变化
2.3 miR-4282表达量变化后侵袭能力变化
相较于对照组,miR-4282上调后穿透小室的细胞数目减少[(12±7)vs(24±2),F=2.602,P=0.000],而miR-4282下调后穿透到小室外的细胞数明显增多[(34±8)vs(20±3),F=14.553,P=0.000],空白组:(22±6),见图4。

图4 Transwell侵袭实验结果及统计
2.4 miR-4282互作基因预测
为了寻找与miR-4282相互作用的基因,我们通过TargetScan等多个生物信息学数据库分析对比对、做韦恩图、TCGA数据库中癌症下调基因相同比对等方法分析筛选后,结果显示,miR-4282可能与VEGFR、PI3K、GRB2等基因相互作用,通过查询KEGG PATHWAY网站中的通路图功能相适应,我们选择了GRB2这个基因作为验证与miR-4282的互作基因。
为了探究GRB2可以与哪些基因或蛋白相互作用,我们通过文献查找和应用STRING网站及KEGG PATHWAY网站进行综合分析,结果显示GRB2可通过激活ERBB信号转导通路影响细胞的侵袭、迁移功能,并影响Ras蛋白的表达。根据目前生物信息学分析结果,我们确定下一步以GRB2基因为研究方向,探究miR-4282如何影响肝癌细胞系SMMC-7721的生物学功能。
2.5 miR-4282表达量变化对GRB2 基因的影响
通过双荧光素酶检测证明GRB2-WT+NC和GRB2-WT+MiR-4282组表达量有差异(P<0.05),miR-4282可影响GRB2基因表达,见图5A。通过qRT-PCR实验验证,我们发现,当miR-4282上调时GRB2基因表达量下调[(0.499±0.150)vs(1.397±0.632),t=4.719,P=0.009],miR-4282下调时GRB2基因表达量上调[(1.726±0.198)vs(0.965±0.129),t=5.179,P=0.035],见图5B。
2.6 miR-4282转染后Ras蛋白表达量的变化
通过对ERBB通路的进一步了解及蛋白互作网络的分析,我们在通路中选择了关键的Ras蛋白来验证,探究上调及下调miR-4282是否对Ras蛋白的表达量产生影响。结果显示,miR-4282上调后Ras蛋白表达量下降[(0.639±0.075)vs(1.164±0.193),t=3.583,P=0.023];反之蛋白表达量升高[(1.503±0.187)vs(0.994±0.918),t=3.45,P=0.026],见图5C、5D。

A:双荧光素酶报告;B:miR-4282表达量变化后GRB2基因的变化;C、D:Western Blot实验显示miR-4282表达量变化后Ras蛋白的变化
3 讨 论
全世界每年肝癌新发例数超过100万。而且肝癌患者普遍存在发现晚、预后差,生存期短等特点。因此,寻找一种高特异性及敏感度的生物标志物是肝癌基础研究的一个方向。miRNA是非编码RNA中的一种,目前许多研究都发现miRNA在癌细胞中异常表达,并影响癌细胞功能的变化[9-10],这也促使miRNA的研究变成肿瘤研究的热点。
目前已有文献报道发现,miR-4282与结肠癌、乳腺癌、口腔鳞癌相关,其在3种肿瘤细胞系中均存在低表达,且miR-4282低表达可促进3种肿瘤细胞的增殖,并且促进乳腺癌和结肠癌细胞的迁移和侵袭[6-8]197-205,8763-8771,8035-8047。这说明miR-4282在这3种结肠、乳腺及口腔细胞中起抑癌基因作用,肿瘤使miR-4282在细胞中的表达量降低,并促进肿瘤的生长,并且可加速乳腺癌及结肠癌的转移。根据以上文献可以推测,miR-4282的低表达预示着结肠癌及乳腺癌预后不良。相关文献的研究结果与我们的相似,通过前期实验我们发现,和正常肝细胞相比,miR-4282在肝癌细胞中也处于低表达状态[11]。
根据体外功能实验结果,我们得知上调miR-4282可降低SMMC-7721细胞的侵袭、迁移能力,下调可促进侵袭、迁移能力。综合前期实验结果,我们推断miR-4282与其他文献对其报道的相同,在肝细胞中同样作为抑癌基因表达并发挥作用。根据生物信息学分析并验证后,我们发现miR-4282可以影响生长因子受体结合蛋白2(growth factor receptor-bound protein 2,GRB2)的表达。GRB2能够同时与Shc、Sos结合形成Shc-GRB2-Sos复合物,并将Sos激活,激活的Sos与质膜上的Ras蛋白结合,并将其激活,引起信号级联反应。目前已有研究显示,miR-98-5p可通过GRB2抑制乳腺癌细胞的增殖、迁移、侵袭[12];Qizhong Shi等研究显示MiR-433-3p过表达通过抑制GRB2基因表达来抑制食管鳞状细胞癌细胞的增殖,迁移和侵袭[13];Xinjing Wang等研究发现,miR-329通过GRB2/pERK影响胰腺癌细胞的增殖和凋亡能力[14]。以上文献说明GRB2基因作为肿瘤增殖、侵袭等功能变化的一个重要基因与多种肿瘤相关miRNA的表达相关,这些miRNA的异常表达后通过影响GRB2基因表达从而影响肿瘤的功能变化。进一步实验显示,miR-4282也可影响Ras蛋白的表达。通过通路图及蛋白互作网络,我们发现GRB2位于ERBB信号转导通路中,并且GRB2能够激活Ras蛋白。GRB2基因通过Ras蛋白是一种小G蛋白,Zhou B等发现,突变激活状态的Ras蛋白是近30%的人类癌症的关键致癌驱动因子,而且Ras蛋白与突变体Ras具有同种型时,野生型Ras蛋白可能充当肿瘤抑制因子,但当Ras蛋白与突变体Ras具有不同种型时,野生型Ras蛋白起着促进肿瘤作用[15]。有研究证实,miR-411-5p下调后通过miR-411-5p-GRB2-Ras途径促进乳腺癌细胞增殖,迁移和侵袭[16];Wei-Jiang等发现,miR-1258可通过GRB2/Ras/ERK途径抑制非小细胞肺癌细胞增殖[17]。我们发现,GRB2-Ras是多种肿瘤发展的一个重要途径。且调控GRB2表达的上游miRNA和受其调控的下游蛋白均有很多种,但该途径的主要作用是调控肿瘤细胞的迁移、侵袭能力,GRB2和Ras均位于ERBB通路中,该通路是调控肿瘤侵袭迁移的重要通路。因此我们可以推断,激活后异常表达的GRB2可能导致多种肿瘤发生侵袭迁移能力的变化,而miR-4282-GRB2-Ras途径作为影响肝癌侵袭迁移的发现可为临床治疗提供一个新的靶点,即通过阻断miR-4282的表达影响肝癌细胞的侵袭、迁移,而检测miR-4282也可成为判断肝癌预后的一个新的分子标志物。
综上所述,本研究认为miR-4282通过miR-4282-GRB2-Ras途径影响肝癌细胞的侵袭、迁移能力。希望能为临床上提供了一个新的分子标志物,为肝癌的诊断、预后判断提供新的参考依据。

