RBM5-AS1在甲状腺癌细胞中表达变化及其对细胞增殖、凋亡、侵袭、迁移能力的影响
梁宝珍,卢顺,张利华,陈雪君
1南方医科大学附属东莞石龙人民医院(东莞市第三人民医院)甲状腺外科,广东东莞523320;2南方医科大学南方医院普通外科
甲状腺癌(TC)是常见的内分泌恶性肿瘤,虽然预后较好,但由于远处转移、遗传和环境因素影响,大约10%的病例可能会分化成更具侵袭性的肿瘤[1-2]。TC发病过程涉及多种癌基因的激活、抑癌基因失活及信号通路的异常改变等过程,因此研究TC发病的分子机制对寻找治疗靶点和指导治疗具有重要意义[3-4]。近年研究证实,长链非编码RNA(lncRNA)具备调控肿瘤细胞分化、代谢等功能,通过调节基因表达进而参与多种恶性生物学过程[5-7]。结合基序蛋白5反义RNA1(RBM5-AS1)基因定位于人染色体3p21.31,与肿瘤细胞增殖、凋亡、侵袭和迁移密切相关,在骨肉瘤、口腔鳞癌等多种恶性肿瘤组织中高表达,与预后密切相关[8-9]。但目前关于RBM5-AS1与TC关系的报道较少。2019年6月—2021年1月,本研究观察了RBM5-AS1在TC细胞中的表达变化,及其对细胞增殖、凋亡、侵袭、迁移能力的影响,并探讨可能机制。现报告如下。
1 材料与方法
1.1 细胞与主要实验材料 人甲状腺细胞Nthy-ori 3-1和人TC细胞系C643、B-CPAP、TPC-1、BHT101、KMH-2、8305C购中国科学院细胞库。胎牛血清(FBS)、RPMI-1640培养基购自美国Gibco公司。总RNA提取试剂盒、Lipofectamine2000购自美国Invitrogen公司。逆转录及qRT-PCR试剂盒购自日本TaKaRa公司。PCR引物购自上海生工公司。CCK-8试剂盒购自日本Dojindo公司。Annexin V-FITC/PI双染凋亡试剂盒购自美国BD公司。Transwell小室购自美国Corning公司。蛋白裂解液和蛋白浓度检测试剂盒购自上海碧云天生物有限公司。RBM5-AS1 siRNA、NC siRNA购自上海吉玛公司。雷帕霉素靶蛋白(mTOR)、磷酸化(p)-mTOR、p70核糖体蛋白S6激酶(p70S6K)、真核翻译起始因子4E结合蛋白1(4E-BP1)和GAPDH一抗及辣根过氧化物酶标记的IgG二抗购自英国Abcam公司。合成。
1.2 TC细胞与甲状腺细胞中RBM5-AS1表达检测 采用qRT-PCR法检测Nthy-ori 3-1细胞和C643、B-CPAP、TPC-1、BHT101、KMH-2、8305C细胞中的RBM5-AS1。取对数生长期的细胞,PBS洗3次,加入TRIzol试剂,完全裂解细胞,并依次加入氯仿、异丙醇和无水乙醇离心后获取细胞中总RNA,检测RNA的浓度和质量,用于后续实验。使用逆转录试剂盒说明书将RNA逆转录为cDNA,并继续进行扩增。以cDNA为模板,按SYBR Green Ⅰ说明进行PCR扩增。以GAPDH作内参。RBM5-AS1上游引物序列为5′-TGGGAATGGGGAAGAGAAC-3′,下游引物序列为5′-TCTGTTCCTGGGTCTGTGTGC-3′。GAPDH上游引物序列为5′-AACGGATTTGGTCGTATTG-3′,下游引物序列为5′-GGAAGATGGTGATGGGATT-3′。反应条件:95 ℃预温6 min,95 ℃ 20 s,60 ℃ 25 s,75 ℃ 30 s,共40个循环。以2-ΔΔCt计算RBM5-AS1相对表达量。选择RBM5-AS1表达水平最高的细胞进行后续实验。
1.3 TC细胞分组与转染 TC细胞接种于含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2、饱和湿度培养箱中培养,在显微镜下观察细胞形态。当细胞融合度为95%时进行传代,并取二代细胞进行实验。取对数生长期的TC细胞铺6孔板,待细胞融合度为70%~80%时进行转染。将细胞分为对照组和实验组,为别转染NC siRNA和RBM5-AS1 siRNA。qRT-PCR检测结果显示,实验组细胞中RBM5-AS1相对表达量(1.25±0.12)明显低于对照组(3.49±0.17),差异有统计学意义(P<0.05),提示RBM5-AS1 siRNA可以明显抑制TC细胞中RBM5-AS1的表达。
1.4 两组细胞增殖能力检测 采用CCK-8法。转染后细胞消化、重悬,调整细胞密度为1×104/mL,96孔板铺入各组细胞,每孔100 μL,每组设4个复孔。将96孔板放入培养箱中培养,培养条件为37 ℃、5% CO2、饱和湿度。分别于培养0、24、36、48、60、72 h后向各孔加入10 μL的CCK-8稀释液,采用流式细胞术检测。1 h后用酶标仪测定450 nm波长下的吸光度值表示细胞增殖能力。
1.5 两组细胞凋亡率测算 采用annexinV/PI双染色法。转染后细胞消化、重悬,调整细胞密度为1×105/mL,加入70%乙醇重悬。置于4 ℃固定24 h;离心弃上清,PBS洗2遍,加入AnnexinV-FITC、PI各5 μL混匀进行染色,轻轻混匀,室温下反应15 min。流式细胞仪检测并计算细胞凋亡率。
1.6 两组细胞侵袭、迁移能力检测 细胞侵袭能力检测采用Transwell小室实验。将基质胶覆盖于Transwell上室。取转染后细胞用无血清的培养基制成密度为2.5×104/mL的细胞悬液。取细胞悬液500 μL加入Transwell小室上室,下层加入含10%胎牛血清的RPMI-1640培养基500 μL。于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养24 h。取出Transwell小室,保留下层细胞,用棉签清理未穿膜细胞,经多聚甲醇固定和结晶紫染色,15 min后将其置于显微镜下进行细胞计数。在上述基础上,移入涂有明胶的Transwell小室上室,计数侵袭细胞数。细胞迁移能力检测使用带有8 μm孔径插入物的Transwell小室进行。在200 μL无血清培养基中将2×104个细胞接种到上室中,并将600 μL完全培养基添加到下室。48 h后,将细胞用4%多聚甲醛固定并用结晶紫染色。显微镜下计数迁移细胞数。
1.7 两组细胞中mTOR、p-mTOR、p70S6K、4E-BP1蛋白检测 采用Western boltting法。取两组转染细胞,加入蛋白裂解液RIPA混匀后冰上震荡裂解30 min。离心取上清后进行蛋白定量,经BCA法蛋白定量合格。然后加入等体积的上样缓冲液,煮沸变性。取变性蛋白30 μg,SDS-PAGE(5%浓缩胶、10%分离胶)分离蛋白。采用湿转法将蛋白电泳产物转印至聚偏二氟乙烯膜(PVDF)上,然后用5%脱脂奶粉封闭1 h,分别加入mTOR、p-mTOR、p70S6K、4E-BP1和GAPDH一抗(稀释比均为1∶1 500),4 ℃孵育过夜。TBST冲洗膜,加入辣根过氧化物酶标记的IgG二抗(稀释比均为1∶4 500),室温孵育1 h。TBST洗3次后,采用ECL超敏化学发光法曝光条带,Image J软件分析蛋白灰度值。
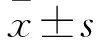
2 结果
2.1 TC细胞与甲状腺细胞中RBM5-AS1表达比较 C643、B-CPAP、TPC-1、BHT101、KMH-2、8305C细胞中RBM5-AS1相对表达量分别为1.25±0.31、1.14±0.29、2.46±0.12、2.03±0.05、1.15±0.32、3.61±0.12,均高于Nthy-ori 3-1细胞的0.28±0.05,P均<0.05。以8305C细胞中RBM5-AS1表达量最高,故选择8305C细胞进行后续实验。
2.2 两组TC细胞增殖能力比较 见表1。
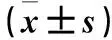
表1 两组细胞不同时间点增殖能力比较
2.3 两组TC细胞凋亡率比较 实验组、对照组细胞凋亡率分别为15.74%±3.87%、34.21%±4.08%,实验组细胞凋亡率低于对照组(P<0.05)。
2.4 两组TC细胞侵袭、迁移能力比较 实验组侵袭和迁移实验穿膜细胞数分别为(94.53±2.75)、(54.80±3.25)个,对照组分别为(152.00±3.18)、(87.20±2.51)个,实验组侵袭和迁移细胞数少于对照组(P均<0.05)。
2.5 两组TC细胞中mTOR、p-mTOR、p70S6K、4E-BP1蛋白表达比较 见表2。
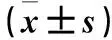
表2 两组TC细胞中mTOR、p-mTOR、p70S6K、4E-BP1蛋白表达比较
3 讨论
TC是最常见的甲状腺恶性肿瘤,约占全身恶性肿瘤的1%,包括乳头状癌、滤泡状癌、未分化癌和髓样癌四种病理类型。绝大部分TC起源于滤泡上皮细胞。电离辐射、碘、激素、其他甲状腺疾病、遗传和表观遗传学等危险因素都可能与TC的发生相关,但TC的病因及发病机制尚不清楚[10]。近年来,有研究证实,lncRNA在TC发展进程中发挥基因调控作用,参与TC的恶性进展[11]。研究表明,离子转运体26A家族反义RNA1(SLC26A4-AS1)在TC组织和细胞中呈低表达,上调SLC26A4-AS1表达可能通过激活DDX5来抑制TC细胞的增殖和转移[12]。lncRNA微小染色体维持蛋白3相关蛋白-反义链1可能通过竞争性抑制miR-211-5p从而促进TC的转移[13]。因此,lncRNA望成为TC诊断和治疗的靶点,发掘调控TC的重要lncRNA,并且进一步探讨相关分子机制,对于研发有效治疗干预措施、改善患者预后十分重要。
RBM5-AS1是新近发现的参与肿瘤发生发展多个过程有关的lncRNA,主要表达于细胞核,长度为1.2 kb,位于3号染色体[14]。LI等[8]研究证明,RBM5-AS1在口腔鳞状细胞癌(OSCC)中表达显著升高,过表达RBM5-AS促进OSCC细胞的增殖。SERENA等[15]研究表明,RBM5-AS1过表达能够通过调控WNT信号通路,导致结肠癌干细胞的激活增加。DENG等[9]研究报道,RBM5-AS1高表达于骨肉瘤细胞和组织,在体内及体外过表达RBM5-AS1,可促进肿瘤细胞的迁移和侵袭。目前关于RBM5-AS1在TC中的作用尚不清楚。本研究首先检测明确RBM5-AS1在TC细胞中的表达均高于正常甲状腺细胞。选择RBM5-AS1表达相对较高的8305C细胞转染RBM5-AS1 siRNA,实验结果发现,抑制RBM5-AS1表达后,TC细胞的增殖、迁移、侵袭能力均明显降低,凋亡率升高,这表明RBM5-AS1参与促进TC的恶性进展。
mTOR磷酸化后参与肿瘤细胞的生长、存活、代谢和细胞免疫等过程[16]。p70S6K是该信号通路下游的重要蛋白,主要是通过增强mRNA翻译来促进肿瘤细胞生长。LI等[17]究证明,激活的p70S6K可促进非小细胞肺癌的上皮细胞—间充质转化并增强肿瘤细胞对厄洛替尼的耐药。4EBP1是mTOR的另一下游底物,是一种翻译关键调节因子。SEI等[18]研究表明,4EBP1在发生转移的肾癌患者肿瘤组织中表达量更高,是临床预后不良的独立危险因素。mTOR/p70S6K/4EBP1信号通路参与恶性肿瘤的周期进展、分化、凋亡、自噬、运动和代谢等过程[19-20]。本研究结果显示,相比对照组,实验组细胞中p-mTOR、p70S6K、4E-BP1蛋白表达下降,提示mTOR/p70S6K/4E-BP1信号通路的激活受到抑制,可能以mTOR为调控中枢,激活下游靶蛋白p70S6K、4E-BP1,促进TC细胞恶性生物学行为。
综上所述,TC细胞中RBM5-AS1表达上调;干扰RBM5-AS1表达可抑制TC细胞的增殖、迁移、侵袭能力,促进其凋亡,其机制可能与调控mTOR/p70S6K/4EBP1信号通路有关。RBM5-AS1有望成为抗TC治疗的新靶点。后续实验将以多个TC细胞系为研究对象,分析RBM5-AS1作为癌基因的具体机制,同时还需进行体内试验与临床研究进一步验证以上结论。

