山萘酚对雨蛙素诱导小鼠急性胰腺炎的干预作用及机制
陈艳,赵月,何楝楝,王僚阳,王晓川
中国科学院大学深圳医院药学部,广东深圳518107
急性胰腺炎(AP)是一种常见的腹部炎症性疾病,常由胆管疾病、过量饮酒、药物、胆管和胰管的侵入性手术引起,导致胰酶异常激活消化胰腺自身组织,吸引免疫细胞浸润到损伤部位,释放大量的细胞因子,如白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)等,从而造成局部胰腺组织和相关脏器损伤,激活核转录因子κB(NF-κB)信号通路释放炎症因子进一步加重炎症反应,严重时可发生全身炎症反应综合征,甚至导致多器官功能衰竭[1-3]。目前临床治疗AP主要采用液体复苏、营养支持和镇痛等对症支持疗法,但效果不理想。山萘酚是一种天然黄酮,广泛存在于茶、西兰花、苹果、草莓和豆类中,具有抗炎、抗感染、抗氧化、抗癌、心脏保护、神经保护和抗糖尿病等特性[4-5]。但对AP的治疗作用还不明确。2020年8月—2021年3月,本研究观察了山萘酚对雨蛙素诱导小鼠AP的干预作用,并探讨山萘酚相关机制,为AP临床治疗提供新的方法。
1 材料与方法
1.1 实验动物与主要材料 24只C57BL/6雄性小鼠购自北京维通利华公司,鼠龄8~10周,体质量20~22 g。雨蛙素购自美国Sigma公司。BCA蛋白浓度测定试剂盒购自北京索莱宝公司。GAPDH抗体购自上海碧云天公司。NF-κB抗体购自美国CST公司。血清淀粉酶购自上海酶联生物科技有限公司。TNF-α、IL-1β检测试剂盒购自美国Proteintech公司。
1.2 模型制作及给药方法 小鼠适应性饲养1周,随机分为对照组、模型组、实验组,每组8只。模型组和实验组制作AP模型,腹腔注射雨蛙素(50 μg/kg,溶于PBS)8次,每次间隔1 h;实验组在雨蛙素注射前1 h腹腔注射山萘酚(20 mg/kg,溶于DMSO)。对照组不制作模型,注射等量PBS,造模12 h后处死小鼠。
1.3 胰腺病理组织观察 取胰腺组织,4%多聚甲醛固定,石蜡包埋,切成4 μm厚切片,用HE染色,光学显微镜下观察胰腺形态并对胰腺组织进行病理损伤评分[6]。
1.4 血清淀粉酶及炎症因子检测 采用ELISA法检测血清淀粉酶及TNF-α、IL-1β,按试剂盒说明书操作。
1.5 胰腺组织中TNF-α、IL-1β、NF-κB蛋白检测 采用免疫组化法检测胰腺组织中的TNF-α、IL-1β。石蜡切片经二甲苯脱蜡、乙醇梯度水化(100%、95%、85%、75%的乙醇),H2O2孵育阻断内源过氧化物酶活性;抗原修复,封闭,一抗孵育并4 ℃过夜,加二抗孵育;3,5-二氨基联苯胺显色,显微镜下观察显色反应;苏木精复染10 min,乙醇梯度脱水(75%、85%、95%、100%的乙醇),二甲苯浸泡,封片,光学显微镜下观察,并用Image J软件进行定量分析平均光密度。采用Western blotting法检测胰腺组织中的NF-κB蛋白。小鼠胰腺组织剪碎提取蛋白,BCA法测定蛋白浓度;每孔加入20 μg蛋白,电泳(80 V电泳30 h,150 V电泳50 min)、300 mA恒流湿转1 h、封闭1 h凝胶电泳;加一抗孵育4 ℃过夜(1∶1 000),洗膜3次,二抗室温孵育1 h,洗膜3次,化学发光法显影。以GADPH为内参,采用Image J软件进行分析,以目的蛋白条带与内参条带灰度值比值表示目的蛋白相对表达量。

2 结果
2.1 各组小鼠胰腺组织病理变化 模型组小鼠胰腺组织水肿、炎细胞浸润和细胞坏死,实验组小鼠胰腺损伤程度明显减轻。模型组胰腺组织水肿、炎细胞浸润、腺泡细胞坏死评分低于对照组,实验组胰腺组织水肿、炎细胞浸润、腺泡细胞坏死组织学评分低于模型组(P均<0.01)。见表1、图1。

表1 各组小鼠胰腺组织病理评分比较(分,

图1 各组小鼠胰腺组织病理变化(HE染色,100×)
2.2 各组小鼠血清淀粉酶、TNF-α、IL-1β水平比较 模型组血清淀粉酶、TNF-α、IL-1β水平高于对照组,实验组血清淀粉酶、TNF-α、IL-1β水平低于模型组(P均<0.01)。见表2。
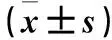
表2 各组小鼠血清淀粉酶、TNF-α、IL-1β水平比较
2.3 各组小鼠胰腺组织中TNF-α、IL-1β、NF-κB蛋白表达比较 模型组胰腺组织中TNF-α、IL-1β、NF-κB蛋白表达高于对照组,实验组TNF-α、IL-1β、NF-κB蛋白表达低于模型组(P均<0.05)。见表3、图2。
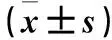
表3 各组小鼠胰腺组织中TNF-α、IL-1β、NF-κB蛋白表达比较

图2 各组小鼠胰腺组织中TNF-α、IL-1β、NF-κB蛋白表达情况(免疫组化法)
3 讨论
AP是胰腺的一种急性炎症性疾病,除了胰腺局部病变外,还常伴有明显的全身炎症反应,甚至伴有多器官损伤[7-8]。目前临床上AP的治疗多为液体复苏和对症支持治疗,尚无特异性药物[8-9]。越来越多的证据表明,炎症反应是疾病进展的主导因素[10-11],因此,探讨AP早期炎症机制,寻找一种针对炎症过程的潜在治疗方法具有重要的临床意义。
山萘酚是一种天然黄酮具有抗炎、抗感染、抗氧化、抗肿瘤、心脏保护、神经保护和抗糖尿病等特性[4-5]。然而,山萘酚在AP中的药理作用尚不清楚。雨蛙素是一种缩胆囊素类似物,本研究用雨蛙素诱导AP小鼠模型,该模型稳定且已被广泛应用于实验性AP的研究[12-13]。本研究结果显示,山萘酚能明显减轻雨蛙素诱导的小鼠AP,明显减轻AP引起的胰腺组织病理损伤,小鼠胰腺组织病理学评分(坏死、空泡化、炎细胞浸润)及血清淀粉酶水平明显降低,血清炎症因子TNF-α、IL-1β水平降低,并下调胰腺组织中NF-κB的表达,提示山萘酚可能通过抑制NF-κB信号通路的激活来抑制胰腺炎症反应。
炎症是AP发展的一个主要过程,胰腺局部和全身器官损伤的严重程度取决于促炎细胞因子的表达水平。TNF-α、IL-1β等促炎因子在AP发生发展中起重要作用。研究表明,抑制炎症因子表达有利于减轻疾病严重程度[14-15]。当有害刺激作用于胰腺时,胰腺腺泡细胞内酶原的过早激活可引起腺泡细胞损伤,引起局部炎症反应;另一方面,胰腺腺泡细胞受损后,本身产生炎症因子、趋化因子等,吸引免疫细胞浸润到损伤部位,释放大量细胞因子,如TNF-α、IL-1β、IL-6等,从而造成局部胰腺组织和相关脏器损伤[16-17]。本研究结果与相关研究一致,模型组小鼠血清TNF-α、IL-1β水平高于对照组,而山萘酚可显著抑制血清及胰腺组织中TNF-α和IL-1β的表达,因此认为山萘酚可以减少炎症因子的产生,以减轻雨蛙素诱导的AP。
NF-κB通路是调节AP炎症介质转录和生物合成的重要信号通路,在AP的发展中发挥了关键作用。通常情况下,NF-κB在细胞质中与IκB结合处于非活动状态,当细胞受到炎症因子及其他有害物质等的刺激时,IκBs降解,NF-κB核易位信号暴露,NF-κB转录因子进入细胞核与其同源DNA序列结合并诱导靶基因转录,介导多种炎症介质表达[18]。多种AP实验模型表明,NF-κB激活与小鼠AP的严重程度有关[19-20],药物抑制NF-κB信号通路的激活可显著减轻AP[21]。本研究发现,模型组NF-κB通路被激活,而NF-κB在实验组中表达被显著抑制,因此,我们推测山萘酚减轻AP炎症反应可能是通过抑制NF-κB信号通路激活来实现的。
综上所述,本研究表明,KF可以通过减轻AP小鼠的炎症反应,抑制NF-κB炎症通路的激活改善AP预后,而其在AP中的特异性作用靶点有待进一步研究。

