前床突脑膜瘤显微外科手术策略与疗效分析
王慧博,陆嘉诚,陈正新,李海林,骆慧,汤其凯,汪张杰,吴伟,尤永平,刘宁
前床突脑膜瘤(anterior clinoidal meningiomas,ACMs)是指起源于前床突(anterior clinoid process,ACP)表面或者蝶骨小翼内侧的脑膜瘤[1],因其位置深在,并与颈内动脉(internal carotid artery,ICA)及其分支、视路、海绵窦、垂体柄、下丘脑等结构关系密切,手术全切难度大,术后并发症多、肿瘤复发率高,一直是神经外科领域治疗上的难点。本研究回顾性分析南京医科大学第一附属医院神经外科2013年6月—2018年6月行显微手术治疗的43例ACMs患者的临床资料,总结手术方法及术中注意要点,分析临床疗效。
1 资料与方法
1.1 一般资料 共纳入43例ACMs患者,其中男19例,女24例;年龄32~70岁,平均年龄(51±9)岁。病程5个月~12年,平均(6±2)年。术前症状表现为头痛、恶心、呕吐等颅高压症状者为27例(62.8%),癫痫或精神症状5例(11.6%),嗅觉受损2例(4.7%),视觉功能障碍19例(单侧视力下降或视野缺损15例(34.9%),双侧视力下降或视野缺损4例(9.3%),动眼神经麻痹6例(14.0%),外展神经麻痹3例(7.0%),对侧肢体运动障碍4例(9.3%)。
1.2 神经影像学检查 所有患者均在术前行头颅MRI平扫+增强,据此测得各肿瘤最大径1.5~9.0 cm,平均(3.9±1.7)cm;通过MRI T2WI评估肿瘤的质地;同时,肿瘤与海绵窦关系也由术前MRI获得。25例行颅底高分辨CT平扫检查以评估肿瘤与颅底骨质关系。12例行CTA,18例行DSA。3D-Slicer软件被用于部分病例的术前影像学重建(图1、图2)。根据Al-Mefty分型,Ⅰ型14例,Ⅱ型20例,Ⅲ型9例。

A:术后1 h头颅CT; B:轴位MRI; C:冠状位MRI图2 患者术后影像学检查
1.3 手术方法 所有患者均采用翼点或改良翼点入路,根据手术显露需要和肿瘤生长方向调整切口范围。全麻后患者采用仰卧位,头向对侧旋转角度,约为30°,使额骨颧突位于最高点。常规开颅后,沿蝶骨嵴由外向内分离并尽量磨除蝶骨嵴,直至显露ACP,视肿瘤基底附着情况决定是否磨除ACP。以蝶骨嵴残端为中心弧形剪开硬膜,依次开放侧裂池、颈动脉池和视交叉池。暴露肿瘤后,评估肿瘤与ICA及其分支关系,在距离ICA床突段和视神经安全范围内,尽量电凝肿瘤大部分基底,阻断血供,减少肿瘤。再采用顺行或逆行追踪法,逐步探查、分离肿瘤与颅底Willis环大血管及深穿支的粘连。Al-Mefty Ⅲ型ACMs向视神经管或眶上裂生长,充分磨除骨性视神经管减压视神经,注意保护垂体上动脉和供应视路结构穿支血管,以及尽量减少电凝止血产生的热传导损伤。
1.4 评价指标 所有患者术后2 h内复查CT,72 h内复查头颅MRI,评估肿瘤切除率。术后3个月复查头颅MRI评估肿瘤有无复发或进展。复发评估指标为Simpson Ⅰ或Ⅱ级切除患者在随访期间发现肿瘤再发,进展评估指标为Simpson Ⅲ或Ⅳ级切除患者在随访期间发现瘤体继续增大。KPS(Karnofsky Performance Status)评分被用来评估患者术后生活质量。
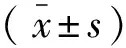
2 结 果
2.1 手术结果 术后Simpson Ⅰ-Ⅱ级切除35例(81.4%),Ⅲ级切除5例(11.6%),Ⅳ级切除3例(7.0%)。肿瘤直径不同,全切率不同:瘤径<2 cm的小肿瘤Ⅰ-Ⅱ级切除5/5例(100%);瘤径介于2~4 cm的中等肿瘤Ⅰ-Ⅱ级切除17/19例(89.5%);瘤径>4 cm的大肿瘤Ⅰ-Ⅱ级切除13/19例(68.4%)。通过对肿瘤大小、质地、与海绵窦关系、与ICA及其分支关系与肿瘤切除率行单因素及多因素分析后显示,肿瘤体积小、未侵及海绵窦、与ICA及其分支不粘连均可提升肿瘤切除率(表1)。术后病理结果示18例患者为内皮细胞型,9例为沙砾型,13例为成纤维型,1例混合型,2例间变型。

表1 肿瘤大小、质地、与海绵窦关系、与ICA及其分支关系对肿瘤切除率的关系(例)
2.2 并发症 近期并发症包括迟发性出血2例,偏瘫3例,精神症状4例,不同程度混合性失语1例,动眼神经麻痹3例,皮下积液3例,脑脊液鼻漏1例。脑脊液鼻漏患者经腰椎穿刺持续引流脑脊液2周后好转。出院时临床症状获得不同程度改善患者达32例。头痛头晕患者术后明显缓解率为23/27;视力视野损害患者术后明显恢复率为12/19。
2.3 随访 平均随访23.2个月。2例偏瘫患者经康复治疗后可自行行走,上肢精细活动较差。动眼神经麻痹患者均不同程度症状改善。头痛头晕患者术后明显缓解率为24/27,视力视野损害患者恢复率16/19。复发2例,进展2例。复发、进展病例发现后,于放疗科行伽玛刀治疗后3例取得较好疗效。据切除等级分为的两组患者的随访KPS评分如表2所示。可见在术后短期内,全切组患者的生活质量低于非全切组,然而经过康复等治疗后,两组患者生活质量无统计学差异,提示在安全前提下,对于肿瘤进行全部切除不会对患者神经功能产生影响而降低生活质量。

表2 切除率不同的两组患者不同随访时间KPS评分对比分)
3 讨 论
ACMs与鞍结节脑膜瘤、蝶骨嵴内侧型脑膜瘤起源位置毗邻,既往定义模糊;Romani等[2]将ACMs定义为起源于ACP硬膜,并向上方、下方、侧方和(或)侵入视神经孔的脑膜瘤。Al-Mefty根据肿瘤起源及与ICA之间是否存在蛛网膜间隙将ACMs分为三型,Ⅰ型是指从ICA远环上方与颈动脉池蛛网膜下界之间起源;Ⅱ型是指起源于ACP硬膜的上方和外侧;Ⅲ型是指起源于视神经管内[3]。该分型是目前神经外科学界广为接受的ACMs分型。Xu等研究发现ACP上、外、尖、内、下表面硬脑膜和骨膜的膜性解剖分布和延展方式各不相同,据此将ACMs分为四型,针对不同类型的ACMs,提出个体化的手术方案,并取得了满意的治疗效果[4]。
本研究提示肿瘤体积、是否侵及海绵窦、与ICA及其分支粘连是否紧密均是影响肿瘤切除率的独立因素。此外,在安全前提下的肿瘤全切不会影响患者长期的生存质量。然而,本研究也发现,对四种因素与肿瘤切除率的影响进行分析后,除了肿瘤质地外,其余三种因素均可影响肿瘤切除率。此结果与刘定阳等的研究结果不一[5]。产生这种不一结果的原因除了样本量差异之外,更重要在于现代神经外科器械不断发展,超声外科吸引系统等器械在临床的广泛应用,可极大提升术中操作的便捷性[6]。此外,在术后短期内,全切组患者的生活质量低于非全切组,本研究认为原因在于全切时对重要神经、血管的暴露要求更高,剥离后带来一过性神经功能损伤可能性也相对更高,更要求术者在术中合理运用多种技巧来提升ACMs的治疗效果。
ACMs治疗效果主要与下列因素相关:肿瘤的大小、质地、血供情况,肿瘤与颅底大血管及其分支的粘连程度,肿瘤是否侵犯海绵窦及与Ⅱ-Ⅵ颅神经的关系。本研究Simpson Ⅰ-Ⅱ级切除率达81.4%,不同瘤径ACMs手术切除率各不相同,总体疗效较好,现对手术治疗策略总结如下。
翼点及扩大翼点入路,是目前治疗ACMs的首选入路[3],具有如下优点:(1)可根据肿瘤的生长方向、大小,调整骨窗范围,操作距离更接近病变部位;(2)广泛分离外侧裂池,增大手术空间,充分暴露重要血管、神经,减少对瘤周脑组织的牵拉;(3)有效磨除蝶骨嵴,降低肿瘤复发率;(4)可有效暴露肿瘤基底部,从而阻断肿瘤血供,减少出血。然而,对于大型ACMs,可行眶颧入路,增加肿瘤暴露范围,如肿瘤向鞍内延伸,必要时可磨除鞍结节,如与ICA包绕,需切开远环,如肿瘤侵入海绵窦,可切开海绵窦顶壁及外侧壁切除肿瘤[7]。然而,创伤较大、操作复杂、术后脑脊液漏发生率高则是眶颧入路的不足[3,8]。
不管何种入路,均需决定是否磨除ACP。磨除的指征:(1)肿瘤侵入视神经管;(2)ACP明显伴有骨质增生;(3)ICA包裹肿瘤,为了更好分离二者;(4)对于质硬肿瘤,无法通过单纯电凝切除肿瘤。磨除ACP的方法又分为硬膜外、硬膜下及硬膜外-硬膜下联合切除[4,9]。本研究认为,在硬膜外阶段磨除ACP可减少对硬膜下脑组织、神经、血管的损伤;而硬膜下磨除ACP则可早期探查到肿瘤基底、ICA、视神经等结构,利于操作。对于一些复杂的入路需要选择合适的方法,包括选择硬膜外-硬膜下联合方法,个性化磨除ACP,尽最大可能提升手术效率、降低术后脑脊液漏等并发症发生率。
除Al-Mefty Ⅰ型ACMs与ICA之间缺乏蛛网膜平面,另外两种亚型与ICA的分离并不十分困难。顺行法、逆行法应序贯使用来分离血管、切除肿瘤。顺行法指瘤内减压后在ACP内侧定位ICA床突上段,然后根据ICA走向顺行向MCA分离,逐步切除包裹在MCA和ACA上的肿瘤。而逆行法指在探查到MCA M2段由远及近逐步分离包裹M2、M1段的肿瘤,进而分离至ICA[10]。在肿瘤与血管之间的分离应尽可能行锐性分离,当缺乏蛛网膜-脑脊液界面时应注意小心操作,可保留薄层肿瘤组织。尤其注意对深穿支血管、后交通动脉、脉络膜前动脉等重要血管的保护。术中亦可使用罂粟碱明胶海绵湿敷分离处的动脉,防止出现血管痉挛。
ACMs与视路关系密切,可起源于视神经孔或沿视神经孔侵犯视神经管引起突眼、视力下降、视野缺损[11]。术中应充分磨除ACP、视神经管顶壁和眶外侧壁,沿视神经走向切开视神经鞘和镰状韧带,在探明肿瘤与眶内组织的关系后分块切除肿瘤,可有效对视神经减压,降低术后视力恶化程度[12]。Al-Mefty Ⅲ型的ACMs与视路结构之间一般没有蛛网膜层,分离困难,此外切除过程中垂体上动脉小分支血管的损伤以及电凝镊的热传导均会损伤视神经[13-14]。一味追求全切往往导致术后视力急剧下降,因此应在术前细致评估患者视力、视野的情况下,个性化行视神经减压[15]。
尽管Al-Metfy分型已是最经典的ACMs分类方法,但不能详尽地描述肿瘤与海绵窦的关系。Abdel-Az等[16]据肿瘤与海绵窦、ACP的关系将其分为三型:蝶骨嵴海绵窦型、前床突海绵窦型、蝶骨嵴前床突海绵窦型,后两种分型ACP的磨除十分必要。之所以强调ACMs与海绵窦之间的关系,是因为先前研究提示,ACMs对海绵窦的侵袭,是ACMs造成部分患者出现神经功能损伤、手术全切率较低、术后复发率较高的重要原因[17]。过于强调肿瘤全切可造成ICA、第Ⅲ、Ⅳ、Ⅵ对脑神经不可逆损伤,发生率高达26%~33%[18]。本组病例术后3例动眼神经麻痹的发生主要缘于切除侵袭入海绵窦的部分肿瘤。对于海绵窦本身受累的病例,本研究总结以下经验:(1)术前应行神经功能的细致评估,如术前同侧神经功能已有不可能逆损伤,则可追求全切,否则应重视神经功能的保护;(2)分离动眼神经三角、幕缘、海绵窦外侧壁附近的肿瘤组织时,动作应轻柔,尽量避免在这些区域使用电凝,防止机械性损伤或热传导损伤,出血时应首选可吸收止血明胶海绵及脑棉压迫止血;(3)对于海绵窦广泛侵袭且质地较韧、血供尤其丰富的肿瘤,在已行海绵窦外肿瘤全切除、视神经、动眼神经等充分减压时,可考虑终止手术;(4)海绵窦内不能切除的肿瘤,术后分次立体定向放疗或γ刀等辅助治疗[19],WHO Ⅱ级以上的肿瘤可考虑纳入临床试验行同步放化疗[20]。
此外,围术期仍有一些操作可以极大提升临床疗效:(1)术前即对瘤体巨大、占位效应显著或骨质广泛侵袭的ACMs患者行腰穿置管持续引流脑脊液,可有效降低颅内压、减轻术中牵拉、降低术后脑脊液漏发生率[21];(2)术中神经导航、电生理监测等神经外科多项辅助技术模块可综合应用于ACMs术中。
综上所述,随着神经外科技术的不断发展,神经影像、神经麻醉等支持手段的不断强化,ACMs的临床疗效取得长足进展。然而,患者对于预后期望日趋提高,督促着神经外科医生需着眼解决如何更微创、如何综合治疗复发难治性肿瘤等临床难题,从而最大程度让患者受益。

