机械臂辅助颅内病灶体表投影定位的临床应用
刘德峰,刘焕光,张华,胡文瀚,张凯,孟凡刚,杨岸超,张建国
精准医学是目前医学发展的指导理念,神经外科手术之前,位于脑实质的病变必须首先使用CT、MRI等影像技术进行定位,并明确颅内病灶的体表投影[1]。而对于神经外科而言,精准治疗能够最大程度地缓解患者的病情且兼顾手术疗效[2]。颅内病变的定位和体表投影有助于确定与病变位置相关的开颅部位,以及确定切口部位[1,3-4]。更重要的是,皮肤切口和骨窗的宽度和长度可以在开始手术前在皮肤表面进行调整和绘制[5]。而早在1986年,神经导航的概念就已经产生[6]。随后神经外科医生逐渐开始在开颅手术中应用各种医疗导向设备。在导航设备的帮助下,神经外科医生能够在有限的术野下安全且准确地到达颅内病变的位置,这也表明了导航设备极大地提高了神经外科手术的质量和效率。随后,各种各样的导航系统问世并商业化[7-8],其原理是基于使用点对点导航来指示位置。
近些年随着医疗技术的发展进步,越来越多的导航辅助设备进入临床应用,神经外科机械臂就是其中一种重要的辅助技术[9]。在功能神经外科中,机械臂辅助早已经应用于立体定向脑电图技术(stereotactic electroencephalograph,SEEG)、脑深部电刺激(deep brian stimulation,DBS)、活检等手术中[10]。与此同时,在临床实践中经常会遇到根据影像以及体表解剖标记设计的头皮手术切口与术中颅内病灶相偏离的现象。而神经外科机械臂可以根据术前CT和MRI等影像资料,自动计算病灶的三维形状,并在患者颅骨体表形成醒目投影,帮助手术医生定位并标记切口。本研究对首都医科大学附属北京天坛医院神经外科2018年8月—2020年8月收治的75例颅内占位性病变患者的临床资料进行回顾分析;其中15例患者使用机械臂辅助术前定位,将颅内病灶进行体表投影定位,60例患者以常规方法术前定位。现报告如下。
1 资料与方法
1.1 一般资料 本研究共纳入75例患者,其中应用机械臂辅助颅内病灶体表投影定位进行切除手术的患者(机械臂辅助组)15例,颅内占位病变常规开颅切除手术的患者(常规手术组)60例。(1)机械臂辅助组:男10例,女5例;年龄20~68岁,平均(44.2±17.1)岁;肿瘤均位于额、颞、顶部,病理类型为脑膜瘤者6例、胶质瘤9例,直径1.5~9.2 cm,平均5.5 cm。(2)常规手术组:男35例,女25例;年龄15~69岁,平均(42.3±19.1)岁;肿瘤均位于额、颞、顶部,病理类型为脑膜瘤者31例、胶质瘤29例,直径1.8~9.1 cm,平均5.7 cm。本研究患者均知情同意并签署了手术知情同意书。
1.2 方法
1.2.1 机械臂辅助颅内病灶体表投影定位 所有患者术前均行MRI检查(3.0 T西门子磁共振机,德国),扫描序列包括T1WI(层厚为1 mm)矢状位和增强、T2WI(层厚为2 mm)轴位和冠状位、T1-液体衰减反转恢复序列(FLAIR,层厚为1 mm)矢状位和轴位。必要时加做PET-CT及血管成像检查。手术当天,注册标记点粘贴在患者头部,然后行头颅CT扫描(层厚为0.625 mm,层间距为0),图像数据传输至机械臂工作站后进行图像融合,将病灶、皮层及血管等进行三维重建,设计手术路径。使用病灶投射功能将病灶的边缘形状投射至颅骨三维重建模型表面,可在软件中设计骨窗大小,根据模拟去除骨瓣效果适当调整(图1)。患者全麻后,头架固定头部,完成机械臂注册,机械臂末端连接激光导向装置,自动描画规划骨瓣范围(图2);切开头皮后可再次行骨瓣描画,力求精准。术后复查头颅CT(层厚为0.625 mm,层间距为0)。
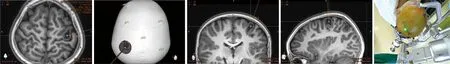
图1 机械臂辅助颅内占位病变切除手术计划 图2 术中病灶投影并设计手术切口
1.2.2 常规颅内病灶体表定位 术前由主刀医生根据患者CT、MRI等影像资料,以及体表解剖标记进行头皮手术切口设计。设计原则包括切口包含占位,距离占位病变最近,尽可能利用自然解剖间隙,尽可能减少对神经、血管和脑组织的损伤。
1.3 手术评价指标 统计两种术前占位体表定位方式的骨窗面积、手术耗时及占位病变手术全切率。骨窗面积计算方法:(1)骨窗最大直径(d),为CT平扫层面上所测量最大的骨窗直径;(2)骨窗高度(h),骨窗最大直径同一CT层面上所测量头皮至该直径线的垂直距离;(3)骨窗面积(A),计算公式为A=π×[(d/2)2+h2]。手术耗时定义:术中切开头皮至缝合头皮的时间。占位病变全切率:手术切除程度由一位神经影像学专家及一位神经外科医生根据手术前后MRI上异常信号范围对比变化确定;达到影像学上病变全切除的患者定义为手术全切除。
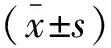
2 结 果
机械臂辅助组患者的术中骨窗面积为(83.33±15.72)cm2,常规手术组患者的骨窗面积为(113.72±11.93)cm2;机械臂辅助组患者的骨窗面积明显小于常规手术组,差异有统计学意义(P<0.01)。两组患者的手术耗时及肿瘤手术全切率间的差异均无统计学意义(均P>0.05)(表1)。
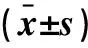
表1 两组患者的临床资料及手术指标比较
3 讨 论
颅内病灶的精准定位是任何神经外科手术的基本要求[11],而术前在患者体表使用记号笔标记手术切口更是每个外科医生的必备技能。术前神经外科医生对病变的位置有一个大致印象并规划暴露病变的路线。在缺乏神经导航系统的情况下,病灶与放射图像上已知解剖结构或标志的距离可以测量并用于定位目标。
既往这项工作基本是基于术前影像以及体表解剖标记进行头皮手术切口设计,但往往会出现术前设计切口与术中实际病灶位置相偏离的现象。而如果出现这种现象,术中可能需要进一步扩大术窗,增加了正常脑组织损伤的风险。较小或者位于深部脑组织的病变,对于术前入路准确定位的要求则更高。
随着头皮切口和开颅骨瓣尺寸最小化趋势,对更准确的定位的需求在神经外科手术中不断增加。国内学者郭宇等[12]利用智能手机软件,识别患者术前影像,镜像翻转后使图像重叠至患者头部从而定位病变位置。但是该软件虽然使用较为方便,但是操作上存在一定难度,定位上需要拍摄患者正侧位照片并与影像完全一致才能准确定位,存在定位误差、耗时较长、手机无法兼容等问题。神经导航同样是作为准确定位颅内占位的辅助设备。Gökyar等[13]应用笛卡尔坐标系统和MRI制作体表立体定位无框架病灶定位模型,其结果虽然具有可用性和可靠性,但更多地适用于浅表占位病变,对于脑深部占位病变的体表定位尚需进一步研究。苏国辉等[14]使用神经导航辅助切除功能区胶质瘤,结果显示神经导航具有定位准确、可个体化选择切口和手术入路、全切率高等优点。但神经导航定位耗时较长,操作技术要求相对更高,且设备价格昂贵,尚不适合大规模推广使用。Meola等[15]的一篇关于虚拟现实结合神经导航技术的综述指出,该技术的使用还需要进行前瞻性研究,并且需要改进设置使得其更具用户兼容性;同时虚拟现实模型也需要改进以融合周围环境。此外,近些年新兴的技术之一三维增强虚拟现实[16]也存在一些不足。其虽然旨在临床干预过程中帮助医生进行空间推理,继而实现在患者身上的手术计划可视化;但由于会聚-调节冲突或其他硬件因素造成的三维虚拟现实设备限制与传统导航相比增加了约1.5 mm的误差,这也限制了该设备在临床环境中的使用。
随着医疗技术的持续发展进步,神经外科机械臂在立体定向领域得以广泛使用[17-19]。机械臂工作平台包括一个计算机软件系统、一个六轴机械臂和一个摄像头。外科医生可以通过计算机软件系统观察头部的多模态影像,规划最佳的手术路径;机械臂可以帮助外科医生准确定位手术部位,同时充当多功能手术操作平台;摄像头可以进行空间映射、实时跟踪,利用独特的标识物自动捕获机械和患者头部的空间位置,操作简单、轻便安全、精准高效,确保机械臂沿着规划的路径运动到术前规划的位置。当前国际上应用较为广泛的机械臂主要有法国的Neuromate、加拿大的Neuro Arm等[20-21]。当前国内使用神经外科机械臂的手术主要包括DBS电极植入、立体定向活检、立体定向血肿清除、置管引流术及损毁手术等。DBS是改善帕金森病相关运动症状的有效外科治疗方法,决定患者预后的关键因素之一就是手术中电极植入的准确定位。Moran等[22]对152例患者进行回顾性分析并探讨机械臂辅助电极植入治疗帕金森病的临床效果,其术后1年的临床随访显示机械臂辅助电极植入的DBS治疗帕金森病的疗效与传统治疗方法相当。这也从侧面证实了机械臂辅助定位的精确性和稳定性。Wang等[23]对17例高血压性脑出血患者的临床资料进行回顾性分析以验证医用神经外科机械臂治疗高血压性脑出血的微创手术方法和疗效,结果显示机械臂辅助立体定向技术能根据血肿形状进行手术规划,准确引导血肿穿刺。本研究所使用的国产Remebot机械臂系统由一个可360°自由旋转六轴机械臂、一台计算机和一台摄像机组成,可将CT和MRI等影像资料自动融合;然后根据术前CT和MRI等影像资料,通过图像灰度等级区分,实现像素级别的划分,可以将占位病变与脑组织分割出来;利用连通域面积、形状等特征进行区分,可以单独显示皮肤、骨骼、脑组织、血管等,即可以达到一个较高精度的颅内占位分割结果;该方法计算简单,效率高。随后自动计算三维病灶形状,并在患者颅骨体表形成醒目投影,激光帮助手术医生定位并标记切口,指导手术入路,避免不必要的术中探查,减少对脑组织的损伤。
本研究对15例颅内占位患者术前进行机械臂辅助体表定位,术前影像学检查显示占位病变均位于额、颞、顶部,主要位于大脑凸面及皮层。机械臂辅助手术组与常规手术组患者的手术指标分析显示,机械臂辅助手术组患者的术中骨窗面积为(83.33±15.72)cm2,常规手术组患者的骨窗面积为(113.72±11.93)cm2,两组患者骨窗面积的差异有统计性意义(P<0.01);而两组患者手术耗时及手术全切率间的差异均无统计学意义(均P>0.05)。
本研究机械臂辅助手术组患者术中在满足术野要求的情况下,未出现因定位偏差而继续扩大骨窗、术中大出血、颅内压升高、急性非术区硬脑膜外血肿等并发症。术后病理检查显示肿瘤病理性质均为WHO Ⅰ-Ⅱ级的脑膜瘤及胶质瘤。术后复查MRI显示占位病变均完全切除,手术全切率100%;未出现颅内出血、感染、癫痫发作等术后并发症。术后半年及1年随访,15例患者均无神经功能障碍,复查MRI均未见肿瘤复发。
机械臂的使用,其主要的优点在于操作简单易用,机器运行稳定,结果可靠可用。机械臂的使用并未增加手术耗时,无需增加特殊装备满足定位需要;并且在不影响手术视野的情况下有效地减小了手术骨窗面积,降低了非术区脑组织损伤的风险。本研究使用机械臂辅助颅内占位病变体表定位,在术中未使用器械扩大骨窗的情况下,手术全切率与常规手术无显著差异;表明机械臂的辅助介入在提高颅内占位体表定位精度的同时不会影响实际手术疗效。21世纪以来,微创神经外科学理念逐渐深入神经外科的各个方面,其中很重要的一部分内容便是微骨窗入路,而实现这一点需要计算机科学和信息学等多学科的合作。神经外科机械臂的应用完全符合微创神经外科学理念,达到了脑肿瘤切除以最小创伤同时最大切除的目的[2,11]。Remebot神经外科机械臂定位系统是国内正式获批准的神经外科手术机械臂,当前的应用主要在于功能神经外科中需要高精度保证的术式,而将该定位系统应用于辅助颅内病变体表投影定位,有助于扩大该系统的应用范围,进一步发挥其定位准确、操作简便、自动化程度高等优势。
综上所述,采用机械臂辅助颅内病灶体表投影定位选择最佳切口入路,取得令人满意的临床效果。本研究的局限性是样本量较小,后期将进一步增加样本量以评价其安全性和稳定性。并且后续可进一步扩大其应用范围,如更深层次或者颅底、后颅窝等复杂区域的占位病变的体表定位。该技术对神经外科肿瘤切除手术的深远影响还有待更长时间的随访观察。机械臂辅助病灶体表定位操作简单、应用方便,能够准确地定位颅内病灶在头部体表的投影,帮助术者设计最佳手术入路,在最短路径到达病灶的同时尽可能地降低脑组织的损伤,提高患者手术耐受性,达到了准确、微创、快捷的目的。该技术还具有进一步开发和应用于其他术式的潜力。

