小脑发育不良性神经节细胞瘤合并Cowden综合征1例报告并文献复习
张达旻,唐莉莉,朱正权,夏海成
小脑发育不良性神经节细胞瘤(dysplastic cerebellar gangliocytoma)又称Lhermitte-Duclos病(Lhermitte-Duclos disease,LDD),是一种罕见的小脑神经节细胞过度增生所致的颅内占位性病变。近年来,越来越多的研究认为LDD是Cowden综合征(Cowden’s syndrome)的一种中枢神经系统表现[1]。Cowden综合征,又称多发性错构瘤-肿瘤综合征,是一种以皮肤黏膜病变、系统性错构瘤、高发乳腺、甲状腺和生殖器官恶性肿瘤为特征的常染色体显性遗传疾病。因LDD和Cowden综合征较罕见,如对其临床、影像学、病理特征表现认识不足,往往会造成误诊。新疆医科大学第三附属医院2017年2月收治1例经手术及病理检查证实的LDD合并Cowden综合征患者。本研究对该例患者的临床资料进行回顾分析,并复习相关文献,探讨LDD合并Cowden综合征的临床、影像学、病理学特征,以提高对该病的认识及诊断水平。
1 临床资料
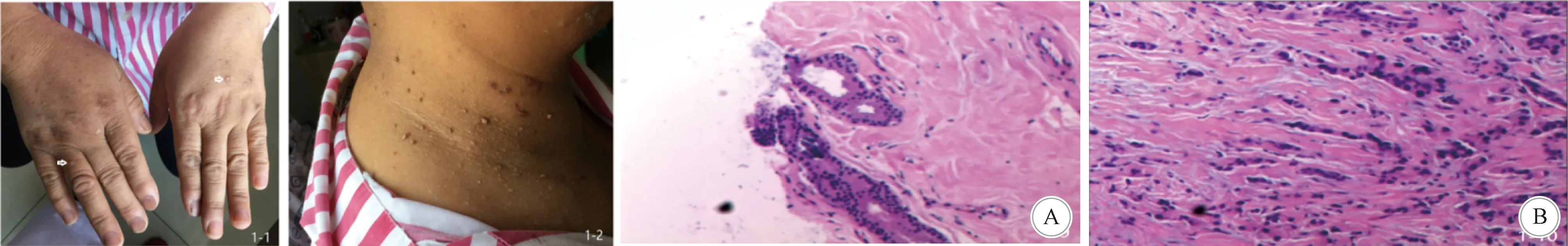
1.1 临床表现 患者,女,46岁,“发现右侧乳腺肿块半个月”于2017年2月22日入院。患者无明显颅内压增高表现;既往史:约30岁出现双手、足、颈部丘疹(图1),腋下皮肤赘生物。查体:右乳外上象限可触及1个大小约18.0 mm×6.0 mm的肿块,质地硬,界限不清,活动度佳,无局部皮肤粘连,未与胸壁固定,不伴有乳头溢液;右腋下可触及数个肿大淋巴结;双手、足、颈部可见丘疹,腋下可见多发条棒状赘生物,长约0.5~1 cm,直径约3 mm;反应略迟钝,未见明显神经系统功能障碍体征。
1.2 实验室检查 B超检查示:甲状腺多发结节病变,结节性甲状腺肿可能;双侧乳腺增生,右乳实性肿物(乳腺癌可能);右锁骨上、右腋下淋巴结肿大;慢性胆囊炎并胆囊多发结石;肝脏、脾脏、胰腺、双肾、子宫、双侧附件区未见占位性病变。乳腺肿块穿刺病理检查示:左乳肿块纤维组织增生,大汗腺化生;右乳肿块浸润性乳腺癌(图2);免疫组化:右乳肿块,ER(2+,90%)、PR(3+,90%)、Her-2(1+)、Ki-67(40%)、AR(2+,90%)。
1.3 影像学检查
1.3.1 胸部CT 右乳病变,考虑乳腺癌;右侧腋窝、右侧胸大小肌之间多发肿大淋巴结,右侧胸壁结节,双肺多发结节,提示转移瘤;左乳结节,考虑良性病变,纤维腺瘤可能;结节性甲状腺肿可能;胆囊结石;脾脏多发结节,转移瘤待排;肝脏结节(图3)。
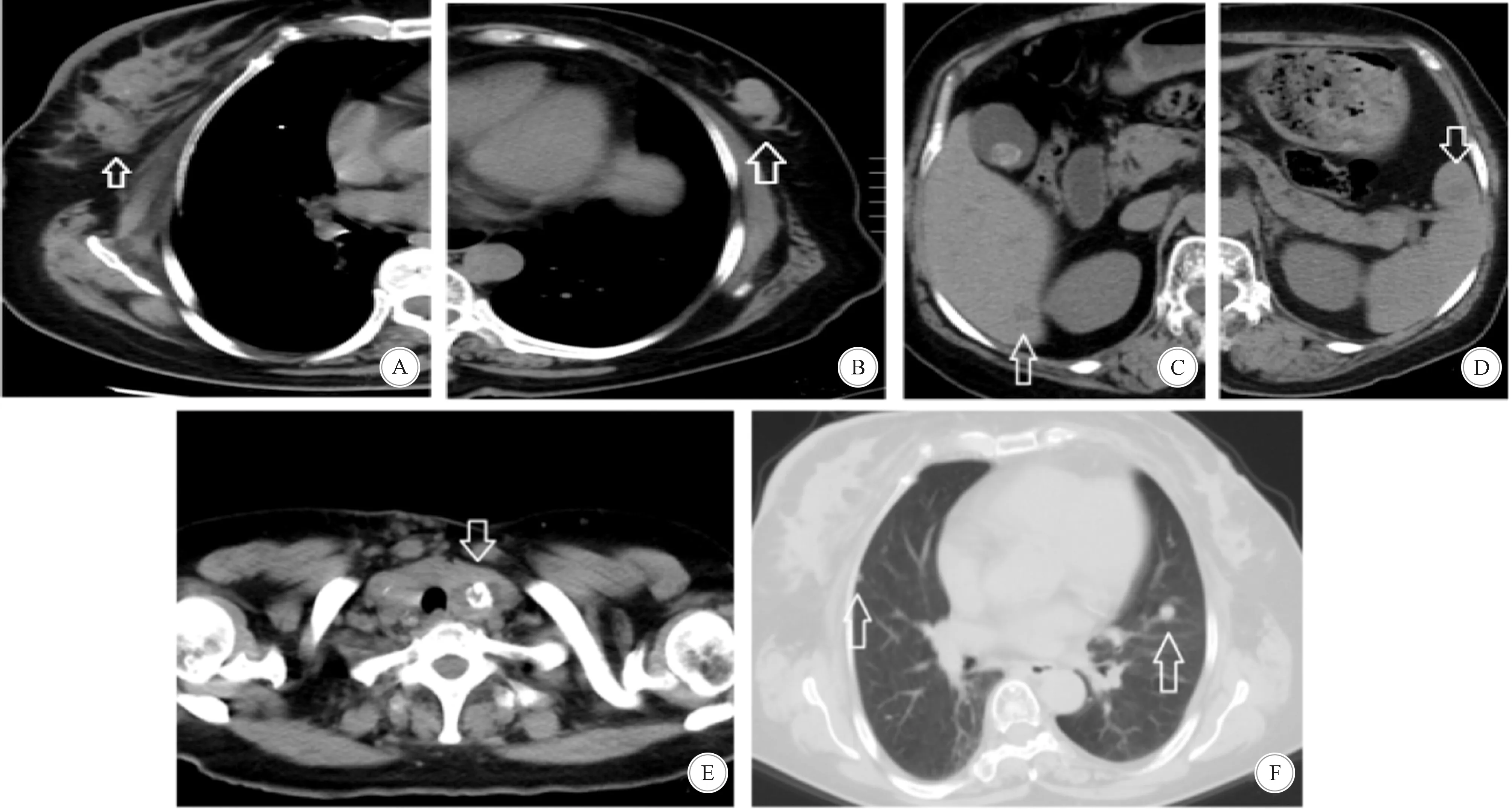
A:右侧乳腺癌; B:左乳纤维腺瘤; C:肝脏结节; D:脾脏结节,考虑转移灶; E:结节性甲状腺肿,可见钙化; F:肺部多发结节,考虑转移灶(箭头所指)图3 胸部CT检查结果
1.3.2 脑部MRI与CT MRI检查示:左侧小脑半球可见一类圆形肿块影,呈稍长T1稍长T2信号,压水像呈等/稍高信号,内部亦可见长T1长T2信号(图2A、B),压水像呈低信号,边界尚清(图2C、D),大小约64.1 mm×56.0 mm×46.1 mm;增强扫描病灶无明显强化(图4F、G),其上部可见一血管样强化影(图4G);小脑扁桃体下移,超过枕骨大孔约11.5 mm;第四脑室明显受压、变形,幕上脑室略扩张;中线结构居中。颅脑CT示,左侧小脑半球低密度影,转移瘤不除外(图4H)。影像学诊断为左侧小脑半球占位,考虑以下可能:(1)髓母细胞瘤;(2)低级别胶质瘤 ;(3)血管母细胞瘤;(4)转移瘤,其他不除外,并小脑扁桃体疝形成。
1.4 术中表现及病理学检查 经多学科讨论,考虑患者为乳腺癌晚期表现,颅内转移瘤待排除,因病灶巨大、占位效应明显,建议手术治疗。开颅手术中,见硬膜张力较高,颅内压明显增高;病变外观呈瓷白色,血供不丰富,边界不清;切除部分变性小脑皮质后,见一畸形小脑皮质逆行生长(图5A),长入脑实质内并使小脑实质形成腔隙,切除畸形生长的小脑皮质及部分变性小脑组织后小脑压力恢复正常;因病变界限不清,未行全切。术后常规病理检查示:灰白灰红碎组织一堆,总体积6.0 cm×4.0 cm×1.3 cm,部分表面见沟回结构,切面实性,灰白、灰红色,质软;显微镜下见肿瘤细胞呈圆形,部分细胞呈空泡状,细胞有异型,核仁明显,未见明显核分裂像(图5B、C),组织形态考虑为节细胞胶质瘤。免疫组化:胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(+)(图5G),NSE(+)(图5D),S-100(+)(图5E),Syn(+)(图5F),P53(-),CD34(血管+),Ki-67(1%+)。进一步复习相关文献资料,结合患者的体征、影像学表现,与病理科医师沟通后,反复看免疫组化切片,明确为GFAP胶质纤维背景(+)(图5G)、GFAP肿瘤细胞(-)(图5H);诊断为小脑发育不良性神经节细胞瘤。结合Cowden综合征诊断标准,确诊为小脑发育不良性神经节细胞瘤合并Cowden综合征。追问患者无家族史,因条件所限,未行人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphate and tension homology deleted on chromsome ten gene, PTEN基因)检查。
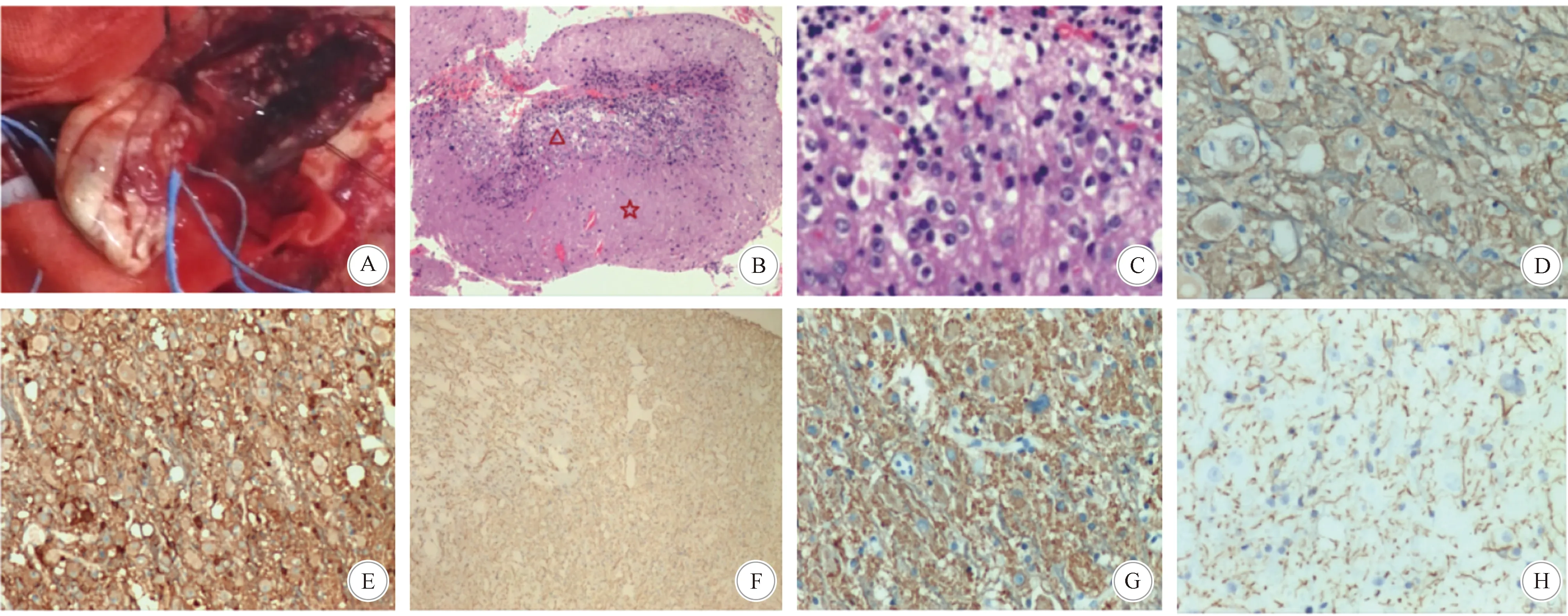
A:术中所见,病变畸形生长于小脑皮层下方; B:病理检查示,五角星示分子层,过度髓鞘化而增厚,三角形示颗粒细胞层,见节细胞增生(HE染色,×40); C:过度增生的节细胞,呈圆形、椭圆形,形态不一,核仁明显(HE染色,×100); D:免疫组化染色示,肿瘤细胞NSE阳性(×200); E:S-100阳性(×100); F:Syn阳性(×200); G:胶质纤维背景GFAP阳性(×40); H:肿瘤细胞GFAP阴性(×200)图5 术中所见及病理、免疫组化检查结果
1.5 术后治疗及随访 考虑患者为乳腺癌Ⅳ期,双肺转移,根据病情,在小脑病变切除术后,于2017年3月30日—7月31日给予TA方案化疗6周期(多西他赛120 mg静脉滴注D1+表柔比星120 mg泵入D1),后持续给予戈舍瑞林去势治疗及来曲唑片内分泌治疗至2017年12月6日。随访至今患者的病情稳定,未见乳腺癌、小脑病变进展。术后9个月复查胸部CT示,肺部、肝脏、脾脏的结节未见明显变化(图6),考虑为结节性病变。患者的头围60 cm。患者有一女,16岁,目前无皮肤黏膜病变及乳腺异常。
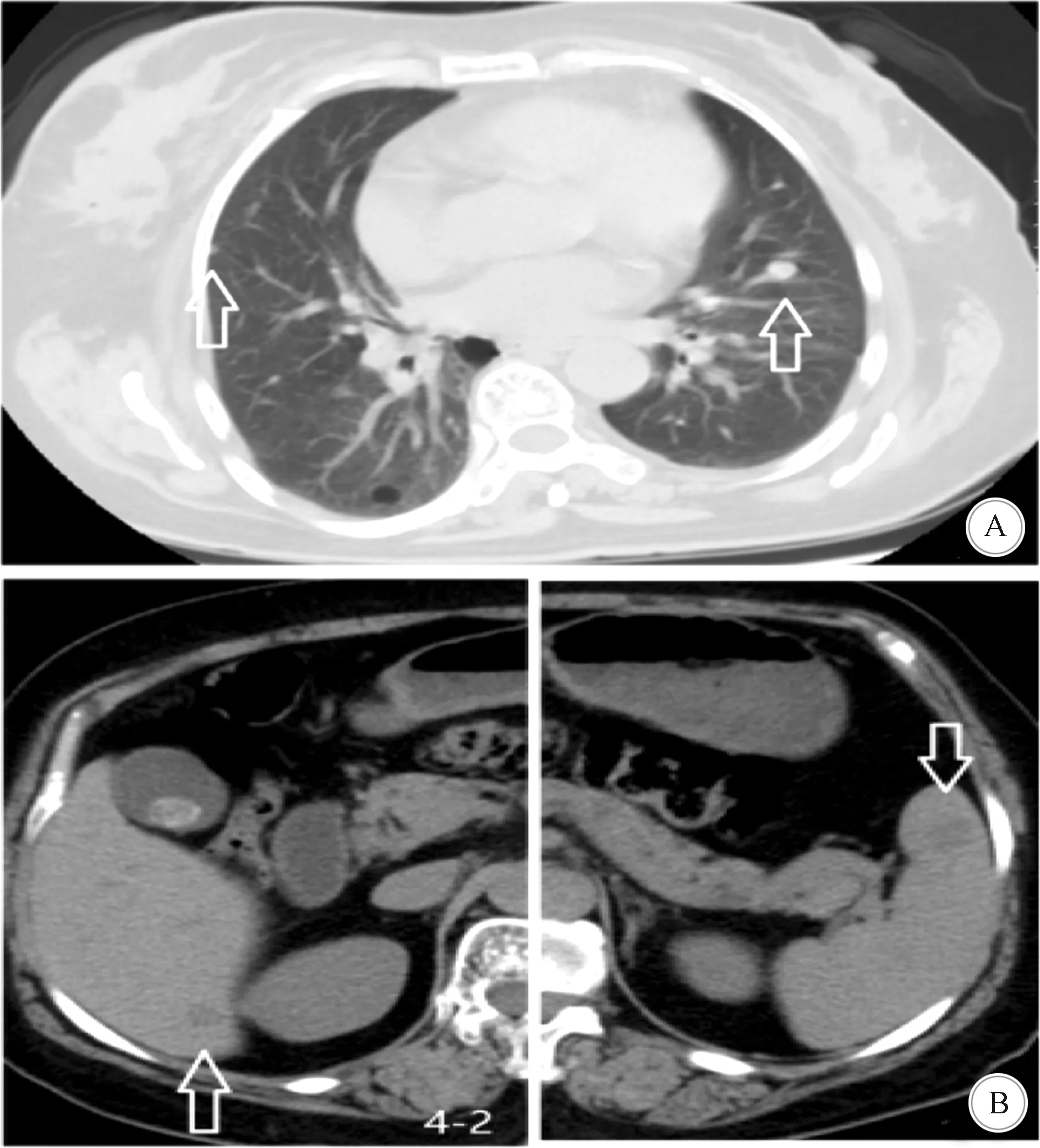
A:肺部; B:肝脏; C:脾脏,各脏器的结节性病变均无明显变化(箭头所指)图6 术后9个月复查胸部CT结果
2 讨 论
2.1 临床特点 LDD于1920年由Lhermitte和Duclos首次报道,因发现患者小脑叶异常增宽伴异常的神经节细胞而命名[2]。在WHO(2016)中枢神经系统肿瘤分类中,LDD位于神经元和混合性神经元-胶质肿瘤中,肿瘤性质为良性Ⅰ级[3]。但其发病机制尚不明确,LDD究竟是良性肿瘤、错构瘤、先天性畸形一直存在争论。自Padberg等[4]首次认识到Cowden综合征与LDD的关系,越来越多的研究表明LDD是Cowden综合征在中枢神经系统的主要表现[1]。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)在遗传/家族高风险评估-乳腺癌和卵巢癌指南(2017年第2版)中,成人LDD是诊断Cowden综合征的一个标准[5]。另外,基于大部分LDD与Cowden综合征具有相同的分子学基础,即PTEN基因突变,LDD更倾向于错构瘤起源。
LDD可发病于婴儿至老年各年龄段,以中青年为主,30~40岁为发病高峰期,无明显性别差异。其进展缓慢,临床表现不典型,往往以后颅窝占位引起的颅内压增高及共济失调表现为主;当肿瘤压迫第四脑室阻塞脑脊液循环,可因急性脑积水出现症状。Cowden综合征为全身系统性疾病,有8项主要诊断标准和11项次要诊断标准[5],皮肤黏膜病变、巨头征、体表肿物(乳腺肿块、甲状腺肿块)易于发现,需引起重视,积极完善全身系统检查,以明确诊断。由于LDD与Cowden综合征的密切关系,Cowden综合征的发现往往是LDD诊断的关键,具有特异性。本例患者约30岁出现双手、足、颈部丘疹,腋下皮肤赘生物,巨头征不明显(头围60 cm,仍大于58 cm),自我发现右侧乳腺肿块,超声检查发现甲状腺结节、左乳纤维增生;另外,右侧乳腺肿块活检病理检查明确为浸润性乳腺癌,符合Cowden综合征的诊断。当MRI与CT检查发现左侧小脑半球占位,应考虑LDD的可能;但是,由于对LDD的临床特点缺乏认识,并且患者又患有右侧乳腺癌,开始诊断考虑为颅内转移瘤的可能。
当然,并非所有的LDD均存在典型的Cowden综合征的表现,尤其是儿童LDD患者,往往未能发现PTEN基因突变,而考虑与成人LDD存在不同的肿瘤生物学行为[6]。但对怀疑LDD的患者,需重视全身系统检查,提高确诊率;对确诊为LDD而没有典型Cowden综合征的患者,需在后期随访过程中,积极注意甲状腺、乳腺、泌尿生殖系统的查体,以期及时发现恶性肿瘤;对患者的直系亲属,同样需注意体检筛查。
2.2 影像学表现 虎纹征、增强扫描病灶不强化是LDD患者的MRI独特表现,是具有不典型临床征象的LDD诊断的有力补充,可以作为肯定的术前诊断及鉴别诊断依据。虎纹征,即在MRI上以长T1长T2信号为主,其间交错有等T1等T2信号,呈分层状条纹样影像[7],故又称为条纹征、叠瓦征、掌纹征。病变往往发生于一侧小脑半球,与正常侧小脑叶片样结构相比(横行排列),其条纹状结构呈增厚的不规则排列(斜行或纵行);病变边界清晰,占位效应明显,无明显瘤周水肿表现。在CT上病灶呈低密度影改变,有报道病变可以出现钙化[8];因后颅窝伪影的出现,CT在诊断上具有局限性。本例患者术前MRI检查显示有相似的典型影像特征,但因对LDD的影像学特征表现认识不足,而未能在术前诊断。
LDD因在MRI增强扫描不强化易与常见的小脑肿瘤相鉴别,如髓母细胞瘤、室管膜瘤、血管母细胞瘤、转移瘤、毛细胞型星形细胞瘤;但重点需要与以下疾病相鉴别[9]。(1)节细胞胶质瘤(ganglioglioma,GG),儿童、青少年多发,多见于颞叶、额叶,影像学表现为囊实性占位,边界不清,可出现钙化,增强扫描可见环形强化。(2)胚胎发育不良性神经上皮肿瘤(dysembryoplastic neuroepithelial tumor,DNT),发病年龄往往在20岁以下,有长期难以控制的癫痫发作史,颞叶、额叶多见,典型DNT在MRI上常呈倒三角,以囊性为主,边界清晰,无瘤周水肿,出血、钙化少见,增强扫描无明显强化。(3)婴儿促纤维增生型节细胞胶质瘤(desmoplastic infantile ganglioglioma,DIG),多见于1岁以内婴儿,额叶多见,易囊变,囊壁结节强化明显。(4)小脑半球脑梗死,中老年多见,一般有急性发病症状,病变分布与责任血管供应区相一致,无典型条纹改变,初期无明显占位效应,增强无强化,后期可见脑回样强化。(5)脑炎,多有感染病史及中毒症状,脑组织水肿明显,增强可有强化。有研究[10-12]报道在功能MRI上的表现可进一步作为诊断依据,目前较为统一的观点有:(1)MRS表现为Cho升高、NAA下降不明显,NAA/Cho往往并不倒置,出现Lac峰;(2)DWI上多呈略高信号,ADC图显示水弥散无干扰;(3)PWI表现为高灌注表现;(4)SWI可见小叶间深静脉显示,可能是部分LDD强化的基础。另外,在PET-CT、PET-MRI上可见LDD存在葡萄糖高代谢表现。本例患者在DWI和ADC上有相似表现,增强扫描可见一血管样强化影,与SWI表现相符。
2.3 病理特点 术中若发现小脑畸形生长、粗大的脑沟回样病变结构可有助于LDD的诊断,病变嵌入表面脑回深部,灰白色,呈胶冻样。整体而言,病变外观呈瓷白色,血运不丰富,与周围正常脑组织界限不清,手术全切困难。病变组织镜下所见须与正常小脑皮层结构相比较,注意形态结构的演变有助于明确诊断。正常小脑皮层由外向内分别为分子层、浦肯野细胞层(小脑节细胞层)、颗粒细胞层,深部为小脑白质。LDD的分子层因过度髓鞘化而增宽,浦肯野细胞层消失,颗粒细胞层出现大量的发育不良的神经节细胞而增厚,中央白质萎缩而减少,因脱髓鞘而呈裂隙样腔隙[9]。单纯镜下所见需要与GG相鉴别,GG因具有肿瘤性胶质混合成分而命名,根据胶质成分的组织学分级可划分为WHO Ⅰ、Ⅱ、Ⅲ级,因胶质成分的出现,GG结构相对复杂;而LDD以发育不良的神经节细胞成分为主,胶质细胞成分较一致,无异型性[13]。LDD的免疫组化中,肿瘤细胞NeuN、Syn、S-100、NSE阳性提示为神经节细胞起源,肿瘤细胞GFAP阴性提示非胶质细胞起源。国内有少数报道肿瘤细胞GFAP(+),易误诊为GG;需要注意鉴别其是肿瘤细胞内表达阳性[14],还是胶质纤维背景染色阳性[13],以明确诊断。本例患者的免疫组化出现相似问题,经反复阅片,确定为肿瘤细胞内GFAP(-)、胶质纤维背景(+),表明肿瘤细胞为节细胞起源,而非胶质细胞起源。
2.4 诊断与治疗 LDD常常合并有Cowden综合征表现,具有典型的影像学特征及独特的病理学表现;掌握以上特点,LDD的诊断并不困难。治疗上,对于具有明显的颅内压增高及脑积水、小脑扁桃体疝等影像学表现的患者,建议积极予以手术治疗;由于LDD边界不清,手术全切困难,对于无明显症状的患者可随访观察。随访观察中须注意对患者及其家属全身系统检查,以早期发现Cowden综合征常见恶性肿瘤的发生,早期干预治疗。本例患者治疗后随访,复查胸部CT显示肺部、脾脏、肝脏结节性病变无明显变化。患者多脏器的结节性病变是否为Cowden综合征系统的表现之一,而非转移灶,需要进一步病理检查诊断;若其为良性结节性病变,乳腺癌的分期是否需要修正,是否可行根治性乳腺癌切除术,需要与乳腺外科医师进一步讨论,以积极控制病情变化,改善患者的预后。由于LDD和Cowden综合征的发病年龄较晚(30~40岁),本例患者的女儿(16岁)需要长期注意自我检查,并定期体检。

