超声造影时间-强度曲线联合CTA预测缺血性脑卒中复发的价值
王皓香 袁 媛 龙海波 滕志朋 万文武 王 广 彭 形 陈 飞 张 维
缺血性脑卒中(ischemic stroke,IS)因脑血管狭窄闭塞导致脑供氧不足,神经细胞缺血缺氧造成不可逆的损伤,致残率及死亡率均较高。IS复发率高,因此准确评估IS复发风险,并及时采取预防措施降低复发风险对临床具有重要意义[1]。颈动脉、颅内动脉血管狭窄是导致IS的主要原因之一,临床多使用CTA检测血管狭窄情况并显示其位置,但其评估IS的发生具有局限性[2]。动脉粥样硬化可形成不稳定颈动脉斑块,导致血管栓塞,是造成IS的危险因素,超声造影时间-强度曲线(time-intensity curve,TIC)可检测斑块下血管新生,评价斑块的稳定性,进而评估患者发生IS的风险[3]。本研究旨在分析超声造影TIC联合CTA对IS患者复发的预测价值。
资料与方法
一、研究对象
选取2018年1月至2020年1月我院收治的95例IS患者,男60例,女35例,年龄51~79岁,平均(63.47±9.25)岁。纳入标准:①符合IS诊断标准[4];②经影像学检查确诊;③颈动脉斑块厚度≥2 mm;④首次确诊。排除标准:①心源性脑卒中者;②脑出血者;③死亡、失访及其他原因脱离随访者;④精神病、严重意识障碍及其他器官严重功能障碍者。根据随访1年内是否复发IS分为复发组和未复发组。复发组中男27例,女17例,年龄55~79岁,平均(57.2±4.6)岁;未复发组中男33例,女18例,年龄51~69岁,平均(53.4±3.1)岁。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.超声造影:使用日立HI VSION Preirus彩色多普勒超声诊断仪,探头频率5~12 MHz;配备脉冲谐波造影功能。患者取仰卧位,充分暴露颈部,常规检查其颈总动脉、颈内动脉、颈外动脉斑块位置、数量、大小及回声强度,记录最厚斑块长度和厚度。选择超声造影模式,造影剂使用意大利Bracco公司生产的声诺维(SonoVue),5.0 ml生理盐水稀释后振荡混匀配制成混悬液,经肘静脉团注造影剂1.5 ml,跟随5.0 ml生理盐水冲管。启动计时器,同步保存90 s动态图像,观察造影剂显影及分布情况,直至造影微泡消失。采用SonoLiver定量分析软件绘制斑块感兴趣区(ROI),选取斑块同一平面大小形态一致的颈动脉管腔区域ROI作为对比,尽量避开强回声区干扰,分析斑块造影后的时间-强度变化,记录始增时间、达峰时间(TTP)、曲线上升支斜率、峰值强度(PI)、峰值时间(MTT),计算曲线下面积(AUCTC)。
2.CTA检查:使用西门子SOMATOM Perspective 64排128层螺旋CT仪。患者取仰卧位,先行颅脑CT平扫,经肘静脉注射100.0 ml碘海醇液非离子型对比剂(扬子江药业集团有限公司,国药准字H10970358),注射流速4.5 ml/s,延迟8 s后启动自动追踪触发扫描,主动脉弓部设定阈值120 Hu,扫描范围为主动脉弓至头颅顶部。将采集数据导入设备配套的Syngo Via CT Vascular软件,对颅脑血管进行重建和分析。动脉狭窄的标准参照颈动脉狭窄标准[4],分为正常(狭窄率≤10%)、轻度狭窄(狭窄率10%~30%)、中度狭窄(狭窄率>30%~70%)、重度狭窄及闭塞(狭窄率≥70%)4个等级。
3.随访情况:患者出院后每3个月随访1次,持续1年,若出现符合诊断标准[5]中IS相关临床症状,嘱其行CT或MRI检查确定是否复发IS,比较复发组和未复发组患者治疗前一般情况、美国国立卫生研究院卒中量表(NIHSS)评分、超声造影及CTA检查结果。
三、统计学处理
结 果
一、两组一般资料比较
复发组年龄≥65岁者占61.36%,未复发组占39.22%,差异有统计学意义(P<0.05);复发组合并高血压病者占59.09%,未复发组占37.25%,差异有统计学意义(P<0.05)。两组其余一般资料比较差异均无统计学意义。见表1。
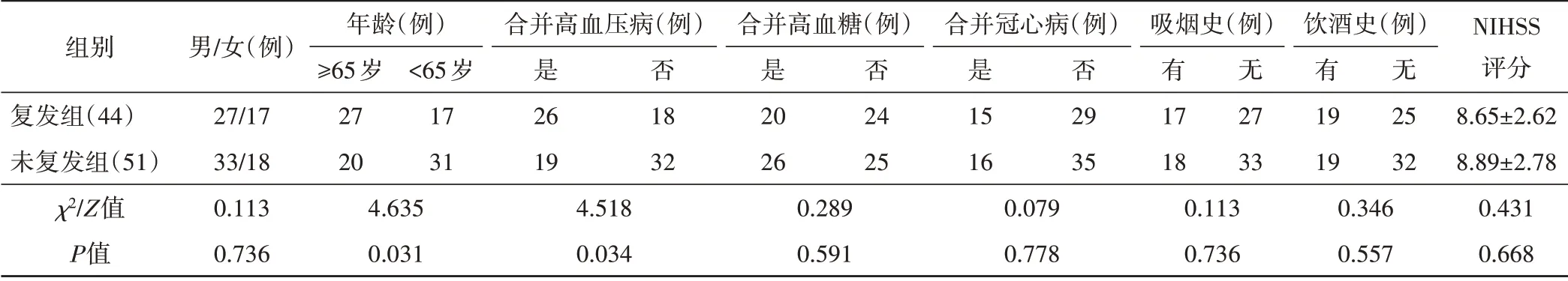
表1 两组一般资料比较
二、两组超声造影TIC参数比较
与未复发组比较,复发组TTP降低,PI、AUCTC均升高,差异均有统计学意义(均P<0.05)。始增时间、曲线上升支斜率、MTT比较差异均无统计学意义。见表2和图1。
表2 两组超声造影TIC参数比较(±s)

表2 两组超声造影TIC参数比较(±s)
TTP:达峰时间;MTT:峰值时间;PI:峰值强度;AUCTC:时间-强度曲线下面积
组别复发组(44)未复发组(51)t值P值始增时间(s)5.52±1.38 5.46±1.35 0.214 0.831 TTP(s)8.66±3.29 12.86±5.72 5.817<0.001曲线上升支斜率0.91±0.23 0.83±0.26 1.577 0.118 MTT(s)26.67±8.68 28.62±9.75 1.022 0.309 PI(dB)72.71±8.25 64.72±7.22 5.034<0.001 AUCTC(dB·s)3003.33±470.55 2166.96±445.21 8.893<0.001

图1 复发组与未复发组超声造影TIC图
三、两组CTA检测血管狭窄程度比较
未复发组血管狭窄程度与复发组比较差异有统计学意义(Z=2.607,P=0.009)。见表3。

表3 两组CTA检测血管狭窄程度比较 例
四、Logistic回归分析
以IS是否复发作为因变量,将单因素方差分析中年龄、合并高血压病、CTA测得血管狭窄、TTP、PI、AUCTC作为自变量,进行多因素Logistic回归分析,结果显示TTP短、CTA测得血管狭窄、AUCTC高是IS复发的独立危险因素。见表4。
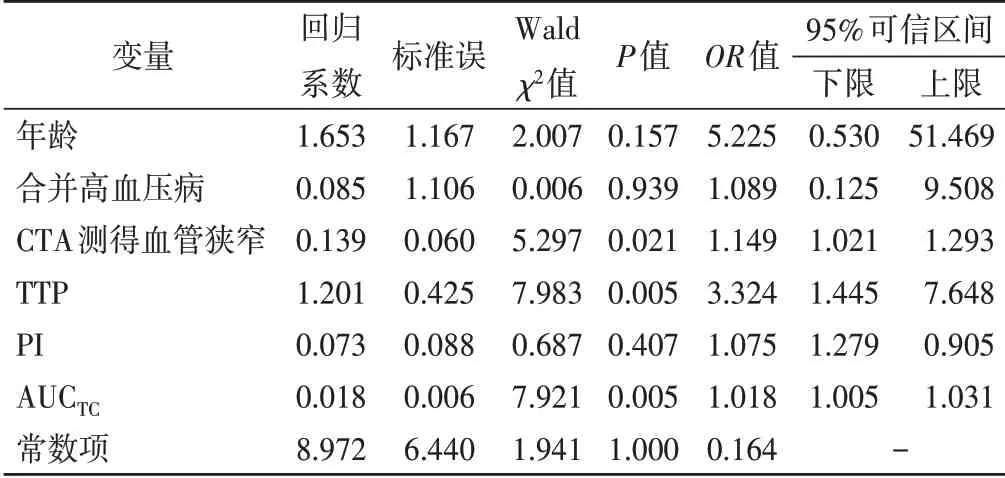
表4 Logistic回归分析IS复发的危险因素
五、ROC曲线分析
ROC曲线分析显示,TTP、PI、AUCTC、CTA检测血管狭窄率预测IS复发的曲线下面积分别为0.724、0.763、0.906、0.694,AUCTC与血管狭窄率联合应用预测IS复发的曲线下面积为0.951,与各参数单独应用比较差异均有统计学意义(均P<0.05)。见表5和图2。
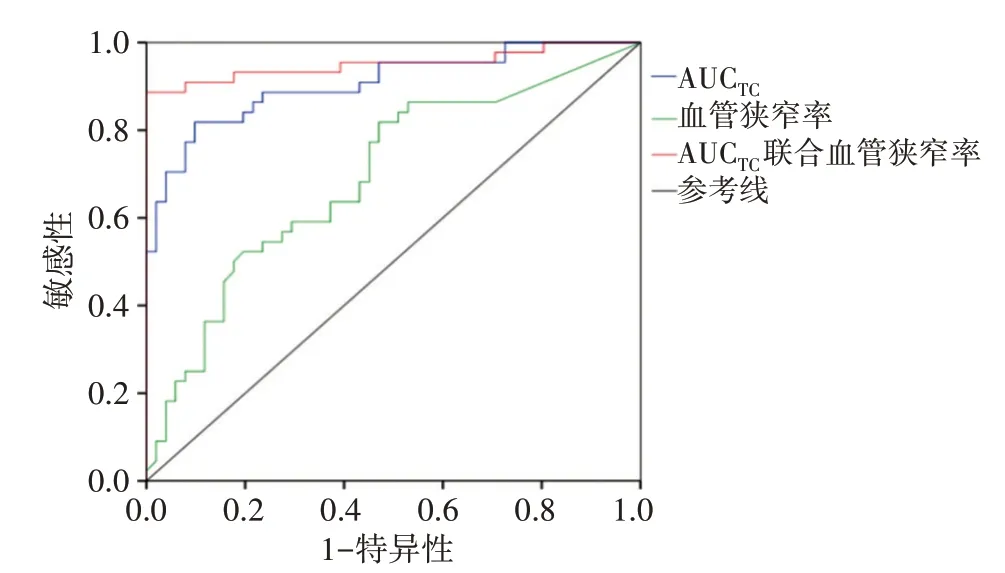
图2 AUCTC、血管狭窄率及其联合应用预测IS复发的ROC曲线图

表5 TIC参数、血管狭窄率及其联合应用预测IS复发的ROC曲线分析
讨 论
大动脉或其分支血管阻塞导致血流不能流入大脑,引起脑组织血流供应中断和能量耗竭,缺血性受损脑组织细胞会迅速产生活性氧,释放促炎介质,发生炎症反应,血脑屏障破坏、缺血半暗带区神经细胞凋亡均会使神经元发生不可逆的坏死,同时长时间梗死后恢复血流可引发缺血再灌注损伤,脑组织发生氧化应激反应,进一步加剧损伤,导致IS患者语言、意识、认知功能均出现障碍,严重者发展为脑死亡。临床多采用溶栓、手术等方式治疗,但无法从根本上解决脑卒中的致病因素,导致IS患者复发的风险较高[6]。因此早期评估IS患者是否具有复发风险,并采取相应的预防措施至关重要。
研究[7]显示,血管狭窄与IS密切相关,血管狭窄程度加重易导致病情发展,可能与预后复发有关。CTA是检查颅内外血管狭窄常用的影像学方法,可以多角度观察颅内外血管管腔形态,准确显示脑血管情况,从而评估颅内外血管狭窄情况,分析侧支循环情况,具有较高的诊断价值[8]。但该技术对管壁和斑块内部结构显示不足,无法准确显示血管斑块的形态和位置,不能区别血管壁斑块的稳定性[9]。本研究结果显示复发组动脉血管狭窄程度较未复发组更严重,差异有统计学意义(P<0.05)。动脉血管狭窄是IS后复发的独立危险因素,血管越狭窄,复发风险越高。本研究ROC曲线分析发现,CTA检测血管狭窄率预测IS复发的曲线下面积为0.694,敏感性和特异性分别为81.8%、52.9%,其预测IS复发具有一定的价值,但易造成假阳性和假阴性结果,不宜单独作为预测标准。
共识[10]指出高血压病是脑卒中发病的重要因素。本研究结果显示复发组患者合并高血压病的比例明显高于未复发组(P<0.05),表明高血压病与脑卒中复发相关;但本研究Logistic回归分析显示其并非IS复发的独立影响因素,可能与部分患者高血压病程较短及血压控制良好有关。动脉粥样硬化既可引起血管壁狭窄,又可形成不稳定斑块引起血栓,从而引发IS[11]。超声造影是评价动脉粥样硬化斑块的常用方法,TIC能实时动态观察斑块内新生血管,定量分析斑块内血管新生情况,准确判断斑块的稳定性[12]。本研究结果显示,与未复发组比较,复发组TTP降低,PI升高(均P<0.05),提示复发组斑块血管新生较明显,斑块稳定性较差,原因可能为丰富的新生血管促进了斑块的不稳定性,易发生破裂,导致IS复发。ROC曲线分析发现,AUCTC预测IS复发的曲线下面积为0.906,而TTP、PI的曲线下面积分别为0.724、0.763,预测价值低于AUCTC,分析原因为单一参数易受患者个体差异、人为操作等因素的影响,可能产生偏差,而AUCTC则是根据一段时间内仪器收集到的血流信号综合计算出来的数值,排除了其他因素干扰,能提高诊断准确率。本研究TIC联合CTA预测IS复发的ROC曲线下面积为0.951,敏感性和特异性分别为88.6%和100%,曲线下面积与各参数单独应用比较差异均有统计学意义(均P<0.05),提示TIC联合CTA能更好地预测IS复发,全面了解血管内斑块和血管新生情况,评估血管再次发生栓塞的风险,指导临床制定有效的治疗方案,避免IS复发。
综上所述,血管狭窄和动脉粥样硬化不稳定斑块是IS复发的独立危险因素,超声造影TIC联合CTA对预测IS复发具有较高价值。

