胃充盈超声检查联合血清学指标在胃癌术前TNM分期中的应用价值
谢允虎 陈建峰 吴海明 程秋莹 朱彩霞
胃癌主要源于胃黏膜上皮细胞,以往临床多选择超声内镜作为其主要检查方式,通过超声引导确保内镜直达靶器官,以了解病灶浸润深度和淋巴结转移情况,但其在判断时存在误差,且适用人群较为局限[1]。胃充盈超声检查(FUS)可探查病灶,清晰显示胃壁结构层次和厚度,了解淋巴结转移情况,在胃癌术前分期诊断中具有较高价值[2]。但肿瘤浸润和转移是一个复杂连续的过程,关联到宿主细胞和肿瘤细胞相互作用,涉及血管形成、细胞迁移、蛋白质水解、细胞间黏附等,其中细胞外基质在肿瘤侵袭、转移评估中有关键作用[3]。基质金属蛋白酶-7(MMP-7)和基质金属蛋白酶-9(MMP-9)是较为重要的两种降解胶原纤维酶类,可促进肿瘤细胞对周围组织浸润,但其在胃癌分期中的价值尚未明确。本研究旨在探讨FUS联合MMP-7、MMP-9在术前筛查不同分期胃癌中的应用价值。
资料与方法
一、研究对象
选取2018年2月至2020年2月我院经病理证实的胃癌患者82例,其中男42例,女40例,年龄42~78岁,平均(59.65±11.86)岁;均为单发,病灶直径0.7~4.2 cm,位于贲门13例,胃体20例,胃窦49例。临床表现为大便性状改变、反酸、嗳气、腹痛、腹胀及消化不良等。排除标准:①伴血液系统、免疫系统疾病者;②伴严重基础病,无法进行手术者;③正在进行抗凝治疗或存在活动性出血倾向者;④有胃肠道梗阻或穿孔者;⑤相关禁忌症。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.FUS检查:使用迈瑞DC-8彩色多普勒超声诊断仪,凸阵探头,频率2.5~5.0 MHz。患者检查前禁食禁饮8 h,将50 g速溶胃肠超声助显剂(生产厂家:湖州东亚医药用品有限公司)与500 ml温开水混合均匀,冷却后均匀饮服400 ml,剩余100 ml一口饮服,立即探查贲门。1~5 min后患者取右侧卧位和仰卧位,必要时取胸膝位、左侧位、坐卧位,插入超声胃镜至十二指肠降部,发现病灶后放大图像,仔细观察胃周、胃壁层次结构和腹腔情况,以及病变部位、数目、大小形态、回声特征、浸润深度及有无淋巴结转移。胃癌判定标准[4]:病灶处胃壁结构紊乱,可见增厚与隆起,呈低回声,常有斑点状强回声附着。
2.实验室检查:在胃镜引导下确定病变位置,切除标本后制成切片,使用链霉素抗生物素蛋白-过氧化酶免疫组化染色法检测MMP-7、MMP-9表达量。患者于空腹状态下抽取静脉血,使用双抗夹心ELISA法检测血清MMP-7、MMP-9,试剂盒由上海康朗生物科技有限公司提供,所有操作均按说明书进行。
3.胃癌分期标准参考《国际抗癌联盟及美国肿瘤联合会胃癌TNM分期系统(第8版)》[5],T分期分为T1~T4期;N分期分为N0~N3期;M分期分为M0和M1期。
4.观察指标:①分析不同分化程度、不同浸润程度及不同淋巴结转移情况胃癌患者的MMP-7、MMP-9表达,细胞浆内或细胞膜上出现棕黄色或黄色颗粒判为阳性[6];②以病理检查结果为标准,分析FUS、MMP-7、MMP-9及其联合对TNM分期的诊断准确率;③分析不同胃癌分期患者MMP-7、MMP-9的差异。
三、统计学处理
结 果
一、胃癌患者TNM分期情况
82例患者中,T分期:T0期11例,T1期16例,T2期20例,T3期25例,T4期10例;N分期:N0期11例,N1期25例,N2期30例,N3期16例;M分期:M0期11例,M1期71例。
二、超声对不同分期胃癌的检查情况
胃癌TNM不同分期超声检查图像见图1。早期胃癌声像图表现为不规则隆起或凹陷,胃壁黏膜局限性增厚,黏膜上皮连续性可有中断,动态观察胃蠕动时,局部无明显变化,胃腔无狭窄。浸润深度:肌层/浆膜层55例,黏膜/黏膜下层27例;淋巴结转移情况:63例存在淋巴结转移(其中33例转移至幽门下,27例转移至腹腔动脉,3例转移至主动脉周围),19例无淋巴结转移。

图1 胃癌TNM不同分期超声图像
三、MMP-7、MMP-9在不同表现胃癌患者中的表达情况
低分化胃癌患者MMP-7、MMP-9阳性率高于中分化和高分化患者(χ2=12.793、5.864,均P<0.05);淋巴结转移患者MMP-7、MMP-9阳性率高于无淋巴结转移患者(χ2=38.110、29.450,均P<0.05);浸润深度处于肌层/浆膜层患者MMP-7、MMP-9阳性率高于处于黏膜/黏膜下层患者(χ2=5.727、5.425,均P<0.05)。见表1。

表1 MMP-7、MMP-9在不同表现胃癌患者中的表达情况 例
四、不同胃癌分期患者MMP-7、MMP-9指标比较
T0~T4期患者MMP-7、MMP-9比较差异均有统计学意义(F=36.410、146.029,均P<0.05),各分期间两两比较差异均有统计学意义(均P<0.05);N0~N3期患者MMP-7、MMP-9比较差异均有统计学意义(F=107.769、253.250,均P<0.001),各分期间两两比较差异均有统计学意义(均P<0.05);M0、M1期患者MMP-7、MMP-9比较差异均有统计学意义(t=5.843、18.250,均P<0.001)。见表2~4。
表2 不同T分期胃癌患者MMP-7、MMP-9比较(±s) μg/L

表2 不同T分期胃癌患者MMP-7、MMP-9比较(±s) μg/L
与T0期比较,*P<0.05;与T1期比较,#P<0.05;与T2期比较,▼P<0.05;与T3期比较,▽P<0.05。MMP-7:基质金属蛋白酶-7;MMP-9:基质金属蛋白酶-9
分期T0期T1期T2期T3期T4期MMP-7 25.45±3.33#▼▽32.56±4.16*▼▽33.98±5.82*#▽46.73±6.32*#▼58.79±8.77*#▼▽MMP-9 168.49±12.27#▼▽210.96±16.75*▼▽238.95±18.16*#▽316.65±22.16*#▼396.53±28.44*#▼▽
三、诊断效能分析
表3 不同N分期胃癌患者MMP-7、MMP-9比较(±s) μg/L

表3 不同N分期胃癌患者MMP-7、MMP-9比较(±s) μg/L
与N0期比较,*P<0.05;与N1期比较,#P<0.05;与N2期比较,▼P<0.05。MMP-7:基质金属蛋白酶-7;MMP-9:基质金属蛋白酶-9
分期N0期N1期N2期N3期MMP-7 24.13±3.59#▼30.79±4.11*▼43.86±5.69*#56.98±7.86*#▼MMP-9 175.96±15.65#▼279.68±20.16*▼352.66±22.49*#386.46±26.95*#▼
FUS、MMP-7、MMP-9及其联合对TNM分期的诊断效能见表5和图2~4。FUS、MMP-7、MMP-9联合应用诊断T分期的AUC为0.993,均高于三者单独应用(Z=2.789、3.273、3.021,P=0.006、0.001、0.002);FUS、MMP-7、MMP-9联合应用诊断N分期的AUC为0.993,均高于三者单独应用(Z=2.712、3.456、3.381,P=0.006、0.004、0.006);FUS、MMP-7、MMP-9联合应用诊断M分期的AUC为0.948,均高于三者单独应用(Z=2.346、2.761、2.847,P=0.018、0.004、0.004)。FUS、MMP-7、MMP-9联合应用诊断TNM分期的敏感性、特异性、准确率均高于三者单独应用,差异均有统计学意义(均P<0.05)。
表4 不同M分期胃癌患者MMP-7、MMP-9比较(±s) μg/L

表4 不同M分期胃癌患者MMP-7、MMP-9比较(±s) μg/L
与M0期比较,*P<0.05。MMP-7:基质金属蛋白酶-7;MMP-9:基质金属蛋白酶-9
分期M0期M1期MMP-7 25.13±2.11 42.65±9.86*MMP-9 170.33±16.68 315.26±25.43*

表5 FUS、MMP-7、MMP-9及其联合对胃癌患者TNM分期的诊断效能

图2 FUS、MMP-7、MMP-9及其联合诊断胃癌患者T分期的ROC曲线图
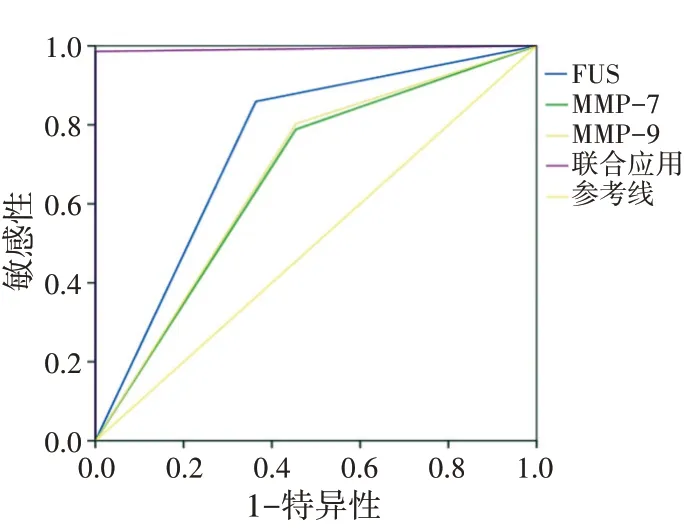
图3 FUS、MMP-7、MMP-9及其联合诊断胃癌患者N分期的ROC曲线图

图4 FUS、MMP-7、MMP-9及其联合诊断胃癌患者M分期的ROC曲线图
讨 论
目前,临床多使用超声内镜检查胃癌,虽可获取淋巴结、邻近组织、胃壁层次等信息,但无法全面观察胃壁,不利于观察黏膜下层,且费用较高,操作复杂。FUS具有方便、无痛、性价比高等优势,可利用助显剂充盈胃肠腔,清晰显示病变部位、大小及侵犯胃壁层次,准确评估胃壁脏器转移及相邻淋巴结、组织等情况[7]。有学者[8]发现恶性肿瘤最重要的特征为转移和侵袭,在发病过程中可影响细胞外基质、宿主细胞、肿瘤细胞。MMP属于细胞外基质降解酶,可降解细胞外基质所有成分,其是否影响肿瘤转移、侵袭已成为当前研究热点。
MMP主要依赖Zn2+蛋白酶家族,由肿瘤细胞、巨噬细胞、中心粒细胞、纤维母细胞分泌而成,在人体组织内分布较广,可调节细胞与细胞、细胞与基质间的信号,调控肿瘤新生血管形成,影响肿瘤细胞生长[9]。MMP-9以酶原形式分泌,激活后可降解Ⅴ型胶原和Ⅳ型胶原,破坏基底膜完整性,为侵入淋巴管、血管及浸润走位组织创造有利条件[10];MMP-7能够降解细胞外基质中的Ⅳ型胶原纤维、纤维连接素、蛋白多糖、弹力纤维及多种抑制肿瘤转移的跨膜蛋白,促进肿瘤细胞在微环境中移行,削弱肿瘤细胞与间质之间的粘合力[11]。本研究中,低分化胃癌患者MMP-7、MMP-9阳性率均高于中、高分化患者(均P<0.05),提示MMP在胃癌发生发展中可能具有重要作用,阳性检出率可作为胃癌的敏感性指标之一。本研究结果还显示,淋巴结转移和肿瘤浸润深度处于肌层/浆膜层患者的MMP-7、MMP-9阳性率均高于无淋巴结转移和浸润深度处于黏膜/黏膜下层患者,差异均有统计学意义(均P<0.05),说明MMP-7、MMP-9阳性率随着疾病严重程度上升,原因是肿瘤细胞可通过膜粘合分子或可溶介质与间质细胞进行信息交换,调节基质金属蛋白酶,使其在肿瘤细胞侵袭中发挥重要作用。此外,本研究结果发现不同TNM分期患者MMP-7、MMP-9比较差异均有统计学意义(均P<0.05),且各分期间两两比较差异均有统计学意义(均P<0.05),说明MMP-7、MMP-9参与了胃癌发生、侵袭转移过程,其表达量随胃癌分期、病情程度而出现不同程度改变。
FUS利用助显剂充盈胃肠腔,可清晰显示胃壁结构、病变部位、大小、胃壁侵犯程度等,并能评估相邻淋巴结、组织及脏器转移情况[12]。本研究结果显示,FUS对TNM分期的诊断准确率稍高于实验室检查结果,但差异无统计学意义,原因可能为FUS可利用局部放大技术全面观察病灶,动态、实时评估血流灌注情况,有助于对疾病的准确诊断。但FUS仍存在漏误诊率,故需选择联合技术。本研究结果显示,FUS、MMP-7、MMP-9联合应用对TNM分期的诊断准确率均高于单一方法的应用,差异均有统计学意义(均P<0.05),分析原因为FUS能够利用造影剂观察病灶内部和周围的灌注、微循环情况,更清晰地显示病灶轮廓与浸润程度[13]。ROC曲线分析显示,FUS、MMP-7、MMP-9联合应用诊断TNM分期的AUC分别为0.993、0.993、0.948,均高于三者单独应用(均P<0.05),说明FUS、MMP-7、MMP-9联合应用不仅能够定位病变位置,还可预测肿瘤转移、浸润等情况,为临床分期提供科学依据。血清学检测虽具有依从性好、检测时间短、费用低、取材方便等优势,但应用单一指标无法准确定位病变位置,而FUS单独应用会因脂肪层较多、胃壁浆膜层高回声与邻近组织难区别等因素出现误诊,故将两者联合应用能起到互补作用,为临床提供新的诊断和评估方向。与文献[14]报道结论一致。
综上所述,FUS联合MMP-7、MMP-9能够提高对胃癌浸润、转移等情况的诊断准确率,在胃癌分期评估中具有较好价值。但本研究样本量较少,今后需扩大样本量进一步分析。

