超声造影联合微血管成像诊断腹部实质脏器活动性出血的实验研究
韩 鹏 梁舒媛 朱连华 姜 波 费 翔
创伤是致人类死亡的第三大原因,其发病率逐年增加[1]。致伤因素以交通事故和暴力事件为主[2],此外,战伤所致的闭合性损伤伴活动性出血则为战场死亡的首要因素[3]。当腹部实质脏器创伤伴活动性出血时,不仅会影响创伤分级和非手术治疗的成功率,还会引起患者出现各种并发症[4]。因此,准确、快速诊断腹部实质脏器损伤有无活动性出血并明确其位置,对指导实质脏器创伤的治疗和降低腹部外伤的死亡率具有重要意义。超声造影(contrast-enhanced ultrasound,CEUS)诊断腹腔实质脏器创伤的准确率较高,但其对于明确活动性出血的具体部位、出血灶数量、破损血管的位置仍存在不足[5]。微血管成像(micro-flow imaging,MFI)是近年新兴的一种多普勒超声成像技术,其对低速血流更敏感且不会对造影剂微泡造成破坏,故将其与对血流灌注敏感的CEUS联合应用(以下简称联合成像),可提高显示更微小、更低速血管的能力[6]。目前,该技术已被应用于评价肝脏肿瘤内血管分布特征,但未见实质脏器活动性出血方面的报道。本实验通过建立体外活动性出血模型,探讨联合成像在诊断活动性出血及判断其位置中的应用价值。
材料与方法
一、主要实验试剂与仪器
1.试剂:造影剂使用意大利Bracco公司生产的声诺维(SonoVue),主要成分为六氟化硫微泡,加入5.0 ml生理盐水振荡均匀配制成悬浊液备用。
2.仪器:使用Philips EPIQ 7彩色多普勒超声诊断仪,C5-1凸阵探头,频率1~5 MHz;超声造影采用对比脉冲序列成像技术,机械指数0.05~0.07。注射泵使用迈瑞公司生产的BeneFusion SP5的注射泵。
二、实验方法
1.水槽配置:按照成人推荐剂量0.03 ml/kg,将0.4 ml SonoVue悬浊液加入盛有1050 ml生理盐水的水槽内,从水槽内抽取50 ml溶液至注射泵内,以确保水槽和注射泵内造影剂浓度相同。
2.体外活动性出血水槽模型的建立:使用硅胶管(内径分别为0.5 mm、1.0 mm)模拟人工血管,将其固定于盛有生理盐水的水槽内,生理盐水深度10 cm,人工血管距水槽底部5 cm。向水槽内注入造影剂以模拟实质脏器造影剂灌注增强后的声像图。于血管游离端正上方3 cm处固定超声探头,探头长轴与血管平行。经注射泵注入造影剂并控制流量,注射器内置与水槽内等浓度的造影剂。为确保水槽内造影剂浓度在实验过程中保持相对稳定,每次更换人工血管前需更换水槽内液体。见图1。
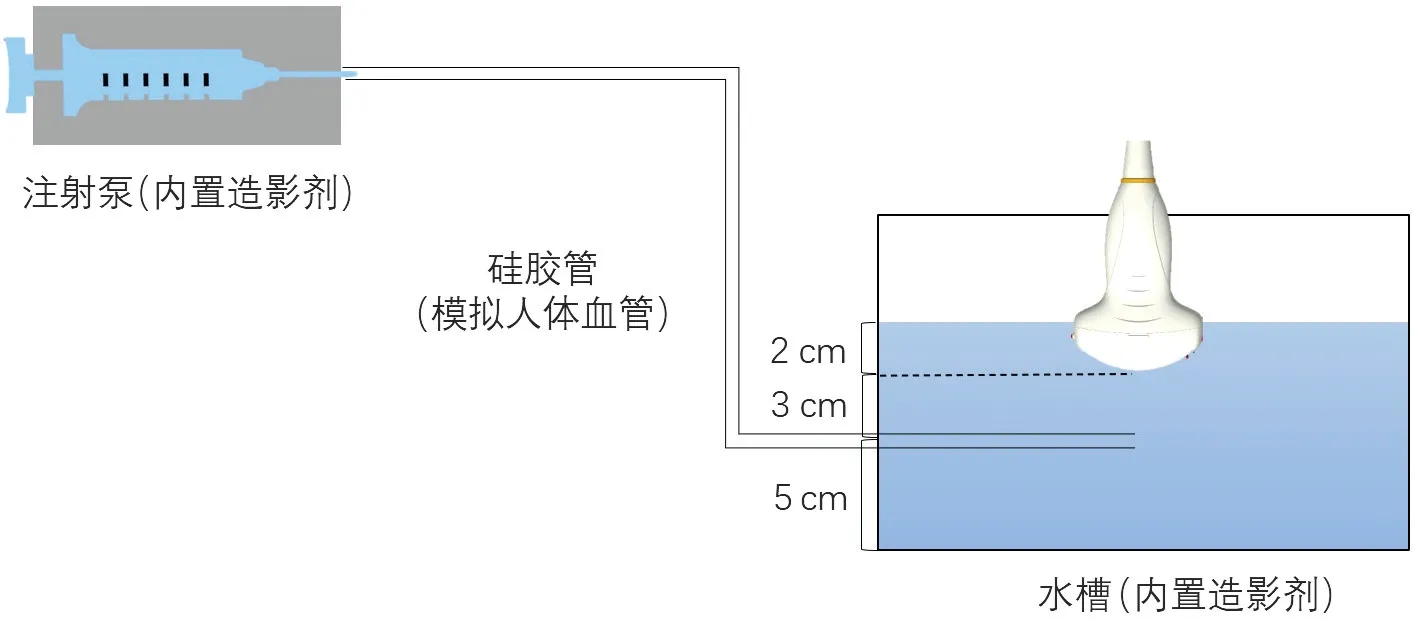
图1 体外活动性出血水槽模型建立示意图
3.体外活动性出血组织损伤模型的建立:选取重量400~800 g新鲜离体猪肝,将其固定于实验平台,使用小型撞击器于肝脏右叶厚度>2 cm的区域建立一处闭合型创伤。使用硅胶管模拟血管(内径分别为0.5 mm、1.0 mm),经超声引导下将血管游离端置入肝脏创伤区,经注射泵注入造影剂并控制流量。为确保肝脏内创伤灶在实验过程中无明显差异,每次更换人工血管前需更换肝脏模型。见图2。
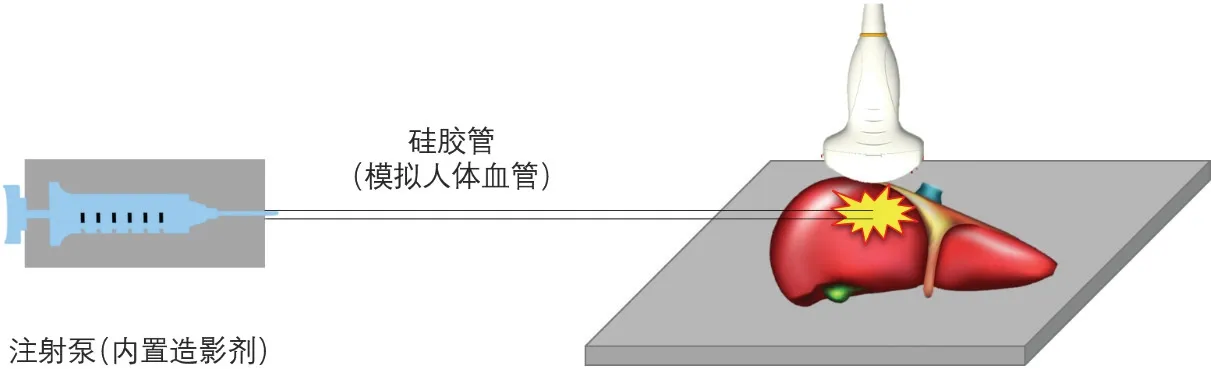
图2 体外活动性出血组织损伤模型建立示意图
4.图像采集与分析:两种活动性出血模型中,每根人工血管的流量均为5~100 ml/h,每次增加5 ml/h,共20种流量。开启注射泵,分别启动超声造影与联合成像观察并存储动态图像(时间≥30 s),同时记录人工血管管径、推注流量。由两名具有8年以上腹部超声造影工作经验的医师采用盲法独立完成图像分析,当判读结果不一致时共同协商。
5.两种方法诊断与定位活动性出血的标准[7]:①水槽模型中超声造影显示血管周边造影剂异常流动诊断为活动性出血,可见血管游离端并于其周围见造影剂异常流动定位为活动性出血;联合成像显示血管周边异常血流信号诊断为活动性出血,可见血管游离端并于其周围见异常血流信号定位为活动性出血。②组织损伤模型中超声造影于创伤灶内显示造影剂聚集诊断为活动性出血,于创伤灶内见血管游离端并于其周围见造影剂聚集定位为活动性出血;联合成像于创伤灶内见异常血流信号诊断为活动性出血,于创伤灶内见血管游离端并于其周围见异常血流信号定位为活动性出血。
三、统计学处理
应用SPSS 24.0统计软件,计数资料以例或率表示,行χ2检验。P<0.05为差异有统计学意义。
结 果
一、CEUS与联合成像对水槽模型活动性出血的诊断及定位
水槽模型中,CEUS未能诊断活动性出血;联合成像诊断和定位活动性出血的准确率均为62.50%(25/40)。联合成像模式下,0.5 mm与1.0 mm内径间的诊断准确率分别为85.00%(17/20)和40.00%(8/20),差异有统计学意义(χ2=8.640,P=0.03)。见表1。

表1 CEUS与联合成像对水槽模型中内径0.5 mm、1.0 mm活动性出血的诊断及定位情况
二、CEUS与联合成像对组织损伤模型活动性出血的诊断及定位
组织损伤模型中,CEUS诊断和定位活动性出血的准确率分别为77.50%(31/40)和62.50%(25/40),差异有统计学意义(χ2=19.355,P=0.000);联合成像诊断和定位活动性出血的准确率均为90.00%(36/40),均高于CEUS,差异均有统计学意义(χ2=15.309、7.407,P=0.000、0.006)。联合成像模式下,0.5 mm与1.0 mm内径间的诊断准确率均为90.00%(18/20),差异无统计学意义。见表2,3。

表2 CEUS与联合成像对组织损伤模型活动性出血诊断及定位情况 例
三、联合成像对水槽模型与组织损伤模型活动性出血定位的准确率
联合成像在水槽模型与组织损伤模型中定位活动性出血的准确率分别为62.50%(25/40)、90.00%(36/40),差异有统计学意义(χ2=7.407,P=0.006)。见图3,4。
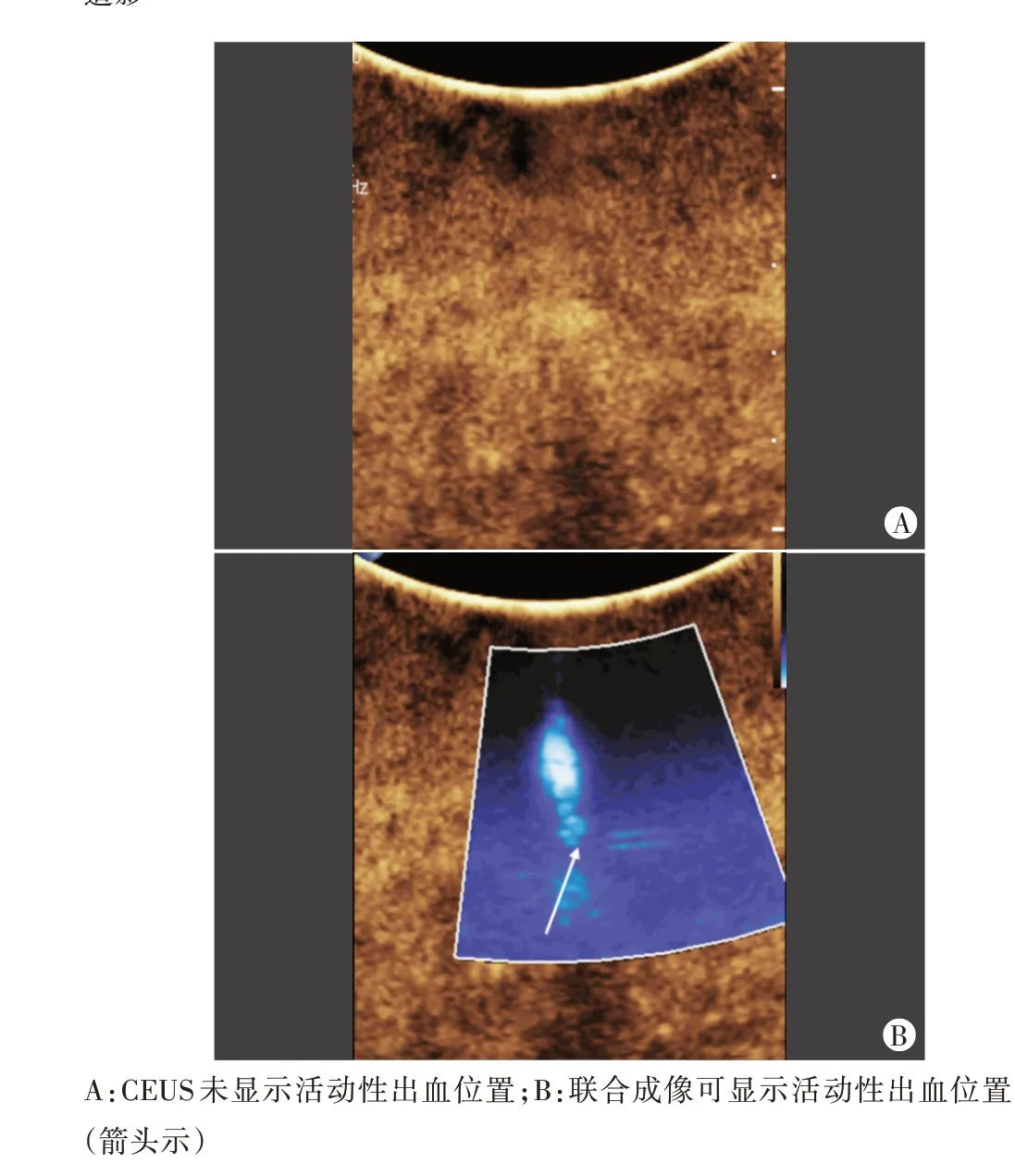
图3 CEUS与联合成像观察水槽模型活动性出血的位置

表3 CEUS与联合成像对组织损伤模型中内径0.5 mm、1.0 mm活动性出血的诊断及定位情况
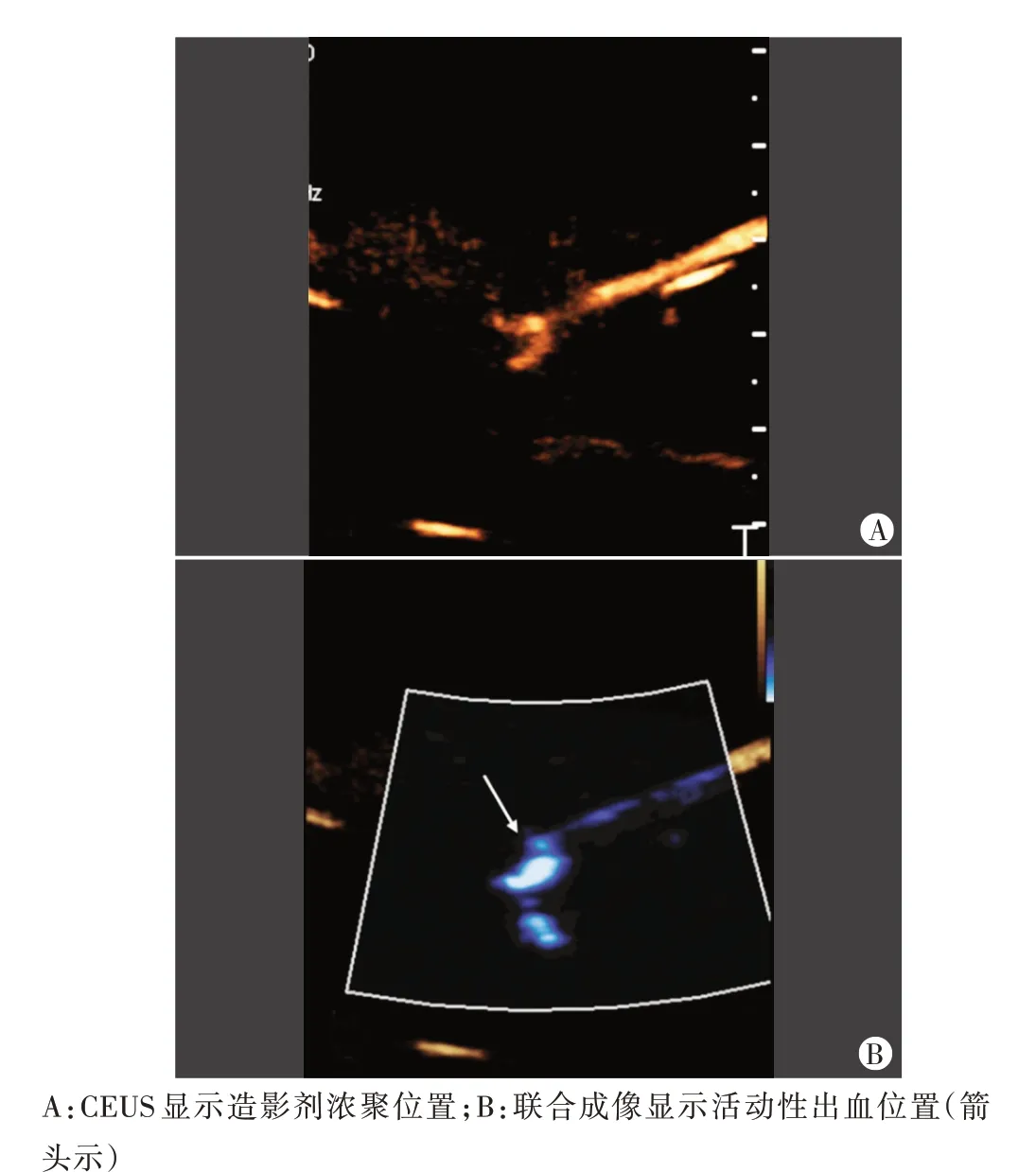
图4 CEUS与联合成像观察组织损伤模型活动性出血的位置
讨 论
腹部实质脏器外伤后准确发现活动性出血并明确其位置是选择治疗方式和评估疗效的关键。CEUS虽对创伤有较好的诊断价值,但对活动性出血的诊断能力有限[8]。近年来,随着微创外科和医学影像技术的发展,腹部实质脏器创伤的治疗方法逐渐向非手术微创治疗方向转变。目前,腹部实质脏器创伤的非手术治疗率已达65%~90%[9],但CEUS诊断活动性出血时主要通过造影剂浓聚或喷射等间接征象推测出血部位,并以上述间接征象消失作为初步判断治疗是否成功的标准,诊断及治疗过程中均缺乏对血管破损位置的直观信息,以及破损血管止凝血的直接证据。Menichini等[10]研究表明,CEUS在钝性腹部创伤中最大的局限是对活动性出血的检测准确性低,对破损血管的定位能力差。若未及时、准确判断有无活动性出血可能会低估美国创伤外科协会创伤分级,同时无法准确定位破损血管也将加大微创手术治疗难度[11]。因此,准确定位活动性出血对临床治疗具有重要意义。
CEUS后由于活动性出血的造影剂外溢及正常脏器实质的灌注均可出现造影剂增强,当增强程度相似且创伤实质脏器周围无积液时,出血与实质二者间难以鉴别,易发生漏诊[12]。本实验考虑到这一情况,在水槽内盛有与注射泵中相同浓度的造影剂模拟脏器实质的增强,这与以往研究[7]有所不同。此时,CEUS下活动性出血的造影剂溢出与水槽内液体背景的增强程度一致,无法显示破损血管及出血部位。本实验结果也表明,CEUS在水槽模型中未能诊断活动性出血。在临床实际情况下,行CEUS检查前通常不了解脏器损伤的具体部位,因此多采用CEUS对创伤区域进行定位,而此时脏器已有均匀强化,与本实验水槽模型模拟的情况更为接近。本实验组织损伤模型通过建立肝脏损伤模型来模拟受损组织对于出血的压迫、包裹和出血形态的改变,在一定程度上会干扰活动性出血的定位。实验结果也表明CEUS对活动性出血的定位能力(62.50%)低于诊断能力(77.50%),原因可能是创伤灶内的造影剂溢出后,沿受损的组织间隙流失或在创伤灶内聚集。当造影剂流失时无法发现活动性出血,当造影剂聚集呈高增强时,虽可诊断活动性出血,但无法明确具体的破损血管及出血部位;仅当出血速度较快,造影剂呈喷射样溢出时,才能在诊断活动性出血的同时定位破损血管的出血部位。
MFI可以抑制组织运动引起的低速杂波,提高空间分辨率,增强血管的可视化,减低信噪比,更好地检出低速血流和低速小血管的走行[6]。另外,该技术在使用过程中机械指数较低(0.07~0.08),避免了对造影剂微泡造成破坏,将其与CEUS联合使用能进一步提高检测微小血管走行及低速血流的能力。本实验结果发现,联合成像对水槽与组织损伤模型诊断和定位活动性出血的能力相同,其准确率分别为62.50%、90.00%,均高于CEUS单独应用,差异均有统计学意义(均P<0.05),证实联合成像较CEUS能更敏感地判断有无活动性出血,且明确出血位置的能力优于CEUS。
本实验结果显示,水槽模型中,联合成像诊断0.5 mm内径活动性出血的准确率高于1.0 mm内径的准确率,差异有统计学意义(P<0.05)。分析原因可能为MFI技术是通过检测多普勒频移的变化进行成像,当人工血管的流量在相同范围内时,较粗的血管内流速相对较慢,导致血流频移信号的减弱,故MFI的诊断准确率有所降低。另外,在相同内径条件下,CEUS和联合成像在组织损伤模型中诊断和定位活动性出血的诊断准确率均高于水槽模型,表明MFI虽能避免背景中造影剂增强对出血部位的掩盖,但仍会受到一定程度的影响,导致诊断准确率下降。
本实验局限性:①本实验为体外实验,无法模拟人体存在活动性出血后继发的血压、呼吸、心率等因素的影响,其诊断能力有待进一步动物实验和临床验证;②体内情况下,血管断端通常不可见,故本实验方法并不能完全反映临床真实情况,有待今后进一步分析;③水槽模型尚不能模拟动脉相造影剂的灌注及延迟相造影剂的廓清过程,仅模拟了实质均匀灌注后的增强晚期图像,即血管和背景均呈等增强,可能会低估CEUS对活动性出血的诊断能力。
综上所述,相较于CEUS,联合成像不仅提高了诊断活动性出血的准确率,其对活动性出血位置的判断能力亦更佳,为今后相关动物实验和临床研究提供了一定的理论依据。

