经直肠三维超声在直肠癌新辅助放化疗后病理完全缓解评估中的价值
金 鑫 陈 东 陈海涛 张映贤 钏志睿 罗晓茂
结直肠癌是消化道常见恶性肿瘤之一,其病死率和发病率逐年上升,其中直肠癌约占结直肠癌的57.2%[1]。对于局部晚期直肠癌而言,国际临床实践指南推荐预先使用新辅助放化疗(NCRT)后全直肠系膜切除术伴或不伴术后辅助化疗作为其标准治疗方案[2]。约10%~38%的直肠癌患者NCRT后能达到病理完全缓解(pCR)[3]。研究[4]认为,对于NCRT后影像学判断为pCR者,可以选择继续等待观察法,以提高患者的生存质量。因此,评估直肠癌患者NCRT后是否达到pCR,对临床制定系统治疗方案和选择手术方案均有重要作用。本研究旨在探讨经直肠三维超声(3D-ERUS)在NCRT后局部晚期直肠癌pCR评估中的应用价值。
资料与方法
一、研究对象
选取2019年1月至2020年1月我院收治的晚期直肠癌患者98例,均符合以下标准:①术前经肠镜活检确诊为直肠癌;②术前均行直肠癌NCRT;③均于首次入院后1周内和NCRT后术前1周内行3DERUS检查,且检查数据完整;④无远处转移或合并其他原发恶性肿瘤。排除标准:①放化疗前后肠腔出现严重狭窄的患者;②孕妇及哺乳期妇女。98例患者根据Ryan肿瘤退缩分级法[5]分为病理完全缓解组(pCR组,0级)和非病理完全缓解组(non-pCR组,1~3级),pCR组20例,其中男12例,女8例,年龄36~74岁,平均(56.7±10.1)岁;non-pCR组78例,其中男47例,女31例,年龄25~80岁,平均(54.6±11.9)岁。术后病理T分期结果:T0期20例,T1期5例,T2期26例,T3期24例,T4期23例。术后病理肿瘤退缩分级结果:0级20例,1级21例,2级34例,3级23例。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.仪器:使用BK Medical 2202彩色多普勒超声诊断仪,8848型经直肠端式腔内探头,频率4~12 MHz;8838型经直肠3D线阵腔内探头,频率4~16 MHz;配备360°自动扫查马达。
2.3 D-ERUS检查:患者检查前1~2 d进流质食物,检查前1~2 h清洁灌肠。取左侧卧位,充分暴露肛门,使用一次性注射器经肛门向直肠内灌注入50 ml医用消毒耦合剂,将8848型经直肠端式腔内探头表面涂少量耦合剂并套上乳胶套,缓慢推进肛门探查,确定肿瘤位置和范围,随后将探头推入所能显示部分最深处,全面探查肠周淋巴结,记录其数目和大小。然后使用8838型经直肠3D线阵腔内探头进入直肠内探查,将探头顶端置于肿瘤处,测量肿瘤累及长径、累及最厚径、肿瘤距肛缘的距离,观察肿瘤浸润肠壁的层次结构、累及肠外组织和邻近器官结构及可疑淋巴结的大小和数目,对血流信号进行Alder分级[6],所有数据均测量3次取平均值。然后稳定探头2 min进行多方位、多角度扫查,从与人体长轴垂直的标准横切面观察肿瘤累及肠圈的范围,并核对上述参数测值,所有操作均由两名具有5年以上胃肠超声检查经验的医师使用盲法完成。
使用相同方法分别于首次入院1周内及NCRT后术前1周内行3D-ERUS检查,两次超声检测结果记为ERUS 1和ERUS 2,计算NCRT前后上述各参数的变化率,具体公式为:变化率=(ERUS 1-ERUS 2)/ERUS 1×100%。
三、统计学处理
应用SPSS 17.0统计软件,计量资料以±s或M(P25,P75)表示,组间比较行t检验或配对样本Wilcoxon秩和检验。相关性分析采用Spearman相关分析法。绘制受试者工作特征(ROC)曲线分析各参数评估NCRT后pCR的价值,计算曲线下面积(AUC)。P<0.05为差异有统计学意义。
结 果
一、化疗前后3D-ERUS参数比较
NCRT后pCR组与non-PCR组肿瘤累及长径、累及最厚径、累及肠圈比较差异均有统计学意义(均P<0.05),肿瘤累及长径变化率、累及最厚径变化率、累及肠圈变化率和血流分级变化率比较差异均有统计学意义(均P<0.05),见图1和表1,2。

图1 pCR组NCRT前后3D-ERUS图
表1 NCRT前后pCR组与non-pCR组3D-ERUS参数比较(±s)
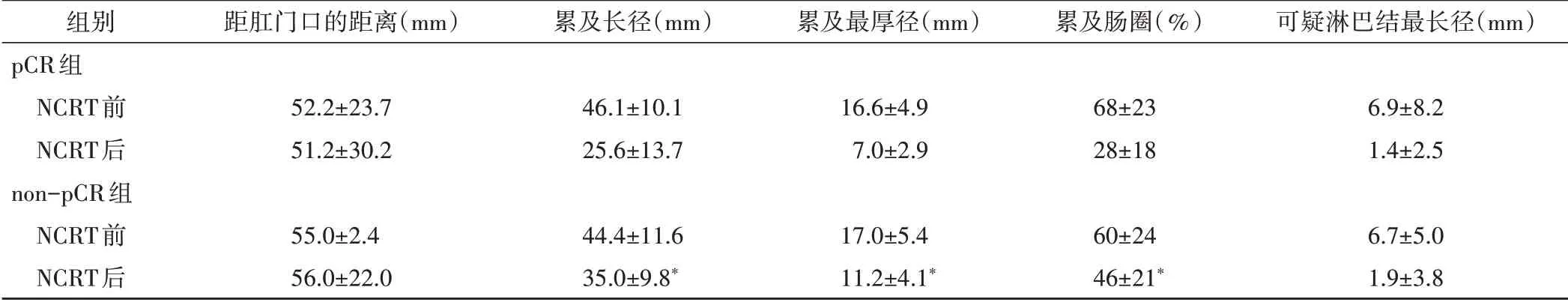
表1 NCRT前后pCR组与non-pCR组3D-ERUS参数比较(±s)
与pCR组NCRT后比较,*P<0.05
组别pCR组NCRT前NCRT后non-pCR组NCRT前NCRT后距肛门口的距离(mm)52.2±23.7 51.2±30.2 55.0±2.4 56.0±22.0累及长径(mm)46.1±10.1 25.6±13.7 44.4±11.6 35.0±9.8*累及最厚径(mm)16.6±4.9 7.0±2.9 17.0±5.4 11.2±4.1*累及肠圈(%)68±23 28±18 60±24 46±21*可疑淋巴结最长径(mm)6.9±8.2 1.4±2.5 6.7±5.0 1.9±3.8
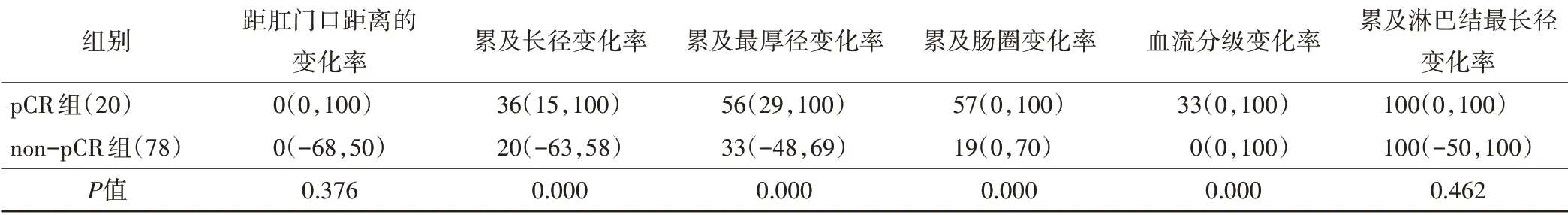
表2 NCRT后pCR组与non-pCR组3D-ERUS参数变化率比较[M(P25,P75)]%
二、相关性分析
相关性分析显示,NCRT后肿瘤累及长径、累及最厚径、累及肠圈与肿瘤退缩分级均呈正相关(r=0.336、0.403、0.339,均P<0.05),累及长径变化率、累及最厚径变化率、累及肠圈变化率、血流分级变化率与肿瘤退缩分级均呈负相关(r=-0.407、-0.435、-0.408、-0.235,均P<0.05)。
三、ROC曲线分析
ROC曲线分析显示,累及长径变化率的截断值为29%,其敏感性、特异性、准确率分别为70.0%、76.9%、75.5%,AUC为0.791;累及最厚径变化率的截断值为44%,其敏感性、特异性、准确率分别为80.0%、76.9%、77.6%,AUC为0.824;累及肠圈变化率的截断值为33%,其敏感性、特异性、准确率分别为70.0%、79.5%、77.6%,AUC为0.782;血流分级变化率的截断值为0,其敏感性、特异性、准确率分别为70.0%、57.7%、60.2%,AUC为0.653。见图2和表3。
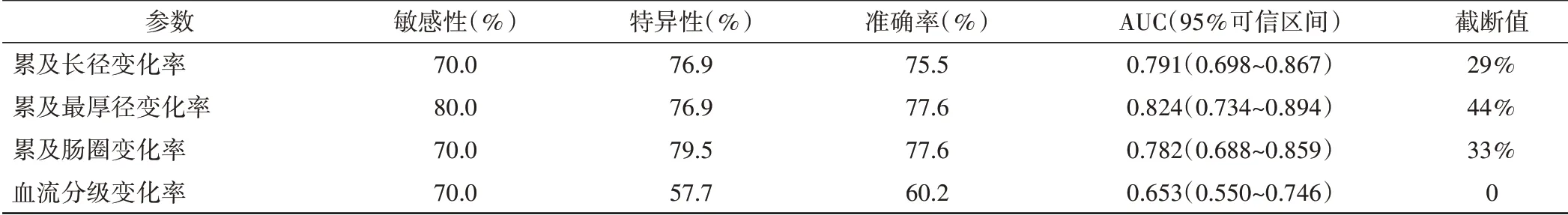
表3 3D-ERUS参数变化率评估局部晚期直肠癌NCRT后pCR的价值
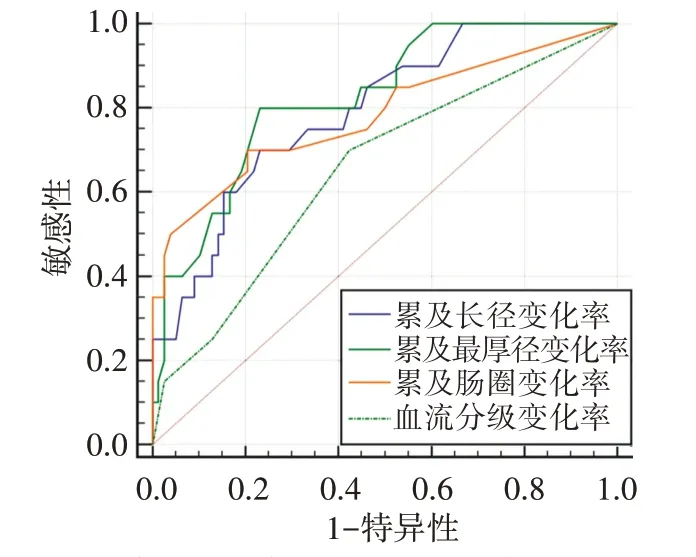
图2 3D-ERUS参数变化率评估局部晚期直肠瘤NCRT后pCR的ROC曲线图
讨 论
目前,局部晚期直肠癌的最主要治疗手段是NCRT后行经全直肠系膜切除术。Skóra等[7]分析了短程放疗联合手术及术后辅助化疗患者的生存率,中位随访时间为57个月,10例达到pCR患者的5年总生存率为66.4%,无瘤生存率为67.2%,局部无复发生存率为91.7%,无远处转移生存率为71.5%,表明NCRT可以有效延长局部晚期直肠癌患者的生存时间。因此,如何准确判断NCRT疗效是临床研究的热点和难点。
与二维超声比较,3D-ERUS具有简便、快速、安全、实时动态、重复性好的优点,不仅可以清晰显示直肠壁的结构层次,还可以多角度、多切面地清晰显示与直肠邻近组织脏器之间的关系,通过三维重建获得三维立体模块,从而提高诊断准确率[8]。3D-ERUS能测量肿瘤累及肠圈,可更准确地鉴别黏膜下小病变与pCR。本研究结果显示,NCRT后3D-ERUS测量的肿瘤累及长径和累及最厚径均较NCRT前明显缩小,表明NCRT对局部晚期直肠癌有效,肿瘤在NCRT后明显退缩,3D-ERUS能准确评估肿瘤的形态变化。
本研究结果显示,NCRT后肿瘤累及长径、累及最厚径、累及长径变化率、累及最厚径变化率与肿瘤退缩分级均相关(均P<0.05);ROC曲线分析显示,累及长径变化率>29%、累及最厚径变化率>44%、累及肠圈变化率>33%、血流分级变化率>0均能有效预测直肠癌NCRT后pCR,与陈丽梅等[9]研究结论存在一定差异。分析原因为:本研究增加了更多的超声因素,除累及长径变化率和累及最厚径变化率外,NCRT后累及肠圈和可疑淋巴结最长径均较NCRT前明显缩小,而累及肠圈变化率和血流分级变化率也与肿瘤退缩分级存在相关性。此外,本研究98例患者均行标准NCRT方案,使肿瘤细胞变性和坏死,原始的肿瘤细胞被炎性细胞和纤维组织的增生所取代,从而改变了肿瘤的生物力学特性。3D-ERUS可有效观察NCRT后直肠癌的细微变化,在预测NCRT后是否达到pCR具有一定作用。
本研究局限性:①本研究为单中心回顾性研究,样本量较小,今后需进一步行更大样本量的多中心及前瞻性研究;②超声图像的质量取决于操作者的经验,影像学判断及测量可能存在一定的主观性;③仅观察了肿瘤NCRT前后的形态学改变,未评估其血流灌注变化,今后可联合超声弹性成像、超声造影等技术进一步分析。
综上所述,3D-ERUS在局部晚期直肠癌NCRT后pCR评估中具有重要价值,今后有望联合更多新技术为局部晚期直肠癌的个体化诊疗提供更可靠的评估依据。

