microRNA-34a/沉默信息调节因子1通路参与新生大鼠坏死性小肠结肠炎的发生
林 妍,朱 慧
坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是一种新生儿时期常见的肠道炎性疾病,病死率高达23%~30%,严重威胁新生儿生命。但目前NEC的发病机制仍未完全明了,治疗手段也有限,若病情进入进展期,则预后较差,25%经手术治疗的患儿存在胃肠道长期后遗症[1]。故亟待探讨NEC的相关发病机制及影响因素以提升临床诊疗效果。
microRNA(miRNA)是一类含有19~25个核苷酸的内源性非编码单链RNA分子,在人类或大鼠、小鼠等动物体内稳定表达,可调控相应的靶基因,参与疾病的发生、发展,已被证实是多种疾病的重要生物检测标志[2-3]。研究证实,miR-222、miR-223、miR-451a、miR-27a、miR-187等与NEC的关系密切[4-6],提示miR可能参与NEC发病的调控。沉默信息调节因子1(silent information regulator 1,SIRT1)为烟酰胺腺嘌呤二核苷酸依赖的脱乙酰化酶,可抑制炎症反应、参与细胞周期调控、抑制细胞凋亡[7]。研究表明,SIRT1参与了NEC的发病过程,且在NEC中呈低表达状态[8-11]。已证实SIRT1是miR-34a的靶向位点之一[12-14],该通路与多种疾病的发生相关[15-17]。因此,SIRT1是否由miR-34a调控而参与NEC的发病,该通路的具体作用机制是什么,需进一步探究。本研究以新生SD大鼠为研究对象,构建NEC动物模型,旨在探究miR-34a、SIRT1与NEC的关系,为阐明NEC的发病机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 动物及分组 出生2 h内未开奶的无特定病原体的新生SD大鼠40只,雌雄不限,体质量5.6~8.5 g[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005]。随机分为5组,对照组(A组)8只,实验组32只(又分为4组,分别为B~E组,其中B组为NEC模型组,C组为NEC模型+miR-34a干扰片段组,D组为NEC模型+SIRT1激动剂组,E组为NEC模型+miR-34a干扰片段+SIRT1抑制剂组,n=8)。A组:与代母鼠同笼鼠乳喂养。B~E组参照既往文献并适当改良建立NEC模型[18],将大鼠放入连接氮气的玻璃瓶中,待氮气充满瓶子60 s后取出大鼠,立即放于4 ℃下冷刺激10 min,2次/d,连续3 d。C~E组给予相应药物溶于生理盐水后进行尾静脉注射,A~B组给予等体积生理盐水尾静脉注射,1次/d,连续5 d。当出现明显临床症状(如严重腹胀、血便和紫绀)时或于建模后第6天行颈椎脱臼处死大鼠,观察各组大鼠的一般情况,根据实验需求取肠管及血液标本进行研究。
1.1.2 主要试剂及仪器 SIRT1激动剂(SRT 1720 Hydrochloride)及SIRT1抑制剂(Nicotinamide)(广州柏赛柯生物技术有限公司);miR-34a干扰片段(miR-34a inhibitors)(重庆市尚亚生物有限公司)。实时荧光定量PCR仪(Roche480,瑞士Roche公司);凝胶成像系统(JS-2012,上海培清科技有限公司)。
1.2 方法
1.2.1 肠组织病理学检查方法 大鼠处死后,取回肠远端5 cm肠管,用冷生理盐水冲洗并清除肠内容物后,置于10%中性福尔马林固定24~48 h,脱水、包埋、连续切片(4~5 μm)、苏木精-伊红(hematoxylin eosin,H-E)染色、中性树胶封固。病理评分参考文献中的计分标准[19]:0分,肠黏膜绒毛完整,组织结构正常;1分,轻度黏膜肌层和(或)黏膜下层与固有层分离;2分,中度黏膜肌层和(或)黏膜下层与固有层分离,黏膜下层或肌层水肿;3分,重度黏膜肌层和(或)黏膜下层与固有层分离,黏膜下层或肌层水肿,局部绒毛脱落;4分,肠黏膜绒毛消失伴肠坏死。双盲法计分,病理评分≥2分者视为发生NEC。
1.2.2 肠组织miR-34α、SIRT1的mRNA表达测定 采取实时荧光定量逆转录聚合酶链反应(real-time quantitative reverse transcription-polymerase chain reaction,qRT-PCR)进行检测。取各组冻存的肠组织标本,加入NucleoZol试剂提取总RNA,其中miR-34α需加入miR-34a颈环结构(反转录引物)以延长序列。反转录得到cDNA。分别以U6、GAPDH为内参,将cDNA稀释后加入引物,配成体系行PCR反应。反应条件:95 ℃预变性5 min,95 ℃变性10 s→60 ℃退火30 s→72 ℃延伸30 s,循环40次。反应结束后采用ΔΔCt方法对各组目的基因进行相对定量分析。相关引物由重庆市尚亚生物有限公司设计合成。
miR-34a:
上游:5′-CGCGTGGCAGTGTCTTAGCT-3′
下游:5′-AGTGCAGGGTCCGAGGTATT-3′
反转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACC-3′
内参U6:
上游:5′-CTCGCTTCGGCAGCACATATACT-3′
下游:5′-ACGCTTCACGAATTTGCGTGTC-3′
SIRT1:
上游:5′-GCTGTGGACTTCCCGGATCT-3′
下游:5′-AACAGAGCTGCTCATGAATGC-3′
内参GAPDH:
上游:5′-AGTGCCAGCCTCGTCTCATA-3′
下游:5′-GGTAACCAGGCGTCCGATAC-3′
1.2.3 肠管组织中SIRT1、炎症细胞因子的蛋白表达测定 采用免疫印迹实验(Western-blot)检测SIRT1以及包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-8、IL-10在内的炎症细胞因子的蛋白量。加入含PMSF的蛋白裂解液,提取总蛋白,用BCA蛋白测定法检测各个样品总蛋白浓度,经电泳分离、转印、封闭后,将膜放入装有稀释的鼠一抗的杂交盒中(其中IL-1β的一抗按1∶10 000稀释,余实验中的一抗按1∶1 000稀释),4 ℃孵育过夜,再放入1∶5 000稀释的鼠二抗杂交盒中,室温孵育2 h,采用凝胶成像系统检测发光,收集条带图像,以β-actin为内参,分析条带灰度值。
1.2.4 血清中炎症细胞因子及氧化应激因子的浓度测定 采用ELISA对炎症细胞因子(TNF-α、IL-1β、IL-6、IL-8、IL-10),以及包括单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde, MDA)在内的氧化应激因子进行浓度测定。抽取各组大鼠静脉血2 mL,3 500 r/min离心后吸取上清,置于-20 ℃冰箱保存,再根据各个试剂盒的说明书进行浓度测定。
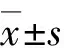
2 结 果
2.1 一般情况与生长发育 实验组大鼠24 h内均存活,48 h内存活29只(90.6%),72 h内存活 25只(78.1%),对照组均存活。对照组大鼠进食及活动正常,大便性状正常,对刺激反应良好。实验组大鼠在建模过程中均出现不同程度的进食量下降、活动减少、腹部膨隆、排便异常等表现。
2.2 NEC模型建设情况及肠管组织H-E染色结果 各组H-E染色结果显示:A组肠黏膜绒毛完整,组织结构大致正常,病理评分(0.25±0.46)分。B组大量肠黏膜绒毛脱落、消失,重度黏膜肌层和黏膜下层与固有层分离,间质崩解,损伤最严重,病理评分(3.88±0.35)分,显著高于A组(P<0.001)。C、D组病理评分均为(2.25±0.46)分,较B组降低(P<0.001),可见轻中度黏膜肌层和(或)黏膜下层与固有层分离,组织损伤均较B组减轻;E组病理评分(3.13±0.35)分,较 C组高(P<0.001),部分肠黏膜绒毛脱落,中重度黏膜肌层和黏膜下层与固有层分离,组织损伤较C组更严重(图1)。

A:A组(对照组),肠黏膜绒毛完整,组织结构大致正常;B:B组(NEC模型组),肠黏膜绒毛脱落、消失,重度黏膜肌层和黏膜下层与固有层分离;C:C组(NEC模型+miR-34a干扰片段组),轻中度黏膜肌层和(或)黏膜下层与固有层分离;D:D组(NEC模型+SIRT1激动剂组),轻中度黏膜肌层和(或)黏膜下层与固有层分离;E:E组(NEC模型+miR-34a干扰片段+SIRT1抑制剂组),肠黏膜绒毛脱落,中重度黏膜肌层和黏膜下层与固有层分离。
2.3 肠管组织中miR-34a、SIRT1的mRNA相对表达情况 与A组比较,B组中的miR-34a表达增加(P<0.001)、SIRT1 mRNA表达减少(P<0.001);C、D组分别与B组比较显示,使用miR-34a干扰片段或SIRT1激动剂后均可使miR-34a的表达显著减少(P<0.001),SIRT1 mRNA的表达明显增加(P<0.05);E组与C组比较显示,使用SIRT1抑制剂后SIRT1 mRNA的表达相对减少(P<0.05),miR-34a的表达相对增加(P<0.01,图2)。

miR-34a:microRNA-34a;SIRT1:沉默信息调节因子1。A组:对照组;B组:NEC模型组;C组:NEC模型+miR-34a干扰片段组;D组:NEC模型+SIRT1激动剂组;E组:NEC模型+miR-34a干扰片段+SIRT1抑制剂组。A:miR-34a;B:SIRT1 mRNA。☆:P<0.05,☆☆:P<0.01,☆☆☆:P<0.001。
2.4 肠管组织中SIRT1、炎症细胞因子的蛋白表达情况 肠管组织中SIRT1的蛋白表达情况与其mRNA的表达意义一致,且差别有统计学意义(P<0.05)。B组的TNF-α、IL-1β、IL-6、IL-8蛋白水平较A组显著增加(P<0.001),而IL-10蛋白水平较A组降低(P<0.001);C、D组分别与B组比较显示,使用miR-34a干扰片段或SIRT1激动剂后均可使TNF-α、IL-1β、IL-6、IL-8蛋白水平降低(P<0.05),而IL-10蛋白水平增加(P<0.01);E组与C组比较显示,使用SIRT1抑制剂可使TNF-α、IL-1β、IL-6、IL-8蛋白水平增加(P<0.05),而IL-10蛋白水平降低(P<0.01,图3)。
SIRT1:沉默信息调节因子1;TNF-α:肿瘤坏死因子-α;IL:白细胞介素;β-actin:β-肌动蛋白(内参)。A组:对照组;B组:NEC模型组;C组:NEC模型+miR-34a干扰片段组;D组:NEC模型+SIRT1激动剂组;E组:NEC模型+miR-34a干扰片段+SIRT1抑制剂组。A:SIRT1蛋白;B:TNF-α蛋白;C:IL-1β蛋白;D:IL-6蛋白;E:IL-8蛋白;F:IL-10蛋白;G:各组Western-blot检测结果比较。☆☆:P<0.01,☆☆☆:P<0.001。
2.5 血清中炎症细胞因子及氧化应激相关因子的表达情况 血清中炎症细胞因子的表达情况与其在肠组织中蛋白的表达意义一致,且差别有统计学意义(P<0.05)。B组的MDA、MCP-1、VCAM-1浓度最高,SOD浓度最低。与A组比较,B组的MDA、MCP-1、VCAM-1浓度升高(P<0.05),SOD浓度降低(P<0.001);C、D组分别与B组比较显示,使用miR-34a干扰片段或SIRT1激动剂后,MDA、MCP-1、VCAM-1浓度降低(P<0.05),SOD浓度升高(P<0.01);E组与C组比较显示,使用SIRT1抑制剂后,血清中MDA、MCP-1、VCAM-1的浓度升高(P<0.05),SOD浓度降低(P<0.05,图4)。

IL:白细胞介素;TNF-α:肿瘤坏死因子-α;MCP-1:单核细胞趋化蛋白-1;VCAM-1:血管细胞黏附分子-1;SOD:超氧化物歧化酶;MDA:丙二醛。A组:对照组;B组:NEC模型组;C组:NEC模型+miR-34a干扰片段组;D组:NEC模型+SIRT1激动剂组;E组:NEC模型+miR-34a干扰片段+SIRT1抑制剂组。A、B:炎症细胞因子(IL-1β、TNF-α、IL-6、IL-8、IL-10)的浓度;C、D:氧化应激因子(MCP-1、VCAM-1、SOD、MDA)的浓度。☆:P<0.05,☆☆:P<0.01,☆☆☆:P<0.001。
3 讨 论
目前,大部分研究认为,NEC的发病是由多种因素综合作用所致,其中炎症反应被认为是关键因素[1]。本研究从炎症反应的角度出发,选取TNF-α、IL-1β、IL-6、IL-8、MDA、MCP-1等已被证实与肠道炎性疾病关系密切的炎性介质作为NEC炎症程度的观测指标[8,20-22],探讨NEC的发病机制。研究发现,参与癌症及多种疾病调控的信号通路miR-34a/SIRT1也可影响炎症介质的释放,与NEC的发病关系密切[15-17]。
本研究中的实验组在建模过程中出现了不同程度的食量下降、活动减少、排便异常等表现,模型组的肠道标本病理评分为(3.88±0.35)分,提示大鼠NEC模型造模成功,所检测的各种指标有代表意义。
SIRT1属于Ⅲ类组蛋白去乙酰化酶,可在大鼠及人体的各细胞、组织中稳定表达,已被证实可抑制相关炎症介质释放,以减轻炎性反应对机体造成的损伤[7,23-24]。本研究结果显示,SIRT1在NEC新生大鼠体内呈低表达状态,而使SIRT1表达水平增高可以使促炎因子(TNF-α、IL-1β、IL-6、IL-8)、促氧化因子(MDA、MCP-1、VCAM-1)的表达降低,而使抗炎因子(IL-10)、抗氧化因子(SOD)表达增加,从而使肠黏膜、肌层水肿减轻,肠黏膜绒毛脱落减少,病理评分降低。提示SIRT1的表达水平与NEC密切相关,SIRT1表达增加可能对减轻炎症反应及改善NEC肠组织损伤有一定作用,这与Bai等的研究结果一致[11]。
miRNA可影响细胞的增殖、分化和迁移,参与多种疾病的调控[25]。miR-34a作为目前国内外的研究热点,不仅被证实与肿瘤、骨关节疾病等关系密切[14-17],还与先天性巨结肠等肠道疾病有关[26]。本研究发现,miR-34a在NEC新生大鼠体内呈高表达状态,降低miR-34a的表达水平,可使NEC大鼠体内炎症应激反应减轻,组织损伤减轻,可见miR-34a是导致NEC炎症反应发生的重要因素。
本研究还发现,SIRT1激动剂不仅调控了下游的炎症因子的表达水平,还影响了SIRT1及miR-34a的表达水平,原因可能是SIRT1激动剂调控了下游炎症因子浓度,而下游炎症因子浓度的改变间接影响了SIRT1和miR-34a的表达水平。Huang等[27]发现,低浓度TNF-α处理的成骨细胞中SIRT1的蛋白表达较高浓度组增加,证实了炎症因子的浓度变化导致SIRT1表达变化的现象,但具体是通过何种机制进行调控,有待实验进一步探究。研究发现,IL-6水平发生变化会激发IL-6R/STAT3/miR-34a反馈环,从而导致miR-34a的表达变化[28],还有一项关于炎症反应与miR关系的研究也证实了IL-6、IL-8及IL-10等炎症因子可影响miR的表达[29],故SIRT1激动剂对miR-34a表达的影响很可能是通过调控炎症因子的浓度来实现的。
研究显示,miR-34a可与SIRT1的3′端不翻译区结合,抑制SIRT1的表达,从而影响肠上皮细胞氧化应激与细胞凋亡的调控,参与小肠缺血再灌注损伤的病理过程[14-15,24]。本研究发现,miR-34a干扰片段可上调SIRT1的表达水平,改善NEC大鼠肠组织损伤,当使用SIRT1抑制剂下调SIRT1的表达后,miR-34a干扰片段对NEC的修复作用也受抑制,证实miR-34a是通过调控SIRT1的表达参与NEC的发病。
本研究从炎症反应的角度出发,为NEC的发病机制提供了新的思路,但是上述结果系基于动物实验得出,且实验动物数量有限,其结论是否可用于临床,仍需要多中心、大样本量的人体临床实验进一步验证。
综上所述,miR-34a/SIRT1通路参与新生大鼠NEC的发生,机制可能是miR-34a下调SIRT1的表达,使促炎因子、促氧化因子释放增加,抗炎、抗氧化水平降低,激发炎症反应,从而导致NEC的发生发展。

