人脐带间充质干细胞对宫颈癌HeLa 细胞增殖和凋亡的影响及其作用机制
王 琛,田 君,程海玲
(河南大学淮河医院妇科,河南 开封 475000)
人脐带间充质干细胞(mesenchymal stem cells,MSCs)是源自中胚层的一种多潜能干细胞,具有体外易扩增、取材方便和容易导入外源基因等优点,因而被作为天然的基因和细胞治疗的种子来源,在组织工程和再生医学中均具有重要价值[1-2]。MSCs 本身有迁移特点,可向肿瘤组织趋化和迁移,是肿瘤靶向治疗理想载体,因而分析MSCs 对于肿瘤细胞生物学特征的影响十分必要[3]。宫颈癌作为妇科最常见的恶性肿瘤,其病死率位居妇科肿瘤的前列,且目前尚无特效疗法。有学者主张发挥MSCs 亚全能分化潜能,通过旁分泌机制,调控宫颈癌细胞生物学活性,为宫颈癌基因治疗开辟新道路[4-5]。然而,目前关于MSCs 对宫颈癌细胞增殖、凋亡的影响及内在机制的报道较少。本实验通过集落形成实验和凋亡分子蛋白检测等方法,分析MSCs 对宫颈癌HeLa 细胞增殖凋亡能力的影响,并探讨其相关机制,为MSCs 治疗宫颈癌提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人HeLa 细胞为本实验室保存。胎牛血清(fetal FBS)、DMEM 培养基和胰蛋白酶-EDTA 溶液(北京百奥莱博科技有限公司),RPMI 1640 培养基(北京索莱宝科技有限公司),细胞增殖及毒性检测试剂盒(cell counting kit-8,CCK-8)(广州研创生物技术发展有限公司),Annexin Ⅴ-FITC 细胞凋亡检测试剂盒(apoptosis Detection Kit)和碘化丙啶(propidine iodide,PI)(南京碧波生物科技有限公司),兔抗人B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)、半胱天冬氨酸蛋白酶3(cysteinyl aspartate-specific proteinase-3,Caspase-3)和P53 单克隆抗体(一抗)以及辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG(二抗)(上海碧云天生物技术有限公司),增强化学发光法(electrochemiluminescence,ECL)显色 试剂盒和Bradford 蛋白浓度测定试剂盒(北京百奥莱博科技有限公司)。Nunc EasYFlask 细胞培养瓶和细胞培养板(北京隆福佳生物科技有限公司),DxFLEX流式细胞仪(美国贝克曼库尔特公司)。
1.2 人脐带MSCs 分离和培养经家属知情同意后,采集足月新生儿脐带,并在6 h 内进入制备程序。无菌条件下剪碎脐带,体积控制在1 mm×1 mm×1 mm,以贴壁法培养脐带,即接种于内含专用培养基的培养瓶内,置于37 ℃、5%CO2饱和湿度的孵箱中培养,2~4 d 换液1 次,待有成纤维样细胞爬出后1~2 周,可去除组织块,获得MSCs细胞。取MSCs 细胞加入内含10%FBS 的DMEM培养基内,置于37 ℃、95%饱和湿度、5%CO2的培养箱内,48 h 后半量换液3 次,每隔2 d 换1 次,随后每隔3~5 d 换1 次。待原代培养细胞铺满瓶底,收集条件培养液分装,-80 ℃下保存、备用,应用0.25%的胰蛋白酶对细胞进行常规消化、传代,F4 代后细胞用于后续实验。倒置显微镜观察其细胞形态,在F5 代时,40 倍光学显微镜下观察细胞形态。待细胞融合度为80%~90%时,采用Triple 液消化,绝大部分细胞消化完全后,吸管吹打,转入离心管,4 ℃、1 000 r·min-1离心5 min,离心半径为10 cm,倾倒液体,采用流式细胞仪检测离心MSCs 细胞表面抗原标志物CD90、CD105、CD34 和CD45,即将收集的细胞与一抗CD90、CD105、CD34 和CD45 常温孵育0.5 h,与cy3-二抗孵育0.5 h,以未加一抗仅加二抗的MSCs 为平行对照组。
1.3 宫颈癌HeLa 细胞培养应用含10%FBS 的DMEM 培养基,培养宫颈癌HeLa 细胞,3 d 传代一次。
1.4 细胞集落形成实验检测细胞集落形成抑制率取对数生长期宫颈癌HeLa 细胞,采用胰蛋白酶消化制备单细胞悬液,在6 cm 平板上接种1 000 个细胞,细胞贴壁后,加入20%和60%的MSCs 条件培养基,在37 ℃、5%CO2的条件下培养8 d,显微镜下观察细胞集落形成情况。每组细胞设置5 个复孔,取出平板后以甲醇固定20 min,以PBS 缓冲液冲洗1 次,吉姆萨染色15 min。拍照,统计20%和60% MSCs 对宫颈癌HeLa 细胞集落形成抑制率。
1.5 细胞增殖实验检测细胞增殖抑制率收集对数生长期的宫颈癌HeLa 细胞,浓度为2×105mL-1,接种于96 孔细胞培养板,每孔50 μL,次日将不同浓度的第5 代MSCs(5%、10%、20%、40%和60%)加入丝裂霉素C 处理3 h,待细胞贴壁后,以DMEM 培养基洗涤3 次,接种于96 孔细胞培养板内,每组设置5 个复孔,以RPMI 1640 完全培养液作为空白对照。将处理后的MSCs 细胞调节为适当浓度,与HeLa 细胞共同培养接种于96 孔细胞培养板中,每组5 个复孔,将96 孔细胞培养板置于37 ℃、5%CO2的饱和湿度条件下培养。24 h 后取出96 孔细胞培养板,每孔加入10 μL CCK-8 液,在37 ℃条件下孵育2 h,采用酶标仪于450 nm 波长处检测各孔吸光度(A)值。依据实验结果,计算细胞增殖抑制率。实验分组:①对照组,仅加入宫颈癌HeLa 细胞;②MSCs 组,加入MSCs 细胞;③实验组,根据HeLa 细胞和MSCs 细胞比例(依次为1∶3、1∶2、1∶1、2∶1、4∶1 和8∶1)不同分组。MSCs 对HeLa 细胞的增殖抑制率的计算公式:细胞增殖抑制率=[1-(实验组A 值-MSCs 组A 值)/对照组A 值]×100%。
1.6 细胞凋亡实验检测细胞凋亡率收集MSCs处理48 h 后的宫颈癌HeLa 细胞(HeLa 细胞和MSCs 细胞比例为1∶3)作为实验组,以单纯宫颈癌HeLa 细胞作为对照组,使用预冷后的PBS 缓冲液洗涤3 次,取适量结合PBS 缓冲液重悬细胞,将细胞密度调节为1×106mL-1,取100 μL 细胞悬液置入流式管内,加入5 μ L Annexin Ⅴ/FITC 和10 μL 的PI,混合后摇匀,室温避光孵育15 min,以300 目尼龙网过滤,采用流式细胞仪测定细胞凋亡率。细胞凋亡率=细胞凋亡数/总细胞数×100%。
1.7 蛋白质印迹法检测宫颈癌HeLa 细胞中凋亡分子蛋白表达水平MSCs 处理HeLa 细胞0、24 和48 h 后,收集细胞,以1×PBS 缓冲液洗涤2 次,采用RIPA 蛋白裂解液提取细胞总蛋白,4 ℃、1 000 r·min-1离心15 min,离心半径为8 cm,取上清液。应用Bradford 法检测蛋白含量,蛋白提取物定量后,各组取等量蛋白,加入上样缓冲液,置入沸水中变性,以50 μg 待检测蛋白质样品,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转移至聚偏二氟乙烯膜,采用5%脱脂奶粉封闭1 h,加入一抗(兔抗人caspase-3、P53 和Bcl-2,浓度为1∶1 000),4 ℃过夜,采用TBST 漂洗,加入HRP 标记的山羊抗兔IgG(浓度为1∶8 000),常温孵育1 h,经TBST 漂洗3 次,以ECL 试剂盒显色,在LAS-4000 凝胶成像仪上显影,分析各个条带灰度值。目的蛋白表达水平=目的蛋白灰度值/内参蛋白灰度值。
1.8 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组细胞凋亡率及蛋白相对表达水平均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t法。检验水准为α=0.05。
2 结果
2.1 MSCs 形态表现光学显微镜下观察可见:脐带分离细胞接种72 h 后有少量细胞贴壁,1 周后逐渐变成扁平单层细胞,呈簇状、旋涡状生长,伴随细胞密度增加,细胞体随之变细长,形态与成纤维细胞类似。见图1。

图1 从脐带中分离出的MSCs 形态表现(×40)Fig.1 Morphology of MSCs isolated from umbilical cord (×40)
2.2 MSCs 细胞表面抗原分析利用流式细胞术检验MSCs 细胞表面抗原标记物CD90、CD34、CD45 和CD105,结果显示:MSCs 细胞CD90 和CD105 呈阳性表达,CD34 和CD45 呈阴性表达,符合干细胞表型。见图2。
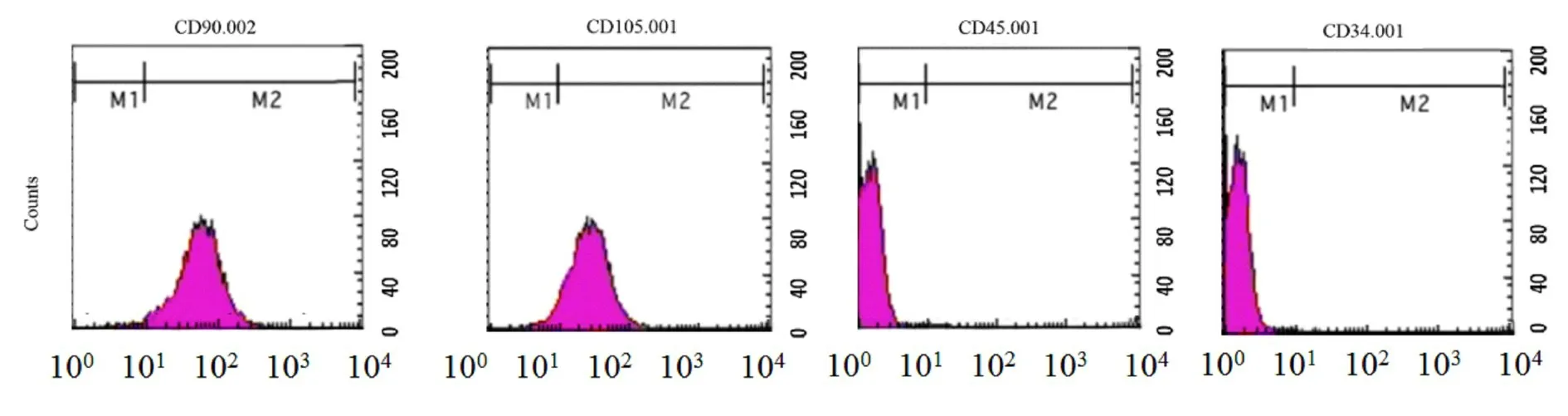
图2 MSCs 表面抗原标志物的表达Fig.2 Expressions of surface antigen markers of MSCs
2.3 各组HeLa 细胞集落形成抑制率将宫颈癌HeLa 细胞与20%和60%浓度的MSCs 条件培养基培养共8 d,进行集落形成实验,结果显示:加入20%和60%的MSCs 条件培养基时,宫颈癌HeLa细胞集落形成抑制率分别为18.56% 和37.64%。见图3。

图3 MSCs 条件培养基作用下各组HeLa 细胞集落形成能力Fig.3 Colony forming abilities of HeLa cells in various groups after treated with MSCs conditioned medium
2.4 各组HeLa 细胞增殖抑制率随着HeLa 细胞/MSCs 细胞比例增加,MSCs 细胞对HeLa 细胞增殖抑制率持续下降,且呈现一定浓度依赖性。见图4。
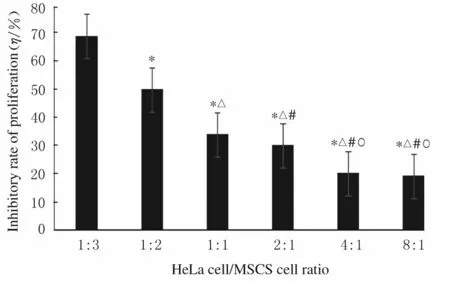
图4 各组HeLa 细胞增殖抑制率Fig.4 Inhibitory rates of proliferation of HeLa cells in various groups
2.5 2 组HeLa 细胞凋亡率Annexin Ⅴ/PI 双染后,经流式细胞术检测,结果显示:MSCs 处理48 h 后的宫颈癌HeLa 细胞凋亡率为(21.77%±2.51%),高于对照组(1.29%±0.88%),差异有统计学意义(P<0.05),提示MSCs 可诱导宫颈癌HeLa 细胞凋亡。见图5。

图5 2 组HeLa 细胞凋亡率Fig.5 Apoptotic rates of HeLa cells in two groups
2.6 不同时间点各组HeLa 细胞中caspase-3 和P53 蛋白表达水平MSCs 处理HeLa 细胞0、24 和48 h 后,各组HeLa 细胞中caspase-3 和P53 蛋白表达水平持续升高,Bcl-2 蛋白表达水平持续降低,同一蛋白不同时间点的相对表达水平比较差异有统计学意义(P<0.01)。见表1 和图6。
表1 各组细胞中caspase-3、P53 和Bcl-2 蛋白表达水平Tab.1 Expression levels of caspase-3,P53 and Bcl-2 in HeLa cells in various groups (n=3,)
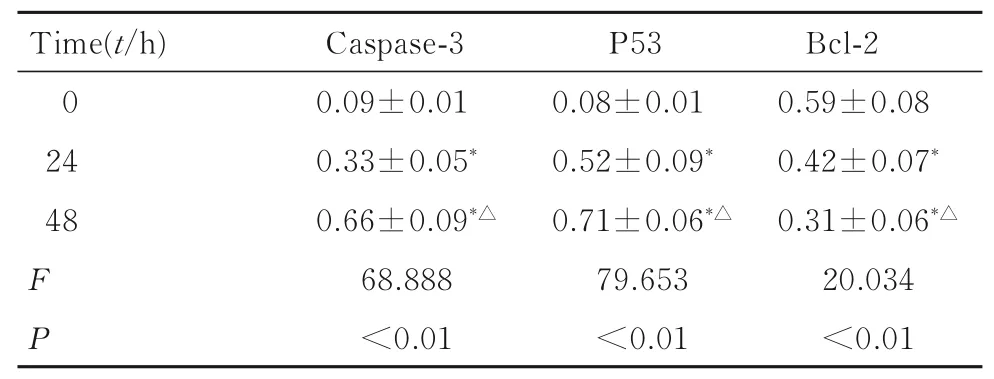
表1 各组细胞中caspase-3、P53 和Bcl-2 蛋白表达水平Tab.1 Expression levels of caspase-3,P53 and Bcl-2 in HeLa cells in various groups (n=3,)
*P<0.01 compared with 0 h;△P<0.01 compared with 24 h.

图6 MSCs处理0、24和48 h后HeLa细胞中caspase-3、P53 和Bcl-2 蛋白表达电泳图Fig.6 Electrophoregram of expressions of caspase-3,P53 and Bcl-2 proteins in HeLa cells after treated with MSCs for 0,24,and 48 h
3 讨论
宫颈癌是一种全球发病率仅次于乳腺癌的妇科恶性肿瘤,每年新增病例超过50 万,病死率在妇科肿瘤中占比高达8%,对女性健康造成严重威胁[6-7]。既往宫颈癌治疗以手术和放射治疗为主,但即使医疗科技发展到今天,医师手术技巧和放疗技术均有长足进步,宫颈癌患者5 年生存率的提升幅度不甚理想,因此探索其他治疗方法十分必要[8-9]。伴随基因治疗研究日益深入,干细胞理论日趋丰富,相关技术不断完善,MSCs 凭借其独特生物学特性,可向肿瘤组织进行特异性趋化,被募集于肿瘤处,发挥抗肿瘤作用,其在癌症中的潜在治疗价值引起学术界广泛关注,但是否适用于宫颈癌临床治疗,有待深入研究。
有学者对宫颈癌细胞中侧群细胞进行了富集、分选,发现宫颈癌细胞分化越差,侧群细胞比例越低,且后者具备一定肿瘤干细胞特征,可作为宫颈癌干细胞治疗的切入点[10]。目前临床采用的MSCs多源自脐带,本研究即从足月胎儿脐带组织中分离获得了可靠的脐带MSCs 细胞,发现其黏附性较强,与宫颈癌HeLa 细胞共培养1 周后形态变为扁平单层细胞,提示MSCs 培养成功,且MSCs 条件培养基浓度越高,宫颈癌HeLa 细胞集落形成能力越弱,建议选用20% 浓度的MSCs 条件培养基。本研究探讨了MSCs 细胞与HeLa 细胞之间不同比例时对细胞增殖抑制率,结果显示:伴随MSCs 比例增加,HeLa 细胞增殖抑制率持续下降,呈现出浓度依赖性,提示不同浓度的MSCs 对于HeLa 细胞增殖的抑制能力不同,建议采取高浓度MSCs 细胞抑制宫颈癌HeLa 细胞毒性。其原因可能是MSCs 细胞可分泌一定量生物活性因子,间接杀死癌细胞,影响癌细胞信号通路,从而抑制癌细胞增殖;另外,还可能与细胞凋亡间存在一定关联,MSCs 可能是通过激活凋亡基因,诱导癌细胞凋亡,从而影响癌细胞周期,抑制癌细胞增殖。经流式细胞术检测结果显示:MSCs 处理48 h 后的宫颈癌HeLa 细胞早期凋亡率为21.77%,与单纯宫颈癌HeLa 细胞比较差异有统计学意义,提示MSCs可诱导宫颈癌HeLa 细胞凋亡。
研究[11-12]证明:MSCs 对癌细胞生长有抑制作用,一方面可抑制癌细胞周期、促进癌细胞凋亡干扰癌细胞周期进程;另一方面还可通过分泌生物活性因子作用于癌细胞信号通路抑制癌细胞增殖、诱导其凋亡。本研究选取多种细胞凋亡分子并进行检测,结果显示:MSCs 体外可上调促凋亡分子caspase-3 和P53 蛋白表达,下调抗凋亡因子Bcl-2蛋白表达,最终促进HeLa 细胞凋亡。caspase 是存在于细胞质的天冬氨酸特异性半胱氨酸蛋白水解酶,也是促使HeLa 细胞凋亡的主要调控蛋白[13]。caspase 分为2 类:一类是发挥启动作用的促凋亡蛋白,如caspase-8 和caspase-9;另一类负责执行促凋亡任务,如caspase-3[14-15]。P53 蛋白可调控细胞周期启动,与细胞周期调控、细胞分化、DNA 修复和细胞凋亡等生物学功能有关[16-17]。p53 基因在宫颈癌HeLa 细胞中的表达被抑制,因而有学者认为可通过上调P53 蛋白而抑制HeLa 细胞增殖[18]。研究[19-20]表明:Bcl-2 蛋白属于凋亡相关蛋白,其过度表达与多种上皮性肿瘤产生、进展存在密切关系,可使细胞在DNA 损伤的情况下持续生存。同时,既往研究[21]表明:Bcl-2 蛋白表达与宫颈癌细胞扩散直接相关。本研究结果显示:MSCs 对HeLa 细胞处理0、24 和48 h 后的caspase-3 和P53 蛋白相对表达水平持续升高,Bcl-2 蛋白相对表达水平持续降低,提示MSCs 可能通过上调caspase-3 和P53 蛋白表达,下调Bcl-2 蛋白表达,抑制宫颈癌HeLa 细胞毒性。
综上所述,MSCs 体外抑制宫颈癌HeLa 细胞增殖,诱导其凋亡,可能是通过上调caspase-3 和P53 蛋白表达、下调Bcl-2 蛋白表达实现的,该结果为MSCs 治疗宫颈癌提供了理论依据,未来可更深一步研究,丰富MSCs 治疗宫颈癌的实验依据。

