紫苏叶中α-淀粉酶抑制剂的提取工艺研究
糖尿病是一种以高血糖为特征的代谢疾病。近几十年来,糖尿病患者的比例逐渐提高,90%以上的患者被诊断为2型糖尿病。糖尿病易引发各种并发症,如神经病变、肾病、肝损伤等[1]。因此,抑制或延缓糖尿病并发症的有效途径之一是通过抑制α-淀粉酶的活性来减缓葡萄糖的形成[2]。α-淀粉酶抑制剂(α-Amylase Inhibitor,α-AI)主要作用于人体的胃肠道,通过抑制α-淀粉酶的活性来延缓和阻碍碳水化合物的消化吸收,从而使血糖浓度降低[3]。目前,临床上常用的降糖药物有一定的治疗效果,但易产生副作用。因此,研究者开始从植物中开发绿色安全、副作用小的α-淀粉酶抑制剂[4]。
紫苏(Perilla frutescensL.)是一种药食同源的中草药,有近2000年的栽培历史[5]。紫苏全身是宝,其叶、茎和种子均可入药,而叶子为最常用入药器官。研究表明紫苏具有抗氧化、治疗心血管疾病、降血糖等活性,这些功能与其含有多种生物活性成分有关,如酚酸类、黄酮类、多糖类等[6-7]。因此,本研究以紫苏叶为实验原料,采用乙醇浸提的方法提取紫苏叶中具有α-淀粉酶抑制活性的物质,并通过正交实验对其提取工艺条件进行优化,为更好地开发利用紫苏叶提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
紫苏叶购自于广东省揭阳市;3,5-二硝基水杨酸;猪胰腺α-淀粉酶;可溶性淀粉;无水乙醇等。
1.2 仪器与设备
FLUOstar Omega多功能荧光酶标仪,德国BMG LABTECH公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;H2050R高速冷冻离心机,长沙湘仪离心机仪器有限公司等。
1.3 实验方法
1.3.1 紫苏叶预处理
先用自来水冲洗新鲜的紫苏叶片表面,再用蒸馏水清洗,自然风干,鼓风干燥箱60 ℃烘10 h。多功能粉碎机粉碎后过60目标准筛,装自封袋中4 ℃保存备用。
1.3.2 紫苏叶α-淀粉酶抑制剂的提取工艺
准确称取3 g过筛后的粉末,加入一定体积的乙醇溶液,在恒定温度下浸提一段时间。利用超声波辅助提取30 min,10 000 r·min-1离心15 min,得到的上清液经旋转蒸发仪浓缩,用蒸馏水将不同实验条件下获得的紫苏叶提取液定容至相同体积。
1.3.3 单因素实验
采用上述提取方法,分别在不同料液比(1∶5、1∶10、1∶15、1∶20和1∶25)、不同提取温度(50 ℃、60 ℃、70 ℃、80 ℃和90 ℃)、不同乙醇浓度(10%、30%、50%、70%和90%)、不同提取时间(10 min、30 min、50 min、70 min和90 min)条件下进行浸提,探讨上述因素对α-AI的抑制率的影响。
1.3.4 正交实验
在单因素实验的基础上,选取料液比、提取温度、乙醇浓度和提取时间这4个因素为自变量,α-AI的抑制率为因变量,采用L9(34)正交实验法,确定α-AI的最优提取条件。
1.3.5 α-AI活性测定
参考赵蓉等[8]的方法测定紫苏叶提取物中α-AI的活性。将0.25 mL的紫苏叶提取样液与0.25 mL猪胰腺α-淀粉酶稀释液(1.5 U·mL-1)混合,加入0.5 mL PBS溶液,37 ℃水浴10 min。加入0.5 mL 0.1%可溶性淀粉,37 ℃水浴反应5 min。加入DNS试剂1 mL,沸水浴10 min,冷却至室温,540 nm处测定吸光值。α-AI的抑制率为
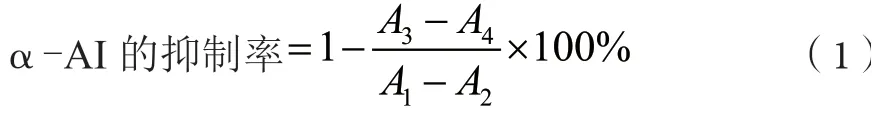
式中:A1、A2、A3和A4分别为空白管、空白对照管、抑制管和抑制对照管的吸光值。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对α-AI的抑制率的影响
由图1可知,随着料液比的增大,提取液中α-AI的抑制率逐渐增大,当料液比为1∶20(g∶mL)时α-AI的抑制率最好。说明适当增加提取剂的用量,可以增大提取剂与α-AI的抑制率成分的接触面积,有利于提取物中α-AI的抑制率成分的扩散,便于α-AI的抑制率成分的溶出,从而提高其抑制率[9]。继续提高料液比,α-AI的抑制率反而下降。因为增加了提取液的体积,α-AI在体系中的浓度逐渐降低,从而导致其抑制率下降。因此最佳料液比为1∶20(g∶mL)。
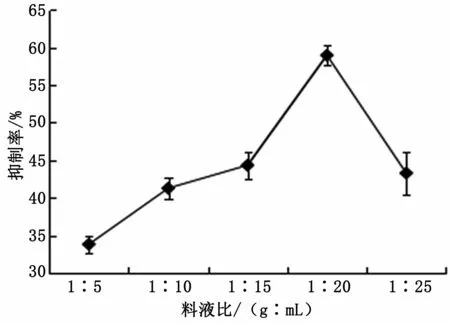
图1 料液比对α-AI的抑制率的影响图
2.1.2 提取温度对α-AI抑制率的影响
由图2可知,随着温度的升高,提取液中α-AI的抑制率逐渐增大,温度达到60 ℃时,α-AI的抑制率最好。此后随温度的增加抑制率反而下降。因为温度对α-AI的溶解度会产生一定影响,升温会使分子热运动逐渐加快,同时也会提高提取剂的扩散速度,加大提取剂对α-AI的溶解度[10],利于提取物中降血糖的活性物质得到释放。但过高的温度可能会导致α-淀粉酶抑制剂的稳定性受到影响,同时α-AI成分也会部分失活,从而变性析出,降低其活性[9]。因此最佳提取温度为60 ℃。
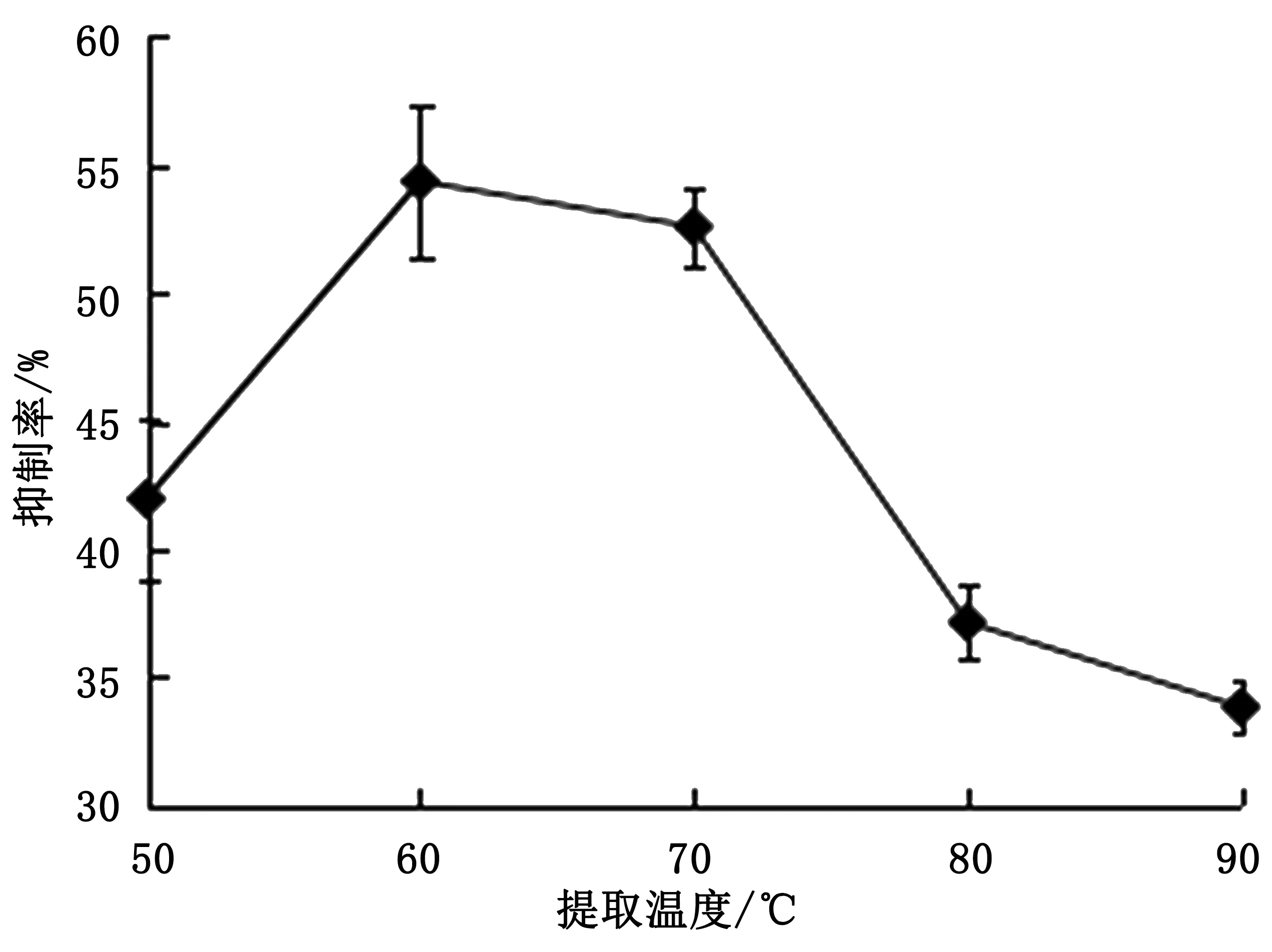
图2 提取温度对α-AI的抑制率的影响图
2.1.3 乙醇浓度对α-AI抑制率的影响
由图3可知,乙醇浓度在10%~70%,提取液中α-AI的抑制率随着浓度的增加而升高,当乙醇浓度为70%时α-AI的抑制率达到最大,提取效果最好,之后逐渐下降。可能是因为乙醇浓度的提高,会增大提取剂对细胞的渗透作用[6],有利于α-AI的抑制率成分从细胞中释放出来,从而提高提取物中α-AI的抑制率。当乙醇的浓度增加到一定程度后,物料中水的比例降低,会阻碍α-AI的溶出,从而影响其得率,α-AI的抑制率不升反降[10]。因此最佳乙醇浓度为70%。
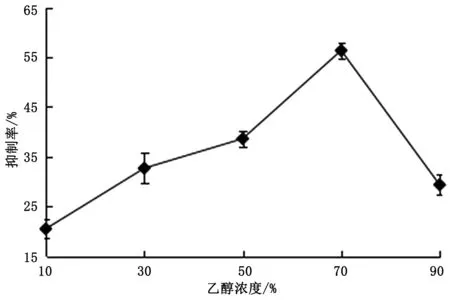
图3 乙醇浓度对α-AI的抑制率的影响图
2.1.4 提取时间对α-AI抑制率的影响
由图4可知,随着提取时间的延长,提取液中α-AI的抑制率逐渐提高,浸提时间为70 min时,α-AI的抑制率最好。说明在浸提初期,延长提取时间有利于α-AI的析出。当活性成分在细胞内外趋于平衡时,继续增加浸提时间,提取液中能够抑制α-AI活性成分的物质浓度在增加,溶出物中α-AI活性成分所占的比例降低[11]。因此最佳提取时间为70 min。
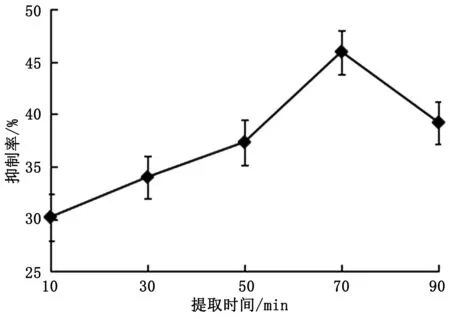
图4 提取时间对α-AI的抑制率的影响图
2.2 正交实验结果分析
在单因素实验的基础上,采用L9(34)正交实验法,因素与水平设计见表1。由表2可知,根据K值确定α-淀粉酶抑制剂提取的最优水平组合为A2B2C2D2,即料液比为1∶20(g∶mL),提取温度为60 ℃,乙醇浓度为70%,提取时间为70 min。为进一步确定制备α-淀粉酶抑制剂的最佳工艺条件,对正交实验的提取条件A2B2C2D2进行验证。结果表明,α-淀粉酶抑制剂的抑制率平均值为59.12%。说明不同因素之间会存在一定的相互促进作用,优化后α-AI的抑制率有所提高。
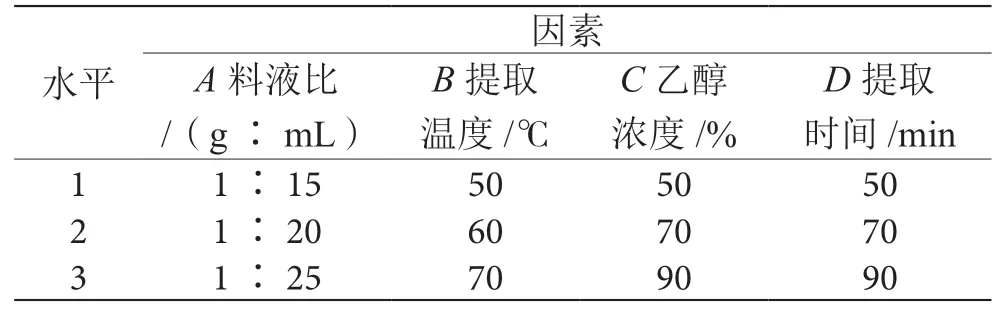
表1 正交实验因素与水平表
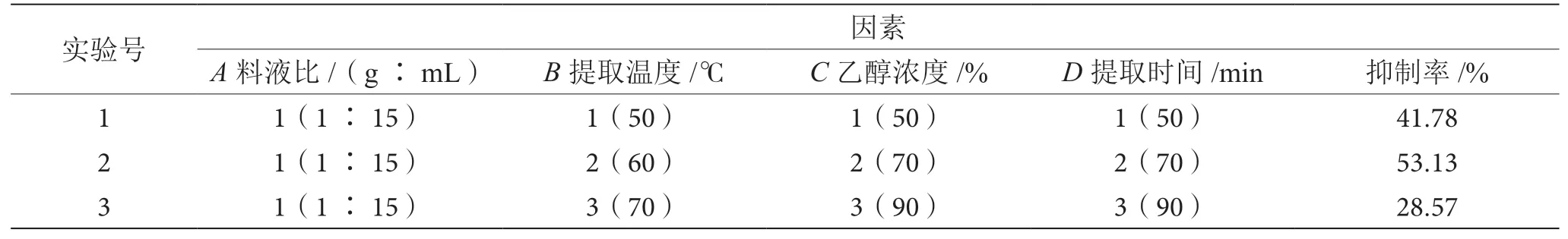
表2 正交实验结果表

续表2
3 结论
本实验探讨了料液比、提取温度、乙醇浓度和提取时间对紫苏叶提取物中α-AI的抑制率的影响,在单因素实验基础上,优化了α-AI的提取条件。影响α-AI的抑制率的因素依次为料液比>乙醇浓度>提取温度>提取时间。α-淀粉酶抑制剂提取的最优水平组合为A2B2C2D2,即料液比为1∶20(g∶mL),提取温度为60 ℃,乙醇浓度为70%,浸提时间为70 min,得到的α-淀粉酶抑制剂的抑制率为59.12%。

