RGD肽修饰的pH响应型中空介孔二氧化硅纳米粒子的制备与评价
王小宁,巩志强,闫梦茹,梁晓燕,马远涛
(西安医学院药学院,陕西 西安 710021)
抗肿瘤药物纳米递送系统由于具有尺寸小、能显著改善药物的溶解度、提高药物的稳定性、延长其血液循环时间等优点,成为目前化疗药物制剂研究的热点[1]。近年来,介孔二氧化硅纳米粒子(mesoporous silica nanoparticles,MSN)已经被证明是最有潜力的药物递送纳米载体之一[2]。相比于介孔二氧化硅纳米粒子,中空介孔二氧化硅纳米粒子(hollow mesoporous silica nanoparticles,HMSN)具有球形中空空腔和介孔孔壁,比表面积和孔体积较大,有效提高了介孔二氧化硅的载药能力,在提高抗癌药溶解度及肿瘤部位滞留(EPR效应)等方面具有显著优势[3],且生物相容性较好,可生物降解。
通常,载体通过EPR效应被动靶向至肿瘤部位的效果有限,为提高给药系统的靶向性,采用一些小的靶向基团或配体来修饰纳米载体表面,可有效促进药物靶向递送至肿瘤部位并促进细胞摄取[4]。αvβ3整合素受体在多种肿瘤血管内皮细胞中高度表达,精氨酸(R)-甘氨酸(G)-天冬氨酸(D)(RGD肽)序列是已知的αvβ3整合素靶向序列,因此,通过RGD肽序列靶向肿瘤细胞αvβ3整合素受体,可促进细胞的摄取[5-6]。
然而,抗肿瘤药物自纳米粒中的缓慢释放可能导致细胞内游离药物的浓度长时间维持低水平,从而抑制抗肿瘤效果,甚至可能导致肿瘤细胞产生耐药性[7]。因此,为了保证抗肿瘤药物有效地递送至肿瘤部位并达到足够的药物浓度,要求载体在血液循环中保持稳定并将药物快速释放至肿瘤细胞的胞浆中。这可以通过具有触发释放机制的靶向载体来实现[8]。
肿瘤细胞由于在无氧状态下糖降解速率快,产生的乳酸大量堆积,使得细胞周围处于弱酸性环境,pH值在 6.0~7.0 之间[9],这种弱酸性环境可以为设计 pH 敏感给药系统提供条件。聚(2-乙基-2-噁唑啉)[poly(2-ethyl-2-oxazoline),PEOz]是一种亲水性材料,近年来较多用于功能高分子材料的合成[10]。研究表明,PEOz水溶性好,生物相容性理想,可以发挥与聚乙二醇(PEG)类似的亲水效应,具有 pH 敏感性的结构特征,因此,由PEOz构建的pH响应载药体系研究受到了广泛关注[11-12]。聚多巴胺(PDA)结构中含有活泼的双键,可与多个基团发生化学反应,例如氨基(-NH2)、巯基(-SH)等[13],几乎可以在任何类型的材料表面上形成粘合层,是用于功能化修饰非常通用的平台[14]。修饰后载体兼具pH响应性和主动靶向性,使药物靶向导入肿瘤进行响应释放,提高药物疗效并降低抗癌药物对正常细胞的损害作用。
作者构建由RGD肽和pH响应材料PEOz共同修饰的中空介孔二氧化硅纳米载体(HMSN-PEOz-RGD),以PDA为反应平台进行功能化修饰,以盐酸阿霉素(DOX)为模型药物,在细胞水平对载药体系进行评价,阐明载药体系的靶向效果,为癌症的靶向治疗提供理论依据。
1 实验
1.1 材料、试剂与仪器
人乳腺癌细胞MCF-7,购自中国科学院上海细胞生物研究所,用含10%胎牛血清的高糖DMEM培养基于37 ℃、5%CO2及饱和湿度条件下连续培养。
载体:HMSN、HMSN-PDA、HMSN-PEOz、HMSN-PEOz-RGD,自制;3-氨丙基三乙氧基硅烷(APTES)、 精氨酸-甘氨酸-天冬氨酸(RGD肽)、盐酸多巴胺,阿拉丁试剂(上海)有限公司;盐酸阿霉素(DOX),上海吉至生化科技有限公司;巯基化聚(2-乙基-2-噁唑啉)(PEOz-SH),西安瑞禧生物科技有限公司;DMEM培养基、10%胎牛血清(Hyclone),海德创业生物科技有限公司;四甲基偶氮唑蓝(MTT),Sigma;Tris-HCl、胰蛋白酶-EDTA消化液、双抗(青霉素和链霉素),北京索莱宝有限公司;DAPI染料,苏州宇恒生物科技有限公司;多聚甲醛,天津科密欧化学试剂有限公司。
DF-101S型集热式恒温加热磁力搅拌器,巩义予华仪器有限责任公司;T-27型傅立叶红外光谱仪,德国布鲁克;Cary60型紫外可见分光光度计,安捷伦科技有限公司;KQ5200E型超声波清洗器,昆山超声仪器有限公司;冷冻干燥机,美国Labconco公司;ZEN3500型激光粒度分析仪,英国马尔文仪器有限公司;SQP型电子天平,赛多利斯科学仪器有限公司;DZF6050型真空干燥箱,温州顶历医疗器械有限公司;U-LH100HG Ⅸ73型倒置荧光显微镜,Olympus;680型酶标仪,美国BIO-RAD;TCS-SP8型激光共聚焦显微镜,德国Leica公司。
1.2 载药体系DOX@HMSN-PEOz-RGD的构建
称取100 mg HMSN,加入20 mL去离子水,超声20 min后,加入50 mg DOX,搅拌使其溶解,室温下600 r·min-1避光搅拌24 h;离心(14 000 r·min-1,30 min),沉淀用去离子水洗涤4次,40 ℃真空干燥过夜,即得DOX@HMSN。
称取100 mg DOX@HMSN粉末置于50 mL Tris-HCl缓冲液(10 mmol,pH值8.5)中,加入50 mg盐酸多巴胺,室温下避光搅拌(300 r·min-1)24 h,离心(13 000 r·min-1,10 min),沉淀用去离子水洗涤3次,40 ℃真空干燥过夜,即得DOX@HMSN-PDA。
称取100 mg DOX@HMSN-PDA粉末,加入20 mL含有50 mg PEOz-SH的Tris-HCl缓冲液(10 mmol,pH值8.5),室温下搅拌6 h,离心(10 000 r·min-1,10 min),沉淀用去离子水洗涤3次,40 ℃真空干燥过夜,即得DOX@HMSN-PEOz。
称取100 mg DOX@HMSN-PEOz粉末,加入含有50 mg RGD肽(2 mg·mL-1)的Tris-HCl缓冲液(10 mmol,pH值8.5),室温下搅拌3 h,离心(10 000 r·min-1,10 min),沉淀用去离子水洗涤3次,40 ℃真空干燥过夜,即得 DOX@HMSN-PEOz-RGD。
分别收集所有离心后的上清液,测定其吸光度,按式(1)和式(2)计算载药量及包封率。

(1)

(2)
1.3 载体的表征
采用溴化钾压片,对各修饰载体进行红外光谱表征。采用透射电子显微镜对HMSN和HMSN-PEOz-RGD的分散性和内部孔道结构进行表征。室温下将各修饰载体超声分散于去离子水中,采用激光粒度分析仪于25 ℃下测定各修饰载体的粒径及电位。
1.4 DOX含量测定方法学考察
1.4.1 标准曲线的绘制
精密称取15 mg DOX,置于50 mL棕色容量瓶中,用蒸馏水定容至刻度,得到浓度为300 μg·mL-1DOX储备液,4 ℃下避光保存备用。精密量取DOX储备液0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL于25 mL棕色容量瓶中,分别加蒸馏水稀释至刻度,摇匀,得浓度(μg·mL-1)分别为6、12、24、36、48系列DOX标准溶液,以蒸馏水为空白,于480 nm处测定吸光度值(A)。以吸光度值为纵坐标、浓度(c)为横坐标绘制标准曲线,得到回归方程为:A=0.0197c-0.0491,R=0.9991,表明DOX浓度在6~48 μg·mL-1范围内与吸光度线性关系良好。
1.4.2 精密度实验
取12 μg·mL-1的DOX标准溶液,按照测定条件连续测定6次吸光度值,计算RSD值为0.99%,说明该方法精密度良好。
1.4.3 稳定性实验
取12 μg·mL-1的DOX标准溶液,分别在0 h、2 h、4 h、8 h、12 h按照测定条件测定吸光度值,计算RSD值为0.45%,说明溶液在12 h内稳定。
1.4.4 加样回收率实验
经典作家当下研究的新视野——《赫尔曼·麦尔维尔的现代阐释》述评 ………………………… 赵晶辉(1.109)
分别取浓度(μg·mL-1)为6、24、48系列DOX标准溶液(n=3),加入处方比例的HMSN,超声分散,加蒸馏水定容,以蒸馏水为空白,在480 nm处分别测其吸光度值,计算加样回收率,结果见表1。

表1 加样回收率实验结果
由表1可知,在低、中、高浓度范围内所得的加样回收率均在98.83%~100.67%之间,RSD值均小于5%,表明该方法回收率良好。
1.5 体外释药实验
采用透析法考察DOX@HMSN、DOX@HMSN-PEOz、DOX@HMSN-PEOz-RGD的体外释药行为。精密称取100 mg载药纳米粒子,分散于2 mL去离子水中,将溶液装入提前处理好的截留量为3 500的透析袋中,释放介质为100 mL PBS缓冲液(pH值5.0或pH值7.4),37 ℃避光恒温搅拌,在预设的时间点(20 min、40 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h)吸取释放液3 mL,同时补入等体积等温度的PBS缓冲液。测定样品溶液在480 nm处吸光度值,计算DOX累积释放百分数,绘制累积释放百分数-时间曲线。
1.6 载药体系的靶向性研究
1.6.1 生物相容性评价
将MCF-7细胞按每孔1×104个的密度接种于96孔培养板中,于37 ℃、5% CO2条件下培养24 h,分别加入终浓度为2.5 μg·mL-1、5 μg·mL-1、10 μg·mL-1、20 μg·mL-1、40 μg·mL-1、80 μg·mL-1的 HMSN、HMSN-PEOz、HMSN-PEOz-RGD各200 μL,每个浓度设置6个复孔,对照组加入等体积完全培养基。继续培养24 h后,避光加入MTT溶液(10 μg·mL-1)150 μL,继续培养4 h,小心吸弃上清液,每孔加入100 μL DMSO,37 ℃下振荡 10 min,在酶标仪上测定490 nm处各孔吸光度值,按式(3)计算细胞存活率。

(3)
1.6.2 体外细胞生长抑制率
将MCF-7细胞按每孔1×104个的密度接种于96孔培养板中,于37 ℃、5% CO2条件下培养24 h,分别加入终浓度为0.5 μg·mL-1、1 μg·mL-1、2 μg·mL-1、4 μg·mL-1、8 μg·mL-1、16 μg·mL-1的DOX、DOX@HMSN、DOX@HMSN-PEOz、DOX@HMSN-PEOz-RGD,每个浓度设置6个复孔,对照组加入等体积完全培养基,每孔终体积为200 μL。继续培养24 h,避光加入MTT溶液(10 μg·mL-1)150 μL,继续培养4 h,小心吸弃上清液,每孔加入100 μL DMSO,37 ℃下振荡 10 min,在酶标仪上测定490 nm处各孔吸光度值,按式(4)计算细胞生长抑制率。
(4)
将MCF-7细胞按每孔3×105个的密度接种于6孔培养板中,于37 ℃、5% CO2条件下培养24 h。吸弃培养液,用无血清培养液漂洗3次,加入2 mL无血清培养液稀释的DOX、DOX@HMSN、DOX@HMSN-PEOz、DOX@HMSN-PEOz-RGD,使DOX的终浓度为10 μg·mL-1,37 ℃下继续孵育4 h。吸弃含药培养基,用冷PBS缓冲液洗涤3次,用4%多聚甲醛在37 ℃下固定20 min。固定完毕后,吸弃多聚甲醛溶液,用冷PBS缓冲液洗涤3次,然后每孔加入DAPI染色溶液(0.5 μg·mL-1)1 mL,染色15 min后,用冷PBS缓冲液洗涤3次,防荧光猝灭封片剂封片后,用荧光倒置显微镜进行观察分析。
2 结果与讨论
2.1 载体的红外光谱表征(图1)
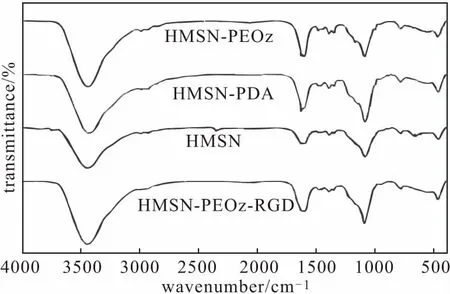
图1 载体的红外光谱Fig.1 FTIR spectra of carriers
由图1可知,1 050 cm-1左右的峰归属于HMSH上Si-O-Si伸缩振动。PDA包裹后,1 633 cm-1处的峰可归属于芳环骨架伸缩振动,3 432 cm-1的宽吸收峰可归属于N-H/O-H的拉伸振动,这表明HMSN表面形成了PDA涂层。对于HMSN-PEOz,1 640 cm-1处的峰归属于PEOz上-CO-NH2中-C=O的振动,3 451 cm-1处的峰归属于PEOz上端-OH 的振动;对于HMSN-PEOz-RGD,1 540 cm-1、1 280 cm-1处的峰分别归属于RGD肽上-C=O和-CO-NH2的振动,表明在纳米粒子表面成功连接靶向配体RGD肽。
2.2 载药量和包封率(表2)

表2 载药量和包封率/%
由表2可知,HMSN的各制剂载药量均较高,DOX@HMSN的载药量可高达(29.16±2.78)%,包封率为(93.24±2.65)%,修饰后载药量和包封率略有下降。
2.3 载体的形态、粒径及Zeta电位(图2、3)
由图2a可知,HMSN载体的内部为中空结构,平均粒径在130 nm左右,分布较为均匀。由图2b可知,HMSN-PEOz-RGD纳米粒子表面可观察到明显的PDA“壳程”,修饰后粒径明显增大,HMSN-PEOz-RGD的平均粒径为(256.1±26.5) nm。

图2 HMSN(a)和HMSN-PEOz-RGD(b)的透射电镜照片Fig.2 TEM images of HMSN(a) and HMSN-PEOz-RGD(b)
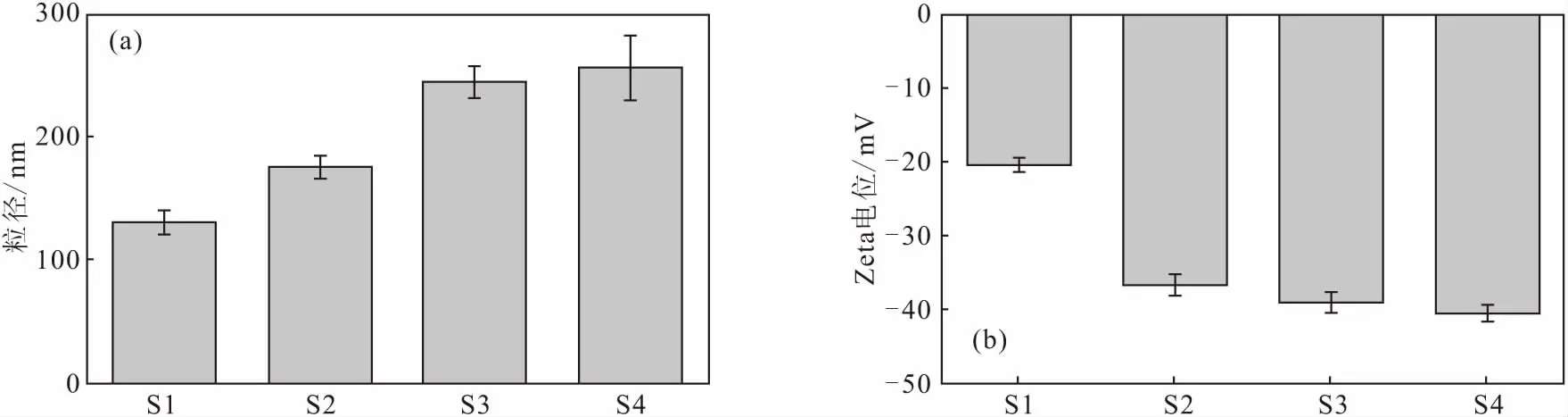
S1.HMSN S2.HMSN-PDA S3.HMSN-PEOz S4.HMSN-PEOz-RGD
由图3a可知,HMSN经PDA包裹后,粒径增大,经PEOz修饰后,粒径进一步增大。这是由于,PEOz长链的水合作用造成纳米粒子的水化,粒径增大。连接RGD肽后,粒径稍有增大。由图3b可知,HMSN表面由于存在大量硅羟基而带负电,经PDA包裹后,电位降低,可能是因为PDA具有儿茶酚结构,使纳米粒子表面带负电[15]。连接PEOz后电位稍有降低,连接RGD肽后,电位继续降低。这是由于,RGD肽中的天冬氨酸带一定的负电荷,纳米粒子间的强静电排斥力使其表现出极强的稳定性。
2.4 载药体系的体外释药
pH响应载药体系可在肿瘤酸性微环境下快速释放药物,对载药体系进行体外释药研究评价其pH响应性,得到体外释药曲线见图4。
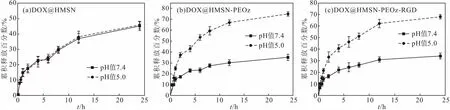
图4 体外释药曲线Fig.4 In vitro drug release curve
由图4可知,未经修饰的HMSN载药后,在不同pH值下,累积释放量基本相同(P>0.05),不具有pH响应性。DOX@HMSN-PEOz组和DOX@HMSN-PEOz-RGD组的累积释放量在pH值7.4时明显低于pH值5.0时的,在pH值7.4时24 h之内大约30%的药物从制剂中释放,而在pH值5.0时,接近70%的药物被释放出来,且两组间累积释放量差异不大(P>0.05)。由于PDA涂层对孔道的封堵,在生理 pH值(pH值 7.4)条件下,两组的药物释放较DOX@HMSN更为缓慢。总之,经PEOz修饰后,制剂的释放行为表现出明显的 pH 依赖性,即酸性(pH值5.0)条件下药物快速释放,而在生理pH值(pH值7.4)条件下药物释放缓慢。这种pH依赖性的释药是由于PEOz链上的叔氨基强烈的质子化引起的。因为PEOz的质子化,纳米粒子表面的电荷密度增加,PEOz链段之间的静电斥力促使长链舒张,孔道打开而释放药物[16]。这种pH值触发的快速释药除了能在短时间内显著增加胞内药物的浓度、从而有效杀死肿瘤细胞之外,胶束在短时间内的快速释药还可能避免肿瘤细胞产生耐药性。
2.5 载药体系的靶向性研究
2.5.1 生物相容性评价
作为靶向递送载体,良好的生物相容性是其体内作用的首要条件。对HMSN各修饰载体进行生物相容性评价,结果见图5。
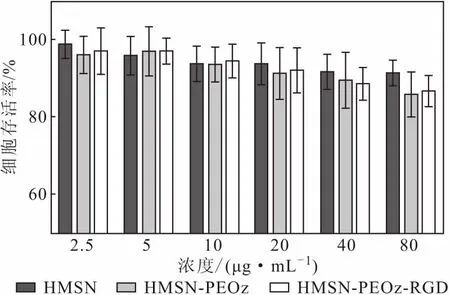
图5 生物相容性实验结果Fig.5 Results of biocompatibility experiments
由图5可知,在2.5~80 μg·mL-1浓度范围内,MCF-7细胞存活率均大于89%。表明,不论是HMSN本身还是其修饰载体均对细胞代谢没有影响。因此,制备的各HMSN载体均具有较好的生物相容性,是良好的药物递送载体。
2.5.2 体外细胞生长抑制率
各载药制剂对MCF-7的细胞毒性结果见图6。
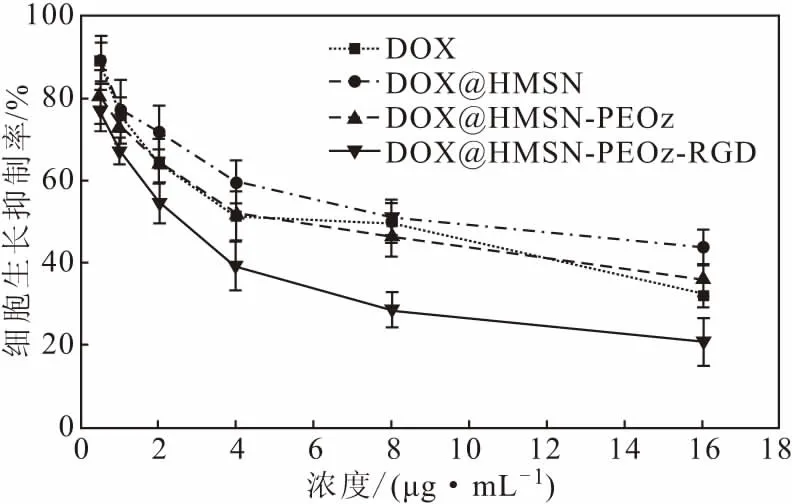
图6 体外细胞生长抑制率结果Fig.6 Results of in vitro cell growth inhibition rate
由图6可知,游离DOX和各载药制剂都对MCF-7细胞的增殖表现出明显的抑制,并且呈现剂量依赖性。游离DOX的IC50值为5.583 μg·mL-1,而DOX@HMSN的IC50值显著增大,为9.050 μg·mL-1,这可能是因为PDA封堵了HMSN的孔道,导致释药速率减慢。DOX@HMSN-PEOz和DOX@HMSN-PEOz-RGD的IC50值分别为5.621 μg·mL-1和2.460 μg·mL-1,DOX@HMSN的IC50值分别是其的1.61倍和3.68倍,说明两种制剂均表现出增强的细胞毒性,DOX@HMSN-PEOz-RGD抑制肿瘤细胞生长的作用最强。这可能是由于,MCF-7细胞是αvβ3阳性的细胞,RGD肽与MCF-7细胞表面过度表达的αvβ3整合素受体具有高亲和力,使其对肿瘤的抑制效果最好。
2.5.3 细胞摄取实验
纳米粒子主要通过内吞的方式内化进入细胞,而经配体的修饰能够促进这种内吞作用。研究了MCF-7细胞对各载药制剂的摄取,结果见图7。
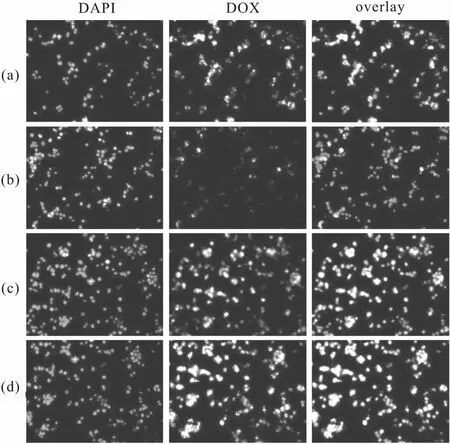
a.DOX b.DOX@HMSN c.DOX@HMSN-PEOz
由图7可知,与游离DOX相比,DOX@HMSN组的细胞摄取明显下降,而DOX@HMSN-PEOz组在细胞内的荧光强度与游离DOX之间差异不大,但是显著强于DOX@HMSN组;DOX@HMSN-PEOz-RGD组具有最高的细胞摄取,说明RGD修饰显著促进了MCF-7细胞对药物的摄取。
3 结论
以聚多巴胺(PDA)为反应平台,对中空介孔二氧化硅纳米粒子(HMSN)进行RGD肽和聚(2-乙基-2-噁唑啉)(PEOz)双重修饰,构建了RGD肽和PEOz共同修饰的中空介孔二氧化硅纳米载体(HMSN-PEOz-RGD),制备条件温和简单。以盐酸阿霉素(DOX)为模型药物构建载药体系DOX@HMSN-PEOz-RGD,通过体外释药实验研究了载药体系在不同pH值下的响应性释放,以人乳腺癌细胞MCF-7为模型,考察了载体的生物相容性及载药体系的细胞毒性及细胞摄取过程。DOX@HMSN-PEOz组和DOX@HMSN-PEOz-RGD组的体外释药都表现出明显的pH依赖性,即酸性(pH值5.0)条件下药物快速释放,而在生理 pH 值(pH值 7.4)条件下药物释放缓慢;生物相容性实验结果显示,各载体在2.5~89 μg·mL-1的浓度范围内,与MCF-7细胞共培养24 h后,细胞存活率均在89%以上,表明载体具有良好的生物相容性;体外抗肿瘤活性实验结果表明,相比于其余载药制剂组,DOX@HMSN-PEOz-RGD组的细胞摄取作用最强,说明RGD修饰显著促进了DOX的细胞摄取。本研究所构建的纳米载体能够特异性靶向递送DOX,具有一定的应用前景。
HMSN虽可生物降解,但其在体内的降解速率很慢,会产生蓄积[17],因此,HMSN在体内的降解及排泄都需要进一步研究。

