SIP合胞体在小鼠结肠中的分布规律及功能研究
王建峰 陆士蛟 刘俊 王彭 王倩倩 陈杰
消化道运动受外来神经和内在神经(肠神经)的调控。在生理条件下,肠神经系统(enteric nervous system,ENS)对胃肠运动起主要调节作用。ENS支配平滑肌运动不像骨骼肌那样形成神经肌-接头的突触联系,而是神经末梢在平滑肌层内形成无数的曲张体(内含神经递质被的囊泡),当神经冲动到来的时候,曲张体内的神经递质被释放出来并扩散到平滑肌发挥作用。近年来研究表明,曲张体与胃肠道平滑肌细胞之间有2种间质细胞,即肌间Caja间质细胞(interstitial cell of Cajal,ICC)和血小板衍生生长因子受体α(platelet-derived growth factor receptor alpha,PDGFRα)阳性细胞[1-4]。平滑肌细胞与这2种间质细胞形成缝隙连接,组成平滑肌、ICC和PDGFRα阳性细胞合胞体,即SIP合胞体[1]。神经递质从曲张体释放出来后,绝大部分通过肌间ICC和PDGFRα阳性细胞调控平滑肌收缩,只有极少量神经递质直接扩散到平滑肌起作用。结肠运动需要ENS和SIP合胞体的共同协调配合。ENS由兴奋性神经元和抑制性神经元组成运动神经元,包括一氧化氮合酶(NOS)和嘌呤神经元,参与调节结肠运动[5-6]。Mane等[7]报道一氧化氮负责平滑肌的持续放松,而嘌呤神经元负责短暂的放松,这可能在结肠传输中起主要作用。此外,结肠移行性复合运动(colonic migrating motor complexes,CMMC)为结肠传输的主要形式,需要满足2个条件:(1)胆碱能运动神经元的激活和抑制性神经递质(主要是一氧化氮、嘌呤)的释放,进而作用于SIP合胞体调节结肠传输,其中兴奋性乙酰胆碱神经元与抑制性的一氧化氮能神经元主要作用于ICC[1],进一步激活或抑制ICC上的钙激活氯通道蛋白1(anoctamin 1,ANO1)产生起搏电流,并通过缝隙连接对平滑肌进行兴奋性调节[8]。另外,ENS中的嘌呤能神经元通过腺嘌呤核苷三磷酸等嘌呤能递质激活PDGFRα阳性细胞上的钙激活钾通道(small conductance Ca2+-activated K+channel,SK3)对平滑肌产生抑制性调节作用[9]。虽然目前有一些关于ICC和PDGFRα阳性细胞在胃肠道中的定位、细胞形态及相关功能等方面的研究报道,但多数集中在小肠和胃,而对于结肠中SIP合胞体的研究较少[10]。因此,本研究拟采用多种实验方法,主要探讨小鼠结肠近远端中这2种间质细胞及离子通道的分布,以及其诱导平滑肌舒缩的传导机制。
1 材料和方法
1.1 实验动物 选用无特定病原体的C57BL/6J小鼠15只,10~12周龄,雌雄不拘,由上海斯莱克实验动物公司提供;饲养于上海交通大学实验动物中心(实验动物编号:A2016047)。
1.2 试剂与仪器 RIPA蛋白裂解液(规格:100 ml,批号:p1082)、ECL 蛋白显色试剂盒(规格:50 ml,批号:p0013)均购自上海碧云天生物技术有限公司;ANO1抗体(规格:100 μl,批号:ab191040)、SK3 抗体(规格:100 μl,批号:ab28631)均购自英国 Abcam 公司;c-Kit抗体(规格:20 μl,批号:3074)、PDGFRα 抗体(规格:20 μl,批号:3174)、辣根过氧化物酶标记抗兔二抗(规格:100 μl,批号:7074)、辣根过氧化物酶标记抗鼠二抗(规格:100 μl,批号:7076) 均购自美国 CST 公司;GAPDH 抗体(规格:100 μg,批号:GB11002)购自谷歌生物科技有限公司;NOS抑制剂L-NAME(规格:1 ml,批号:M00381)购自北京百奥莱博科技有限公司;ANO1通道阻断剂 NPPB(规格:10 mg,批号:S81879)购自上海源叶生物科技有限公司;SK3激动剂CyPPA(规格:10 mg,批号:ab73029)购自英国 Abcam 公司;SK3 阻断剂 apamin(规格:1 mg,批号:CP60151)购自美国ChemeGen公司。肌肉张力换能器(型号:JZJ01,量程30 g)及多道生理信号采集处理系统(型号:RM-6240C)购自成都仪器厂。
1.3 方法
1.3.1 平滑肌组织制备 异氟烷麻醉后颈椎脱臼处死小鼠,迅速取出结肠,放入预先通95% O2+5% CO2混合气的4℃Krebs平衡溶液中。在解剖显微镜下,用眼科剪沿肠系膜方向将肠系膜和脂肪组织清理干净,并沿着肠系膜剪开整个肠管,肠黏膜向上展开固定;用手术镊撕去结肠黏膜和黏膜下层,保留完整的平滑肌肌层。
1.3.2 c-Kit、ANO1、PDGFRα、SK3 蛋白表达检测 (1)采用免疫组化染色法。将甲醛溶液浸泡的小鼠远近端结肠平滑肌组织进行包埋,常规石蜡切片,脱蜡后清水清洗,然后置于100℃柠檬酸抗原修复缓冲液(pH 6.0)中20 min进行抗原修复。自然冷却后浸入3%过氧化氢溶液25 min,PBS充分洗涤。3% BSA封闭2 h后滴加一抗覆盖组织,切片平放于湿盒内4℃孵育过夜。PBS洗3次,5 min/次,二抗室温孵育50 min;PBS充分洗涤后擦干,上显色剂,在显微镜下观察,达到信号强度后终止显色,苏木精衬染、脱水、透明、封片。(2)采用Western blot法。取小鼠远近端结肠平滑肌组织,加入预冷的含苯甲基磺酰氟的RIPA蛋白裂解液,转入匀浆仪中研磨(60 s/次,共3次)。4℃、12 000 r/min离心15 min,吸取上清液,即狭窄段/扩张段组织的总蛋白。加入Loading buffer,置于100℃5 min变性。经5%浓缩胶和8%分离胶聚丙烯酰胺凝胶电泳后(每孔的上样量为20 μg总蛋白)转至聚偏二氟乙烯膜上,3% FBS封闭1 h后进行免疫抗体反应。使用ECL蛋白显色试剂盒发光显色,并利用Bio-Rad凝胶成像分析系统曝光。
1.3.3 CMMC检测 采用电生理学实验。取小鼠全结肠,待结肠规律的蠕动波出现后,分别加入NOS抑制剂L-NAME(100 μM)、ANO1 通道阻断剂 NPPB(5 μM)、SK3激动剂CyPPA(300nM)、SK3阻断剂apamin(300nM),检测给药前后CMCC。将结肠放入预先通混合气的4℃Krebs平衡溶液中。在解剖显微镜下,用眼科剪沿肠系膜方向小心地将肠系膜和脂肪组织清理干净,轻柔拉直结肠并用小细针固定结肠两端。使用1 ml注射器连接软胶管吸取Krebs溶液,将肠道内容物打散、冲出,反复操作,直至粪便全部排出。中空的小铁球(用于模拟粪便颗粒)插入微细玻璃管,并将玻璃管与小球由近端向远端插入结肠中。Krebs平衡溶液灌流,恒温箱将灌流槽的温度控制在36~37℃,同时不停输送混合气。结肠连同玻璃管放入灌流槽中稳定30 min左右。2根5/0丝线一端通过生物胶分别粘在近端和远端结肠的肠壁上,一端连接肌肉张力换能器。约30 min后旋转肌肉张力换能器旋钮,给予0.3 g张力。打开多道生理信号采集处理系统,记录AUC(即时间和收缩幅度的积分,表示整体收缩强度),计算加药前后500 s波形的AUC变化率。
1.3.4 平滑肌自发性收缩检测 采用电生理学实验。将平滑肌肌层沿着环形肌的方向剪成2 mm×4 mm大小的肌条,用4-0丝线系住两端,并打大小合适的空心结,实验过程中尽量避免对结肠组织进行不必要的钳夹与牵拉。分别加入 NOS 抑制剂 L-NAME(100 μM)、ANO1 通道阻断剂 NPPB(5 μM)、SK3 激动剂 CyPPA(300 nM)、SK3阻断剂apamin(300 nM),检测给药前后平滑肌自发性收缩。将结肠平滑肌肌条一端垂直且无张力悬浮固定于盛有10 ml 37℃Krebs平衡溶液的单腔器官浴槽中并连续通混合气,另一端用丝线固定于肌肉张力换能器(连接多道生理信号采集处理系统)上。肌条在单腔器官浴槽内每隔20 min更新Krebs平衡溶液,平衡30 min后给予初始张力0.3 g,待肌条出现自发性收缩且平稳后,加入通道激动剂或阻断剂,观察15 min并记录AUC,计算加药前后500 s波形的AUC变化率。
1.4 统计学处理 采用Origin数据分析软件。计量资料以表示,组间比较采用配对样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠近远端结肠平滑肌组织中c-Kit、ANO1蛋白表达比较 小鼠近端结肠平滑肌组织中c-Kit、ANO1蛋白表达分别为 3.24±0.45、1.73±0.35,均明显高于远端结肠的 1.79±0.26、1.34±0.15,差异均有统计学意义(均P<0.05),见图 1(插页)。
2.2 L-NAME、NPPB对小鼠近远端CMCC和平滑肌自发性收缩的影响 L-NAME给药后,结肠蠕动明显增加,平滑肌自发性收缩增强;近端CMCC增加至给药前的(158.7±6.5)%,平滑肌自发性收缩增强至(137.9±3.9)%;远端CMCC 增加至(114.6±7.6)%,平滑肌自发性收缩增强至(119.5±4.1)%,见图2a-d。NPPB 阻断 ANO1通道后,近远端CMMC明显被抑制,近端CMCC降低至给药前的(46.2±1.8)%,平滑肌自发性收缩降低至(48.9±6.7)%;远端 CMCC 降低至(84.2±2.9)%,平滑肌自发性收缩降低至(66.5±3.9)%,见图 2e-h。
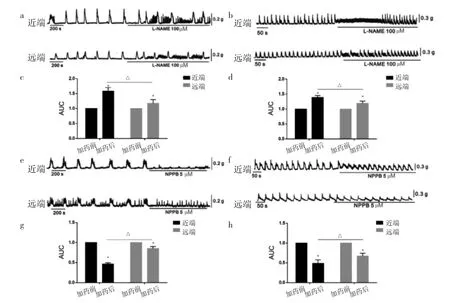
图2 L-NAME、NPPB对小鼠近远端CMCC和平滑肌自发性收缩的影响(a-d:L-NAME给药前后;e-h:NPPB给药前后;与加药前比较,*P<0.05;加药后近远端比较,△P<0.05;CMCC为结肠移行性复合运动)
2.3 小鼠近远端结肠平滑肌组织中PDGFRα、SK3蛋白表达比较 小鼠近端结肠平滑肌组织中PDGFRα、SK3 蛋白表达分别为 0.68±0.09、0.35±0.08,均明显低于远端结肠的 1.28±0.93、1.50±0.25,差异均有统计学意义(均 P<0.05),见图 3(插页)。
2.4 CyPPA、apamin对小鼠近远端CMCC和平滑肌自发性收缩的影响 CyPPA给药后,小鼠近远端CMMC被明显抑制;近端CMCC降低至给药前的(91.9±2.7)%,平滑肌自发性收缩降低至(55.2±5.7)%;远端CMCC降低至(79.7±2.2)%,平滑肌自发性收缩降低至(33.3±3.2)%,见图4a-d。apamin阻断SK3后,近远端CMMC均明显增强,近端CMCC增强至给药前的(106.2±7.7)%,平滑肌自发性收缩增强至(123.9±5.9)%;远端CMCC增强至(110.7±3.6)%,平滑肌自发性收缩增强至(147.5±6.8)%,见图4e-h。
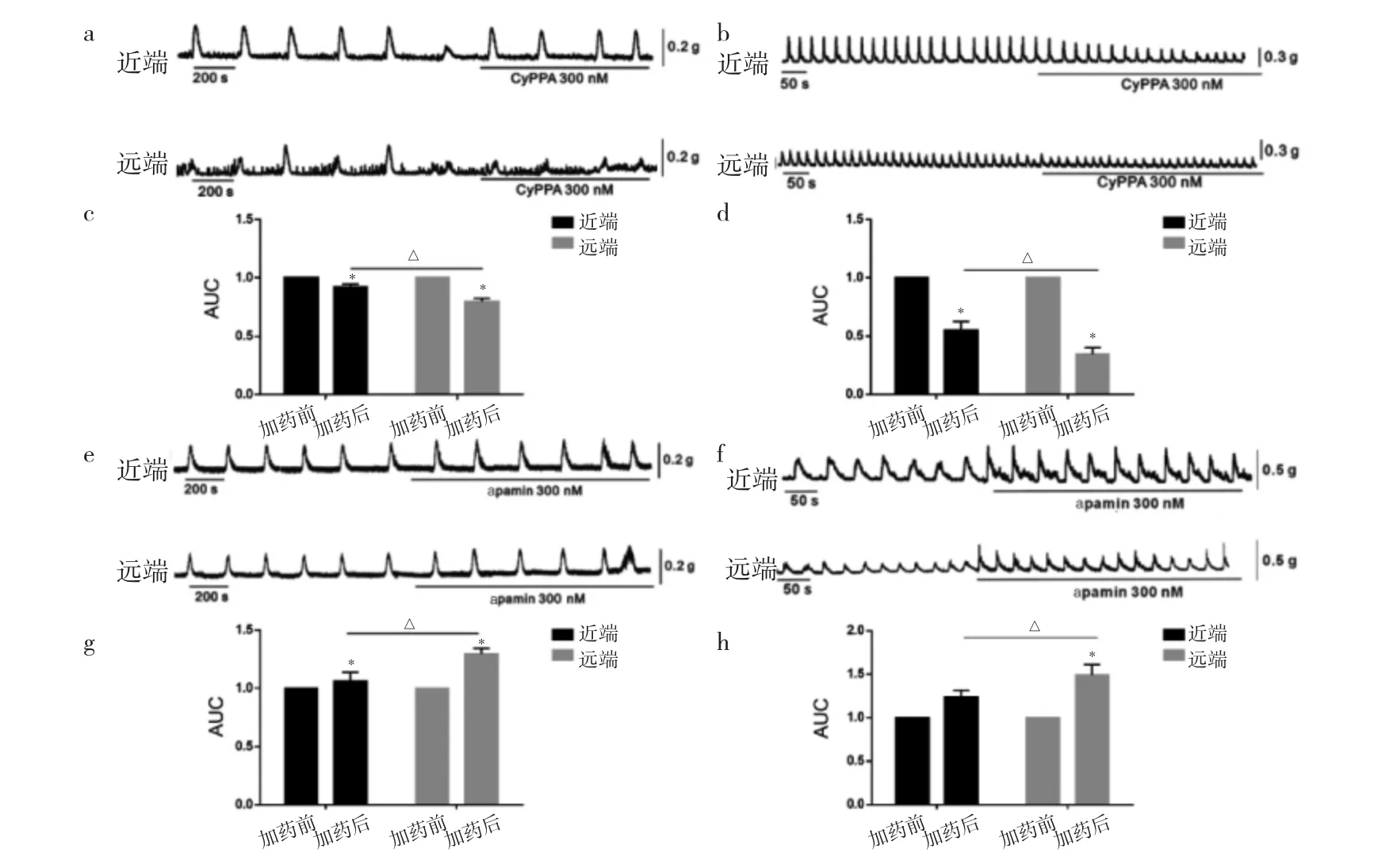
图4 CyPPA、apamin对小鼠近远端CMCC和平滑肌自发性收缩的影响(a-d:CyPPA给药前后;e-h:apamin给药前后;与加药前比较,*P<0.05;加药后近远端比较,△P<0.05;CMCC为结肠移行性复合运动)
3 讨论
20世纪70年代末基于电生理学和超微结构的观察,ICC最初被认为是起搏细胞[10-14]。在过去几年里,ICC的起搏器功能和ENS网络被认为是结肠运输中的独立系统。研究发现,结肠中的起搏器网络由肌间神经丛ICC和肌间ICC组成,且该网络通过肌间ICC中的胆碱能KV7.5通道抑制激活[15]。ICC的起搏器功能和ENS网络的协同作用在结肠传输过程中被证实。有关ICC顺序运作的转运机制认为,ICC不仅是消化道平滑肌自律性运动的起搏细胞,同时还介导神经信号的传递。ICC胞内IP3介导的ANO1通道产生自发的瞬间内向电流,引起ICC自发的瞬间去极化,进而引起胞膜上电压依赖性钙通道的开放,使胞外Ca2+内流,产生慢波[16]。2012年Koh等[17]首先在消化道平滑肌兴奋性的研究中提出SIP合胞体(平滑肌/ICC/PDGFRα阳性细胞)的概念。随后关于PDGFRα阳性细胞在平滑肌功能中的作用成为研究热点。研究表明,在SIP合胞体中,PDGFRα阳性细胞起抑制性作用,嘌呤能抑制性神经递质作用于PDGFRα阳性细胞上的P2Y1受体[3,18],同样激活PLC/IP3信号通路,激活SK3产生自发的瞬时外向电流,钾离子外流引起PDGFRα阳性细胞超极化,进而通过PDGFRα阳性细胞与平滑肌细胞之间的缝隙连接引起平滑肌细胞超极化[19-20]。因此认为胃肠道平滑肌的节律性收缩是外来神经、肠内神经丛与SIP合胞体共同协调作用的结果[9]。事实上,结肠具有多种运动模式,如CMMC、节段性活动、蠕动、张力性抑制等[8,21]。根据文献可知,小鼠结肠推进粪粒的速度与CMMC的传导速度相同,这表明CMMC是粪便推进的主要动力形式[22]。但无论传播形式如何,都有必要产生压力梯度,以确保粪便从结肠近端推进至远端。因此,为了进一步了解结肠传输动力的形成机制,笔者利用小鼠结肠标本研究SIP合胞体在结肠近远端的分布,并从功能上研究其内在传导机制。
本研究首先利用免疫组化染色、Western blot法检测SIP合胞体在结肠近远端的分布及特异性蛋白表达情况,结果发现在小鼠近端结肠ICC分布多于远端结肠,其中小鼠结肠平滑肌组织中c-Kit、ANO1蛋白在近端结肠的表达高于远端结肠;PDGFRα阳性细胞在小鼠远端结肠分布多于近端结肠,其中小鼠远端结肠平滑肌组织PDGFRα、SK3蛋白表达明显高于近端结肠。进一步作与CMMC实验和平滑肌肌条收缩实验,将正常小鼠整段结肠、平滑肌肌条放入水浴槽孵育一段时间,待出现并保持规律的蠕动波、收缩波后,加入L-NAME阻断一氧化氮的合成,记录到近端结肠CMMC和平滑肌自发性收缩的频率较远端结肠明显增强;加入ANO1通道阻断剂NPPB后,近端结肠CMMC和平滑肌自发性收缩的药物抑制作用较远端结肠更强;加入SK3激动剂CyPPA后,结肠平滑肌自发性收缩明显减弱,CMMC受到明显抑制,其中远端结肠的CMMC和肌条收缩对SK3激动剂CyPPA更加敏感;加入SK3阻断剂apamin后,结肠平滑肌自发性收缩和CMMC明显增强,同样远端结肠对apamin的作用更加敏感。以上实验结果提示,从小鼠近端结肠到远端结肠,PDGFRα阳性细胞呈递增性分布,在生理条件下ENS中的一氧化氮能抑制性神经通过一氧化氮作用于ICC,使CMMC频率保持合理的范围,维持正常的结肠传输功能。同时,笔者推测在ENS中,抑制性神经元在结肠自发性收缩中起主导作用。
综上所述,笔者推测在小鼠结肠SIP合胞体中,2种间质细胞ICC和PDGFRα阳性细胞呈规律性分布,即结肠近端到远端ICC分布呈递减性分布,而PDGFRα阳性细胞分布呈递增性分布,ICC和PDGFRα阳性细胞在结肠近远端的分布梯度与结肠近远端动力模式一致,使得结肠收缩时能形成结肠传输动力的有效梯度,即近端传输动力最强而远端最弱,从而保证粪便从近端结肠向远端结肠顺利排出。SIP合胞体中2种间质细胞的分布及其在结肠动力形成中的初步机制研究结果,可能为胃肠动力障碍性疾病的诊治提供新的思路和新的治疗靶点。

