甘露糖受体与慢性乙肝患者肝纤维化的关系研究
李阿利 虞邦映 邵辉 陈华忠 章霞 温寿向 朱坚胜
我国是全球乙肝感染率最高的国家之一。据报道,2016年我国慢性乙肝(chronic hepatitis B,CHB)患者约达3 000万例[1]。肝纤维化是各种病因引起的慢性肝脏损伤后的瘢痕修复反应,是疾病进展为肝硬化的必经阶段[2],而肝星状细胞激活是肝纤维化发生、发展的核心步骤[3]。甘露糖受体(mannose receptor,MR)是一种模式识别受体,在识别病原体、诱导细胞因子生成和保持机体内环境稳定中发挥重要作用,具有清除胶原蛋白的功能,与肝纤维化的形成密切相关[4]。近年来,MR成为国内外研究的热点,关于MR与肝脏疾病的相关研究越来越多,但其与CHB患者肝纤维化关系研究较少。本研究采用免疫组化法和RT-PCR法检测MR在CHB肝纤维化不同分期患者肝组织中的表达,以探讨其在肝纤维化发生、发展过程中的作用,现将结果报道如下。
1 对象和方法
1.1 对象 选取2016年11月至2018年10月在浙江省台州医院感染科住院且行肝脏穿刺活检的CHB患者 50例,其中男 28例,女22例;年龄 32~59(42.61±7.25)岁;肝纤维化分期:S0期 15 例,S1~2期 20 例,S3~4期15例。CHB肝纤维化不同分期组患者性别、年龄比较,差异均无统计学意义(均 P >0.05);ALT、AST、PLT 比较,差异均有统计学意义(均P<0.05),见表1。纳入标准:(1)年龄 30~60岁;(2)符合 2015年 CHB 防治指南中相关诊断标准[5];(3)经B超定位引导下肝脏穿刺活检术后肝组织病理学诊断明确为CHB。排除标准:(1)合并 HAV、HCV、HDV、HEV、HIV 感染;(2) 患有脂肪肝、酒精性肝病、自身免疫性肝病、肝硬化、肝恶性肿瘤、遗传代谢性肝病等疾病;(3)既往或近期接受过抗病毒治疗;(4)妊娠或哺乳期妇女;(5)患有甲状腺功能亢进症、糖尿病等代谢疾病;(6)患有严重的心、肺、脑、肾等重要脏器疾病。本研究经本院医学伦理委员会审查通过,所有患者签署知情同意书。
1.2 方法
1.2.1 肝纤维化分级评估 在超声定位下,采用16 G穿刺针进行肝脏穿刺活检术。取组织标本长度>1 cm,常规行HE染色,由2位高年资病理科医生独立阅片进行诊断。参照2015年CHB防治指南[5]和1995年国际认可的Scheuer评分系统[6]对肝组织进行纤维化分期,分为S0~4期。其中S0期为无纤维化,S1~2期为轻度纤维化,S3~4期为中重度纤维化。
1.2.2 肝组织MR蛋白表达检测 采用免疫组化法。将肝组织置于60℃恒温烤箱中预热2 h,切片,铺平,常规脱蜡至水,梯度乙醇脱水;置于PBS中,冲洗3次,5 min/次;0.3% H2O2、37 ℃恒温箱中孵育 15 min,消除内源性过氧化物酶活性,PBS冲洗3次,5 min/次;0.01 M枸橼酸钠进行抗原热修复,高压15 min,自然冷却至室温,PBS冲洗3次,5 min/次;滴加兔抗人 MR抗体(1∶800一抗稀释液稀释),4℃冰箱内孵育过夜,PBS冲洗3次,5 min/次;滴加兔鼠通用型二抗,37℃孵育30 min,PBS冲洗3次,5 min/次;DAB显色,苏木素复染,中性树脂封片,在光镜下观察并拍照。判读标准:在光镜下观察,细胞质或细胞膜上棕黄色颗粒提示MR阳性表达细胞。每张切片随机选取5个高倍镜视野,每个视野下计算100个细胞中MR阳性表达细胞数,计算阳性细胞百分比并取平均值。染色强度评分:无染色为0分,浅黄色染色为1分,棕黄色染色为2分,棕褐色染色为3分;阳性细胞百分比评分:0%为0分,1%~为1分,26%~为2分,51%~为3分,76%~100%为4分;免疫组化评分为染色强度评分与阳性细胞百分比评分的乘积。根据免疫组化评分评估MR蛋白表达强度:<2分为(-),2~3分为(+),4~6 分为(++),>6分为(+++)。
1.2.3 肝组织 MR、NF-κB、转化生长因子-β1(transforming growth factor,TGF-β1)、α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)mRNA表达检测 采用RT-PCR法。采用Trizol法提取肝组织总RNA,按照两步法RT-PCR试剂盒操作说明进行cDNA逆转录与PCR扩增,将PCR产物经20 g/L琼脂糖凝胶电泳后,观察扩增条带。引物序列见表2。采用2-ΔΔCt法计算肝组织 MR、NF-κB、TGF-β1、α-SMA mRNA 相对表达量,所有样本均重复3个孔,取平均值。

表2 MR、α-SMA、NF-κB、TGF-β1及内参GAPDH引物序列
1.3 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料组间比较采用χ2检验;等级资料组间比较采用Kruskal-Wallis H检验,两两比较采用Nemenyi检验。计量资料双变量之间的相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 CHB肝纤维化不同分期组患者MR蛋白表达比较 MR在CHB肝纤维化不同分期组肝组织上均有表达,主要表达于肝血窦内巨噬细胞的胞膜和胞质上,在肝脏内皮细胞、淋巴细胞的胞膜和胞质中也有部分表达,染色清晰,免疫组化结果见图1(插页)。随着肝纤维化程度的加重,MR表达逐渐增强(P<0.05),见表3。

表3 CHB肝纤维化不同分期组MR蛋白表达强度比较(例)
2.2 CHB肝纤维化不同分期组肝组织MR、NF-κB、TGF-β1、α-SMA mRNA表达比较 CHB肝纤维化不同分期组肝组织 MR、NF-κB、TGF-β1、α-SMA mRNA表达比较,差异均有统计学意义(F=32.50、24.35、96.42、54.37,均 P<0.05);与 S0组比较,S1~2组、S3~4组肝组织MR、NF-κB、TGF-β1、α-SMA mRNA 表达均明显增加(均 P<0.05);与 S1~2组比较,S3~4组肝组织 MR、NF-κB、TGF-β1、α-SMA 表达均明显增加(均 P<0.05),见图 2。2.3 CHB患者肝组织MR mRNA表达与NF-κB、TGF-β1、α-SMA mRNA表达的相关性 CHB患者肝组织MR mRNA 表达与 NF-κB、TGF-β1、α-SMA mRNA 表达均呈正相关(r=0.653、0.811、0.785,均 P<0.05),见图 3。
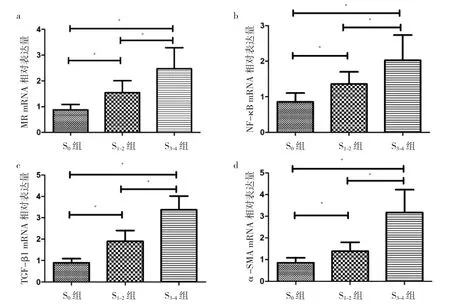
图2 CHB肝纤维化不同分期组肝组织MR、NF-κB、TGF-β1、α-SMA mRNA表达比较(CHB为慢性乙肝;MR为甘露糖受体;TGF-β1为转化生长因子-β1;α-SMA为α-平滑肌肌动蛋白;*P<0.05)
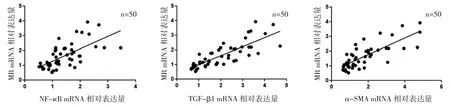
图3 CHB患者肝组织MR mRNA表达与NF-κB、TGF-β1、α-SMA mRNA表达相关性的散点图(CHB为慢性乙肝;MR为甘露糖受体;TGF-β1为转化生长因子-β1;α-SMA为α-平滑肌肌动蛋白)
3 讨论
慢性HBV感染是全球公共卫生问题之一。据WHO报道,全球HBV感染率约为3.5%[7]。据中国疾病预防控制中心统计,自1992年全面实行乙肝疫苗接种后,虽然母婴垂直传播率和婴幼儿时期HBV感染率明显降低,但是我国HBV携带者的比例仍较高[8]。
肝纤维化是CHB发展至肝硬化、终末期肝病甚至肝细胞癌的重要阶段[9-10]。肝星状细胞的活化是导致肝纤维化发展的关键环节[4]。TGF-β1是导致肝纤维化的关键因子,能激活肝星状细胞并使之发生表型改变,从而表达大量α-SMA,促进细胞外基质的过度沉积与生成,最终形成肝纤维化[11-12]。另外,NF-κB具有转录激活功能,参与肝星状细胞的活化调节,对纤维化的发生、发展起着重要作用[13]。本研究结果发现,肝组织NF-κB、TGF-β1、α-SMA mRNA表达随着肝纤维化程度增加而升高,进一步证实 TGF-β1、α-SMA、NF-κB 与肝纤维化严重程度密切相关。
MR是一种Ca2+依赖的1型跨膜蛋白受体,主要表达于巨噬细胞以及未成熟树突状细胞等免疫细胞表面,在调节免疫应答和维持糖蛋白稳态方面发挥重要作用[14]。MR结构中的FNⅡ成分可结合Ⅰ、Ⅱ、Ⅲ、Ⅳ型胶原蛋白,具有清除胶原蛋白的功能,与肝纤维化发生、发展密切相关[5]。近年来,MR与肝脏疾病的研究也取得了一些进展。Ren等[15]研究发现,MR在肝癌组织中的表达明显高于正常癌旁组织中的表达,且在肝硬化、TNM分期差、Child Pugh级别高的肝癌患者中表达更强;此外,肝癌组织中MR高表达者总生存率和无病生存率明显降低。本研究采用免疫组化法检测肝组织MR蛋白表达,发现MR主要表达在巨噬细胞的胞质和胞膜上,肝内皮细胞、淋巴细胞上也有分布;在S0期患者中有少量MR表达,在S1~4期患者中MR蛋白表达随着肝纤维化程度的增加而增强。同时本研究还采用RT-PCR法进一步检测了肝组织中MR mRNA表达,与免疫组化结果一致。
NF-κB在巨噬细胞中的激活后,可以在某些病理条件下将巨噬细胞驱动至M1或M2极化,并在疾病进展或消退中发挥重要作用[16]。Yeh等[17]研究发现三氧化矿物聚集体能通过 Axl、Akt、IKKa/b、IkBa 和 p65 的磷酸化激活Axl/Akt/NF-κB信号通路,诱导巨噬细胞向M2表型极化,上调 IL-10、TGF-β1、MR 表达,其中 MR表达呈时间依赖性增加;而AXL/Akt/NF-κB抑制剂可抑制M2相关细胞因子表达,使MR表达减少。NF-κB是M2巨噬细胞表型的关键调控因子,MR通常被认为是M2巨噬细胞的表面标志物,笔者推测MR与NF-κB可能共同参与疾病的发生、发展。本研究相关性分析结果显示,MR mRNA 表达与 NF-κB、TGF-β1、α-SMA mRNA表达呈高度正相关,提示MR可能通过NF-κB通路参与肝纤维化的发生、发展。
综上所述,随着肝纤维化程度的增加,CHB患者肝组织 MR 表达逐渐上调,且与 NF-κB、TGF-β1、α-SMA表达均呈正相关。笔者推测MR可能通过NF-κB通路参与肝纤维化的发生、发展,但其调控作用及具体机制有待后续细胞及动物实验作进一步证实。

