利拉鲁肽基于 NF-κB/NLRP3通路介导的焦亡途径对小鼠动脉粥样硬化的干预作用研究
陈金晖 陈青青 梅统 王伟林 张岚 卢永明
动脉粥样硬化(atherosclerosis,AS)是心血管疾病的病理基础,是心血管疾病相关死亡的重要原因[1]。AS特征是弹性动脉内膜中纤维组织和脂质的沉积,导致血栓形成和以血管壁增厚和硬化为特征的结构破坏[2]。研究发现,动脉内皮细胞焦亡与AS的发生、发展密切相关[3]。细胞焦亡是近年研究发现的一种程序性细胞死亡新形式——细胞炎性死亡,作为固有死亡的一种形式,可参与AS的形成、发展并影响斑块的稳定性[4]。因此,防治AS的发生与发展,探究内皮细胞焦亡的发生机制或可作为重要突破口。NF-κB信号通路异常是导致AS形成的一个重要影响因素,它涉及AS形成过程中的多种病理过程[5]。NOD样受体蛋白3(nod-like receptor protein 3,NLRP3)炎症小体为先天的免疫信号复合物,其激活可通过不同的信号通路促进AS[6]。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)作为一种内源性促胰岛素激素,具有良好的降糖活性。Patel等[7]研究发现,GLP-1激动剂长期治疗可改善饮食引起的血脂异常和AS。目前,关于GLP-1通过NF-κB/NLRP3通路对AS的作用机制研究少见。基于此,本研究采用GLP-1类似物利拉鲁肽干预载脂蛋白E基因敲除(ApoE-/-)小鼠AS模型,通过基于NF-κB/NLRP3通路介导的焦亡途径分析利拉鲁肽干预对AS小鼠的保护作用,为AS的治疗提供新思路。
1 材料和方法
1.1 材料
1.1.1 实验动物 6周龄SPF级雄性ApoE-/-小鼠(品系C57BL/6J)及C57BL/6J正常小鼠,体质量18~20 g,均购自杭州子源实验动物科技有限公司,动物生产许可证号:SCXK(浙)2019-0004,动物使用许可证号:SYXK(浙)2019-0024,动物质量合格证号:SL304725。所有动物饲养在12 h光/暗周期中,自由进食、进水,温度为(20±2)℃,湿度为(50±5)%。
1.1.2 主要试剂和仪器 普通饲料(批号:D12325)和高脂饲料(批号:D12492)均购自上海睿安生物科技有限公司;利拉鲁肽注射液(批号:20200509)购自诺和诺德(中国)制药有限公司;GLP-1受体抑制剂exendin(9-39)(批号:HY-P0293)购自美国 APExBIO 公司;IL-6 ELISA 试剂盒(批号:ab178013)、IL-1β ELISA 试剂盒(批号:ab197742)、TNF-α ELISA 试剂盒(批号:ab181421)均购自美国Abcam公司;HDL-C测定试剂盒(批号:A112-1-1)、LDL-C 测定试剂盒(批号:A113-1-1)、TG测定试剂盒(批号:A110-1-1)、TC测定试剂盒(批号:A111-1-1)均购自南京建成生物工程研究所;HE染色试剂盒(批号:C0105)购自上海碧云天生物科技有限公司;凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)一抗(批号:67824)、半胱天冬酶-1(Caspase-1)一抗(批号:24232)、NLRP3 一抗(批号:15101)、NF-κB p65 一抗(批号:8242)、p-NF-κB p65一抗(批号:3033)、β-actin一抗(批号:6037)及羊抗小鼠二抗(批号:7074)均购自美国Cell Signaling Technology公司;酶标仪(型号:VICTOR X)购自德国Perkin Elmer公司;光学显微镜(型号:Ni-E)购自日本Nikon公司;蛋白电泳仪(型号:DYCZ-40B)购自上海启闵生物科技有限公司;凝胶成像仪(型号:GIS-630)购自杭州Miulab公司。
1.2 方法
1.2.1 AS小鼠模型的构建与分组 取12只C57BL/6J正常小鼠作为普通饮食组,即对照组(A组)。36只ApoE-/-小鼠随机分成高脂饮食组即AS模型组(B组)、高脂饮食+利拉鲁肽组(C组)和高脂饮食+利拉鲁肽+GLP-1受体抑制剂 exendin(9-39)组(D 组),每组12只。A组小鼠以普通饲料喂养,B、C、D组小鼠以高脂饲料(1%胆固醇+15%猪油)喂养,饮用水均为蒸馏水,喂养过程中,饮水及饲料不限量[8]。AS小鼠造模成功标准:HE染色镜下观察到小鼠主动脉血管壁明显增厚,有斑块形成,管腔狭窄,局部有钙化颗粒物沉淀[9]。C组小鼠在喂养高脂饲料的同时,每天背部皮下注射0.6 mg/kg利拉鲁肽(约0.5 ml)[10],D组小鼠背部皮下注射0.6 mg/kg利拉鲁肽+22 mol/kg exendin(9-39)(约 0.5 ml),A 组和B组小鼠背部皮下注射0.5 ml的0.9%氯化钠注射液。所有小鼠均饲养在实验室SPF级动物房。小鼠每周称重1次,并及时更换垫料。
1.2.2 样本采集 各组小鼠饲养至18周龄后,摘眼球取血,离心取上清液,置于-20℃中保存备用。然后颈椎脱位处死小鼠,在无菌超净工作台上打开小鼠胸腔、腹腔,取升主动脉根部及下端至膈的主动脉组织,用无菌0.9%氯化钠溶液冲洗。剪取距升主动脉根部约0.5 cm的动脉组织置于4%多聚甲醛中固定,用于病理学观察;然后仔细剥离出其余主动脉组织的内膜,液氮速冻后置于-80℃冰箱中保存备用。
1.2.3 血清炎性因子水平检测 采用ELISA试剂盒对各组小鼠血清中IL-6、IL-1β、TNF-α水平进行检测,具体操作步骤严格按照试剂盒说明书进行,用酶标仪在450 nm波长处测定吸光度。
1.2.4 血清中血脂水平检测 根据试剂盒说明书操作,对各组小鼠血清中HDL-C、LDL-C、TG、TC的水平进行检测。
1.2.5 主动脉病理学观察 取出升主动脉根部组织,脱水透明,浸蜡包埋,切片,HE染色,于光学显微镜下观察,并利用Image J软件分析各组小鼠主动脉内膜中层厚度(intima-media thickness,IMT)及主动脉AS面积与所取血管面积比值。
1.2.6 主动脉内膜 NF-κB p65、p-NF-κB p65、NLRP3、Caspase-1、ASC蛋白表达水平检测 采用Western blot法。取出主动脉内膜组织,匀浆后提取总蛋白,BCA法检测蛋白含量,聚丙烯酰胺凝胶电泳分离蛋白,转膜封闭加一抗(NF-κB p65、p-NF-κB p65、NLRP3、Caspase-1、ASC、β-actin,稀释倍数均是 1∶500),4 ℃条件下孵育过夜,洗膜后加入二抗(1∶3 000),室温孵育 2 h,洗膜显色曝光,使用凝胶成像系统观察并以β-actin为内参蛋白,分析各蛋白的相对表达水平。
1.3 统计学处理 采用SPSS 22.0统计软件;计量资料以表示,多组比较采用单因素方差分析,两两比较采用SNK-q检验;P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠血清IL-6、IL-1β、TNF-α 水平比较 与A组相比,B组和D组小鼠血清中IL-6、IL-1β、TNF-α水平均升高(均P<0.05);与B组相比,C组小鼠血清中 IL-6、IL-1β、TNF-α 水平均降低(均 P<0.05);与 C组相比,D组小鼠血清中IL-6、IL-1β、TNF-α水平均升高(均 P<0.05)。见表 1。
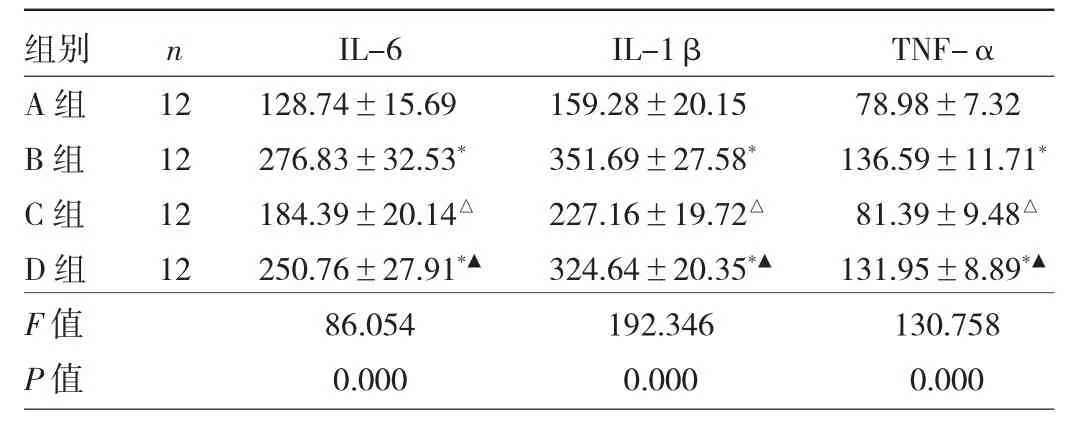
表1 4组小鼠血清IL-6、IL-1β、TNF-α水平比较(pg/ml)
2.2 4组小鼠血清HDL-C、LDL-C、TG、TC水平比较 与A组相比,B组和D组小鼠血清LDL-C、TG、TC水平均升高(均 P<0.05),HDL-C 水平均降低(均 P<0.05);与B组相比,C组小鼠血清LDL-C、TG、TC水平均降低(均 P<0.05),HDL-C水平升高(P<0.05);与C组相比,D组小鼠血清LDL-C、TG、TC水平均升高(均P<0.05),HDL-C水平降低(P<0.05)。见表2。
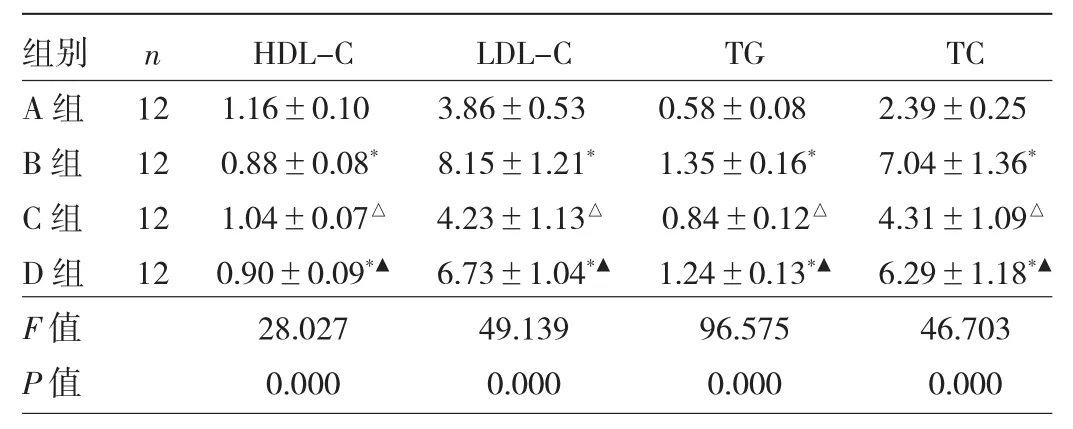
表2 4组小鼠血清HDL-C、LDL-C、TG、TC 水平比较(mmol/L)
2.3 4组小鼠主动脉病理学变化比较 A组小鼠主动脉血管壁未见明显改变;B组小鼠主动脉血管壁明显增厚,管腔狭窄,可见大量斑块形成,有大量炎性细胞浸润及脂质沉淀;C组小鼠主动脉亦可见血管壁增厚,斑块形成,但与B组相比,增厚程度明显减轻,斑块面积显著减小,仅可见少量炎性细胞浸润;D组小鼠主动脉血管壁增厚程度、斑块形成面积及炎性细胞浸润数量介于B组、C组之间,见图1(插页)。与A组相比,B组和D组小鼠主动脉IMT均升高(均P<0.05);与B组相比,C组小鼠主动脉IMT水平降低(P<0.05);与C组相比,D组小鼠主动脉IMT水平升高(P<0.05);见表 3。

表3 4组小鼠主动脉IMT比较(mm)
2.4 4组小鼠主动脉AS面积与所取血管面积比值比较 与A组相比,B组和D组小鼠主动脉AS面积与所取血管面积比值均升高(均P<0.05);与B组相比,C组小鼠主动脉AS面积与所取血管面积比值降低(P<0.05);与C组相比,D组小鼠主动脉AS面积与所取血管面积比值升高(P<0.05)。见表4。
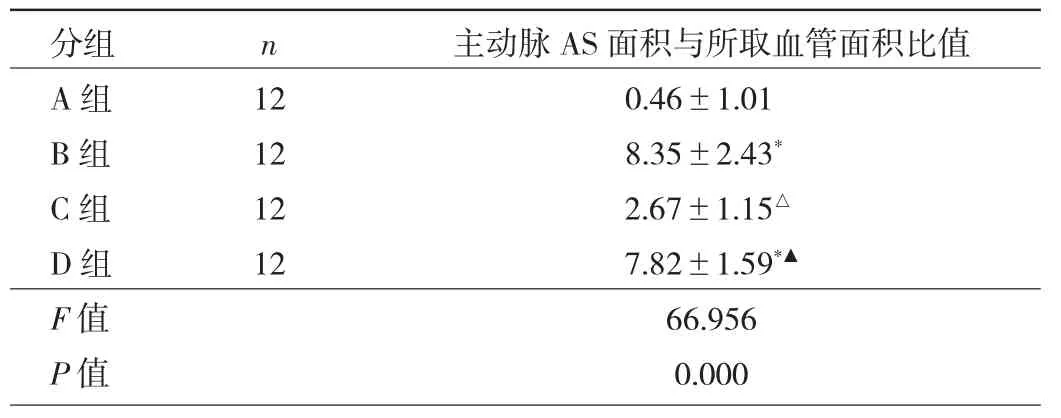
表4 4组小鼠主动脉AS面积与所取血管面积比值比较(%)
2.5 4 组小鼠主动脉内膜 NLRP3、Caspase-1、ASC、p-NF-κB p65、NF-κB p65蛋白表达水平比较 与A组相比,B组和D组小鼠主动脉内膜NLRP3、Caspase-1、ASC、p-NF-κB p65/NF-κB p65 蛋白表达水平均升高(均P<0.05);与B组相比,C组小鼠主动脉内膜NLRP3、Caspase-1、ASC、p-NF-κB p65/NF-κB p65 蛋白表达水平均降低(均P<0.05);与C组相比,D组小鼠主动脉内膜 NLRP3、Caspase-1、ASC、p-NF-κB p65/NF-κB p65蛋白表达水平均升高(均P<0.05)。见图2。
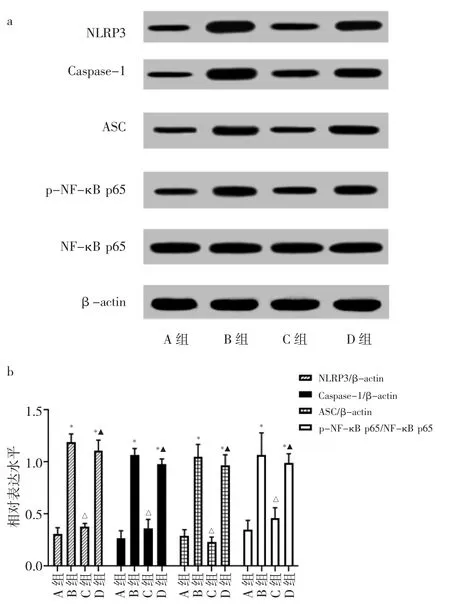
图2 4组小鼠主动脉内膜NOD样受体蛋白3(NLRP3)、半胱天冬酶 -1(Caspase-1)、凋亡相关斑点样蛋白(ASC)、磷酸化NF-κB p65(p-NF-κB p65)、NF-κB p65 蛋白表达水平比较(a:蛋白表达电泳图;b:蛋白表达水平比较;与A组比较,*P<0.05;与B组比较,△P<0.05;与 C 组比较,▲P<0.05)
3 讨论
AS是心血管疾病的重要病理生理过程,涉及先天性和适应性免疫炎症机制参与,是当今世界心血管疾病和死亡的主要原因[11]。本研究中给予ApoE-/-小鼠高脂饮食饲养以构建AS小鼠模型,结果发现,AS小鼠主动脉在光学显微镜下可见血管壁明显增厚,管腔狭窄,并有大量斑块及炎性浸润,主动脉IMT、主动脉AS面积与所取血管面积比值及血清中LDL-C、TG、TC水平升高,HDL-C水平降低,揭示AS小鼠模型构建成功。
越来越多证据表明,炎症与AS的进展密切相关。在AS的发生、发展过程中,各种炎症细胞和炎性介质在脂肪条纹以及纤维斑块、动脉粥样硬化斑块和不稳定斑块的形成和破裂中发挥作用[12]。NF-κB是一种氧化还原敏感的转录因子,调节免疫和炎症反应的各个方面[13]。NF-κB 通路的激活将导致 IL-1β、IL-6和 TNF-α等促炎细胞因子的过度产生[14]。本研究AS模型小鼠血清IL-6、IL-1β、TNF-α水平均升高,主动脉内膜p-NF-κB p65/NF-κB p65蛋白水平升高,表明AS小鼠体内NF-κB p65通路处于活化状态,炎性反应增强,造成主动脉血管病理学损伤。研究发现,NLRP3炎症小体可通过募集ASC并促进Caspase-1激活来调节内皮细胞的焦亡[15]。一些研究已经证明多达70种Caspase-1蛋白底物在AS和血管炎症中起作用[16]。活化的Caspase-1可引起促细胞凋亡的促炎形式,称为细胞焦亡,其特征是细胞溶解并将细胞质内含物释放到细胞外空间[17],从而导致炎症。本研究AS小鼠主动脉内膜中NLRP3、Caspase-1、ASC蛋白表达水平均升高,说明细胞焦亡相关蛋白在AS小鼠主动脉内膜中大量表达,其介导的细胞焦亡与AS发生进程密切相关。
利拉鲁肽作为GLP-1类似物,常用于糖尿病的治疗,在临床使用过程中表现出良好的安全性[18]。Rakipovski等[19]研究发现,利拉鲁肽可通过抑制炎症反应,减轻AS病变和保护血管内皮,而且该功能的发挥与降糖作用无关。本研究中,AS小鼠在利拉鲁肽作用下,小鼠主动脉血管壁的增厚程度减轻,斑块面积减少,仅可见少量炎性细胞浸润,血清炎性因子IL-6、IL-1β、TNF-α水平降低,LDL-C、TG、TC水平降低,HDL-C水平升高,主动脉内膜中p-NF-κB p65/NF-κB p65蛋白表达水平降低。有研究在评估利拉鲁肽对TNF-α诱导的人脐静脉内皮细胞损伤时发现,利拉鲁肽可通过抑制NF-κB激活对内皮细胞产生明显的抗氧化和抗炎作用[20]。这提示利拉鲁肽可能通过抑制NF-κB激活,减轻AS小鼠炎症反应,减少血管壁斑块沉积。另外,利拉鲁肽预处理可有效抑制TNF-α和NLRP3炎症小体活化,抑制TNF-α和缺氧导致的心肌细胞焦亡,发挥心脏保护作用[21]。在研究利拉鲁肽对非酒精性肝炎中发现,利拉鲁肽可通过线粒体抑制NLRP3炎症小体诱导的细胞焦亡,减慢非酒精性脂肪性肝炎的进程[22]。本研究中,利拉鲁肽可明显降低AS小鼠主动脉内膜中NLRP3、Caspase-1、ASC蛋白表达水平;而与利拉鲁肽组相比,利拉鲁肽和GLP-1受体抑制剂exendin(9-39)的双重作用下的AS小鼠的病理学变化加重,血清炎症因子水平、血脂水平及主动脉内膜中NLRP3、Caspase-1、ASC蛋白表达水平均升高,表明利拉鲁肽可抑制AS小鼠主动脉内膜中NLRP3炎症小体活化,且GLP-1受体抑制剂可逆转利拉鲁肽对AS小鼠炎症反应及主动脉病理学损伤的改善作用。
综上所述,利拉鲁肽可能通过抑制NF-κB/NLRP3信号通路,减轻AS小鼠的主动脉内膜中的炎症反应和细胞焦亡,改善主动脉病理学损伤。但GLP-1对AS小鼠的作用机制比较复杂,其类似物利拉鲁肽的药效作用仍需进一步研究。

