糖尿病性乳腺病2例诊治分析并文献复习
吕振晔 汤鸿超 李永峰 孟旭莉
糖尿病性乳腺病(diabetic mastopathy,DM)是一种罕见的特殊类型乳腺炎,发病率占所有乳腺良性疾病的1%[1]。DM发生与糖尿病、自身免疫性疾病有关,以淋巴细胞性小叶炎、乳管炎、血管炎和致密的瘢痕疙瘩纤维化伴上皮样成纤维细胞为特征[2],也称为硬化性淋巴细胞性小叶性乳腺炎。DM由Soler等[3]于1984年首次报道,DM可发生于1、2型糖尿病患者中,但多见于1型糖尿病患者[4]。DM常表现为无痛、不可活动的质硬肿块,且部分患者影像学表现与乳腺癌类似,极易造成误诊。本文回顾2021年浙江省人民医院收治的2例DM患者的临床特征,分析其临床表现、影像学特征和病理学特征,并结合文献复习总结DM的特征,以期为临床医师进一步认识DM提供帮助。
1 临床资料
1.1 一般资料 例1女,63岁。主诉:体检发现左乳肿块4 d,偶感双侧乳房胀痛,余无明显不适。患者于2021年1月11日入院。患者有2型糖尿病病史20余年,血糖控制不佳。查体:双乳对称,左侧乳房12点钟B环位置可及直径约3 cm大小肿块,质硬,边界不清。右侧未及肿块,双侧腋下未及肿大淋巴结。
例2女,65岁。主诉:发现双乳肿块半年,无乳头溢液,无乳房疼痛,无桔皮征,有酒窝征。患者于2021年1月4日入院。患者有2型糖尿病病史20余年,血糖控制不佳。查体:左乳乳头后方可及大小约4 cm×4 cm肿块,质硬,活动度差,边界不清;右乳乳头后方可及约直径约5 cm肿块,质硬,活动度差,边界不清,双侧腋下未及肿大淋巴结。
1.2 影像学检查 例1乳腺超声检查示:左乳腺体层内12点钟B环位置可见团片状低回声,腺体回声致密,彩色多普勒(color Doppler flow imaging,CDFI)未见明显异常血流信号(图1)。钼靶检查示:双侧乳内见散在结节状、小斑片致密影,部分悬韧带增厚,未见明显恶性分布钙化灶(图2)。乳腺MRI检查示:左乳上象限中部见非肿块样强化灶,T2WI呈高低混杂信号,T1WI呈稍低信号,弥散加权成像(diffusion-weighted imaging,DWI)呈不均匀稍高信号增强,动脉期不均匀强化,呈区域性分布,时间信号曲线呈Ⅰ型或Ⅱ型,BI-RADS 4类(图3),请结合临床,必要时穿刺活检。
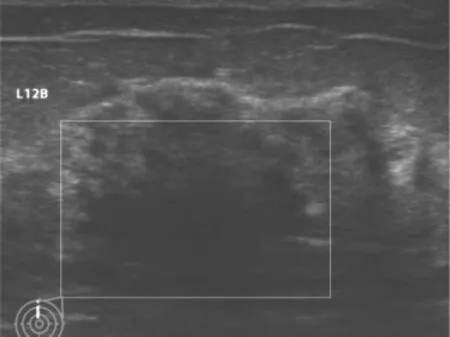
图1 例1左乳超声检查所见

图2 例1左乳钼靶检查所见

图3 例1乳腺MRI检查所见
例2乳腺超声检查示:双乳房乳头后方腺体层可见低回声区,较大的范围约40 mm×17 mm×42 mm(左乳),51 mm×23 mm×51 mm(右乳),边界欠清,形态欠规则,内部回声不均匀,内部可见强光斑,BI-RADS 4B类(图4-5)。乳腺MRI检查示:双侧乳头后方腺体欠规整,见不规则团片状等T1短T2信号影,右侧较明显,大小范围约52 mm×48 mm,DWI呈高信号,增强扫描呈斑片状强化,随时间推移强化范围增大,考虑BIRADS 4类(图6)。

图4 例2左乳超声检查所见

图5 例2右乳超声检查所见

图6 例2乳腺MRI检查所见
1.3 手术方法 该2例患者入院后应用麦默通真空辅助乳腺微创旋切系统进行穿刺活检术。患者取平卧位,超声引导乳房肿块,予1%利多卡因局部浸润麻醉,取4 mm切口,活检枪穿刺进入肿块下方,旋切肿块取组织活检,送常规病理学检查。4-0可吸收线皮内缝合切口,加压包扎。
1.4 病理学检查 例1常规病理学检查示:乳腺组织萎缩,小叶内导管周围大量淋巴细胞浸润,间质纤维组织增生胶原化(图7)。例2病理学检查示:“左侧乳头后方肿块”乳腺小叶结构存在,个别乳腺小叶有导管萎缩,导管间大量淋巴细胞浸润,周围纤维组织增生。个别乳腺导管大汗腺化生,未见明确血管炎改变。“右乳12点钟方向乳腺穿刺组织”符合纤维囊性乳腺病(图8-9)。
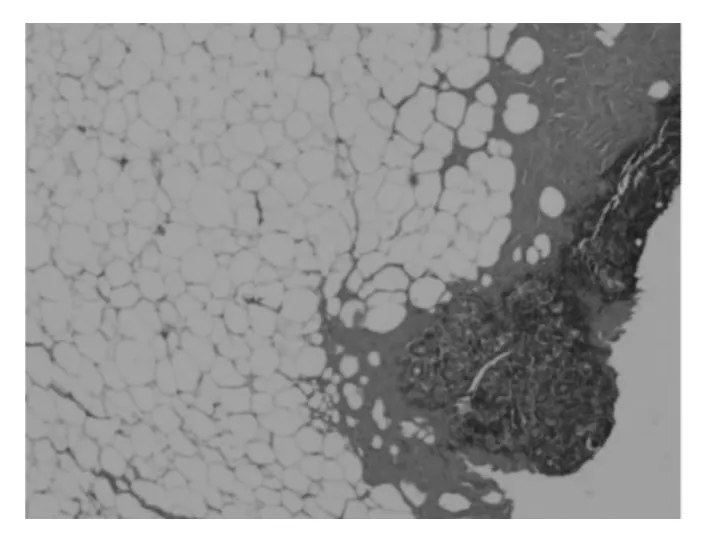
图7 例1乳腺组织病理检查所见(HE染色,×40)

图8 例2左乳腺组织病理检查所见(HE染色,×40)

图9 例2右乳腺组织病理检查所见(HE 染色,×40)
1.5 术后随访 该2例患者术后病理学检查排除乳腺恶性肿瘤,内分泌科就诊,控制血糖。3个月后常规门诊随访,复查乳腺超声,肿块大小未见明显改变,均建议门诊长期随访。
2 讨论
DM是一种罕见的良性乳腺疾病。研究发现,DM与长期存在的1型糖尿病相关,在2型糖尿病患者中发生不多[1,5],但在使用胰岛素治疗的2型糖尿病患者中DM的发生率会相对较高[6]。本文报道的这2例患者均为2型糖尿病患者,且并未长期使用胰岛素治疗。
DM发生的病理生理机制尚不清楚,猜测是长期的体内高血糖状态可能诱导糖基化并导致糖基化产物水平过高而促进免疫反应,引起胶原蛋白的生成增加及蛋白质的降解减少,最终导致细胞外基质膨胀[1,7]。本文2例患者的糖尿病史均超过20年,在病因上支持这一假说。
DM主要临床表现为无痛性乳房肿块,肿块特点包括质地硬,不规则,边界不清。DM可以发生在单侧乳腺或双乳乳腺,双侧同时累及的约占60%[8]。这些肿块的临床表现与乳腺癌非常相似。
Suvannarerg等[9]研究指出,DM的乳腺钼靶检查表现以局灶不对称为主(53.3%),无钙化出现;超声上表现为低回声肿块,主要特征为不规则形状(81.3%)、边缘模糊(100%)、平行向胸壁(93.8%)、低回声(87.5%)和后阴影(62.5%),彩色多普勒超声检查的10个病灶均无血管病变,无腋窝淋巴结肿大。病变的超声特征分为 BI-RADS分类 4B(31.3%)或 4C(68.8%)。DM 的MRI可表现为非肿块样强化,有学者认为这可以作为与乳腺癌鉴别的一个特征[10-11]。由于单纯影像学检查上的表现均与乳腺癌类似,无法准确鉴别,因此需要穿刺病理学检查明确诊断。
DM病理组织学具有特征性改变,具体表现为乳腺终末小叶单位的淋巴细胞浸润,可有数量不等的浆细胞间质硬化透明变,其内常见有淋巴细胞性小血管炎及血管周围炎,小叶可萎缩消失[12]。该病早期表现为小叶增生,小叶、导管及血管周围可见大量淋巴细胞并伴有数量不等的浆细胞、单核细胞等。细胞浸润以成熟的B细胞为主。小叶间质内的上皮样成纤维细胞也经常被观察到[13]。但有时候可以观察到单个细胞与侵袭性小叶癌有类似表现[1]。随着疾病进一步发展,小叶间会逐渐纤维化,纤维母细胞增生,从而出现上皮样纤维母细胞浸润。随着小叶导管的萎缩以及腺泡数量的减少,大量的淋巴细胞存在于小叶中,取代小叶并形成淋巴滤泡,同时伴有间质小血管炎,间质进一步玻璃样变,此时称为淋巴组织滤泡增生,也称假性淋巴瘤[2]。
DM的治疗目前尚无规范指南,有研究者统计,160例DM患者采用了手术治疗,其中34例术后复发,复发率达21.25%[14]。有学者认为DM的手术切除治疗应避免,因为手术会刺激病情进展,而且切除后复发率高,主张确诊DM后定期随访即可[7]。有研究者对10例病理学诊断为DM的患者进行超声随访,随访时间平均40.4个月,其中3例病灶增大,3例病灶自行消失,4例保持不变[9]。临床上对于DM目前没有标准的治疗方案,当影像学检查无法明确,可做穿刺病理学检查明确。由于DM患者通常肿块较大,手术范围较大,而术后复发率较高,且没有证据表明DM会诱发乳腺癌,笔者团队同样不主张手术治疗DM,在病理学检查明确后,控制患者血糖水平,每年超声检查随访即可。
目前关于DM的报道不多,也没有相应的临床指南对DM的治疗和随访提供指导意见,现有的病例报告大多推荐患者每年进行随访,包括体格检查、乳房X线检查和超声检查。到目前为止,还没有报告DM引起的恶性肿瘤病例。因此,临床医生应认识DM这种疾病,在糖尿病患者并发乳腺肿块时需要结合病史、体格检查及辅助检查(包括穿刺活检)与乳腺癌进行鉴别,以避免过度的手术治疗。由于DM的发病机制尚不明确,乳腺肿块有可能会随着时间延长而不断增大,造成患者多次穿刺活检而产生焦虑情绪。对此,有必要进一步开展研究来探讨DM的病因及合适的药物干预方法。

