ABCG2基因多态性与小儿急性淋巴细胞白血病大剂量甲氨蝶呤化疗效果及毒性反应的关系
王华 应勤来 刘晓琳 王天骄 朱佳聪 滕懿群
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童常见肿瘤之一。甲氨蝶呤(methotrexate,MTX)作为大多数化疗方案中抗癌剂的核心,在ALL临床治疗上取得了明显疗效,但大剂量MTX在提高治愈率的同时,也不可避免地产生消化道黏膜损害、血液毒性、肝肾损害等毒性反应。研究表明,MTX血药浓度与临床疗效、毒性反应关系密切,但不同个体间化疗效果及毒性反应差异很大且原因复杂[1-3],其中基因多态性是重要原因之一,主要为编码MTX膜转运蛋白基因的序列差异[4-5]。MTX的外向转运蛋白是ABC亚家族G成员2(ABC subfamily G member 2,ABCG2)[6],ABCG2 基因编码的P-糖蛋白在多种组织中既可以作为功能屏障,又可以作为外排转运蛋白,其过度表达可导致多药耐药,并影响多种抗癌药物的药代动力学。研究表明,ABCG2基因中的变体可改变P-糖蛋白的表达和功能[7]。尽管MTX不被视为P-糖蛋白底物,但是MTX单药治疗的研究表明,沉默的ABCG2基因多态性可能影响MTX化疗效果和毒性反应[8]。目前关于ABCG2单核苷酸多态性在ALL患儿中影响的临床研究较少,故本研究对ABCG2基因多态性与ALL患儿大剂量MTX化疗效果及毒性反应的关系作一探讨,现将结果报道如下。
1 对象和方法
1.1 对象 选取2012年1月至2018年12月嘉兴市第二医院新诊断的167例ALL患儿为研究对象,男80例,女 87 例;年龄 1~18[4.9(1.1,11.3)]岁;免疫表型:B细胞140例,T细胞21例,双表型2例,未表型4例;诊断时 WBC<50×109/L 78例,≥50×109/L 89例;染色体≥50条101例,<50条66例;大剂量MTX化疗后首次缓解133例,发生事件34例;融合基因检测结果:BCR-ABL1(+)12 例,TEL-AML1(+)4 例,E2A/PBX1(+)11 例,MLL-AF4(+)5 例。入组标准:(1)ALL 的诊断符合儿童ALL诊疗建议(第三次修订草案)中相关标准[9];(2)DNA 样本和临床数据具备可用性;(3)均接受 CCLG-2008 方案治疗;(4)无唐氏综合征;(5)既往无恶性肿瘤史;(6)在化疗巩固治疗前无肝肾功能不全或受损。本研究经本院医学伦理委员会审查通过,所有患儿或家属签署知情同意书。
1.2 方法
1.2.1 化疗方法 根据患儿年龄、WBC、免疫表型、细胞遗传学和分子畸变、强的松不良反应、诱导治疗结束时的形态学缓解(基于BFM风险标准)、治疗结束时的微小残留病变情况综合评估,标准风险(SR)69例,中间风险(IR)98例。参照CCLG-2008诱导治疗方案和巩固治疗方案进行治疗[10]。在化疗巩固阶段(第8、22、36、50天),患儿每2周接受1次大剂量MTX化疗。大剂量MTX给药方式如下:总剂量的10%在0.5 h内通过静脉输注给予,剩余的90%在23.5 h内给予(SR、IR患儿的MTX剂量分别为2、5 g/m2)。在大剂量MTX输注开始后42、48和54 h,以15 mg/m2的剂量进行甲酰四氢叶酸解救治疗。48 h后的高血浆MTX浓度(>0.25 μmol/L)作为延长解救的指示;每天检测血浆中MTX浓度,直至低于 0.2 μmol/L。
1.2.2 基因分型 取外周血白细胞和(或)存档的骨髓载玻片,分别使用FlexiGene试剂盒(德国Qiagen公司)、QIAamp DNA Mini试剂盒(德国Qiagen公司)提取DNA。使用限制性片段长度多态性PCR基因分型方法测定 ABCG2基因rs2231137、rs2231142位点的基因型。PCR 扩增条件:初始变性(95 °C,10 min),40个变性循环(95 °C,15 s),退火(60 °C,1 min)和延伸(72 °C,1 min)和延长(72 °C,7 min)。rs2231137引物序列:正向为 5'-CCCAGAGTCCTTATTCTTAGCC-3',反向为 5'-GTGCCTCCTTCACACACAG-3'。rs2231142 引物序列:正向为5'-TGTTGTGATGGGCACTCTGATG-3',反向为5'-ATCAGAGTCATTTTATCCACAC-3'。扩增完成后,将限制酶HpyCH4IV加入PCR产物中并在37℃下孵育4 h,使用溴化乙锭染色的3%琼脂糖凝胶电泳分析限制性片段长度多态性。
1.2.3 MTX血药浓度测定 在开始输注MTX后的第48、72 h采集患儿2 ml血液样本,采用荧光偏振免疫分析法测定血浆MTX浓度,即MTX血药浓度。
1.2.4 毒性反应评估 在大剂量MTX输注结束到下一个大剂量MTX周期间隔或大剂量MTX输注后14 d评估每个大剂量MTX周期后患儿的毒性反应,包括血液毒性、肝毒性、肾功能损伤、胃肠道毒性、口腔黏膜炎等。血液毒性定义为血清Hb、WBC、PLT降低。肝毒性定义为血清ALT、AST或γ-谷氨酰转移酶水平升高。肾功能损伤定义为血清肌酐或尿素水平升高。胃肠道毒性定义为存在腹痛、腹泻、恶心、呕吐、肠梗阻。根据美国国家癌症研究所常见毒性标准4.0版对毒性进行分级,选择巩固治疗期间最高等级的毒性作为分析的终点。
1.2.5 生存评估 所有患儿中位随访时间75个月,记录72个月无事件生存率(event free survival,EFS)。事件包括任何部位的疾病复发、任何原因的死亡或其他恶性肿瘤的发生等。
1.3 统计学处理 采用SPSS 16.0统计软件。对每个位点基因型频率分布进行Hardy-Weinberg平衡检验。计量资料以表示,组间比较采用两独立样本t检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 ALL患儿ABCG2基因型分布 167例ALL患儿ABCG2的2个位点rs2231137、rs2231142基因型分布频率见表1,经Hardy-Weinberg平衡检验,提示该研究人群具有代表性(均P>0.05)。

表1 ALL患儿ABCG2的2个位点基因型分布频率(n=167)
2.2 不同基因型患儿MTX血药浓度比较 在rs2231137位点,GG与AG+AA基因型患儿巩固治疗期间第48、72 h时MTX血药浓度比较,差异均无统计学意义(均P>0.05);在rs2231142位点,CT+TT基因型患儿巩固治疗期间第48、72 h时MTX血药浓度均高于CC基因型患儿,差异均有统计学意义(均P<0.05),见表2。

表2 不同基因型患儿MTX血药浓度比较(μmol/L)
2.3 不同基因型患儿大剂量MTX化疗毒性反应及用药延迟时间比较 167例ALL患儿接受大剂量MTX化疗的毒性反应主要有血液毒性(80.8%)、胃肠道毒性(36.5%)、口腔黏膜炎(26.9%)、肝毒性(23.4%)、肾功能损伤(17.4%)。在rs2231137位点,GG、AG、AA基因型患儿大剂量MTX化疗毒性反应比较,差异均无统计学意义(均P>0.05);在rs2231142位点,CT、TT基因型患儿肾功能损伤发生率较CC基因型患儿明显升高(P<0.05),而其余大剂量MTX化疗毒性反应各基因型比较,差异均无统计学意义(均P>0.05)。因化疗毒性反应导致大剂量MTX巩固治疗用药延迟≤2周154例(92.2%),>2周13例(7.8%);rs2231137、rs2231142位点各基因型患儿用药延迟情况比较,差异均无统计学意义(均P>0.05),见表 3。
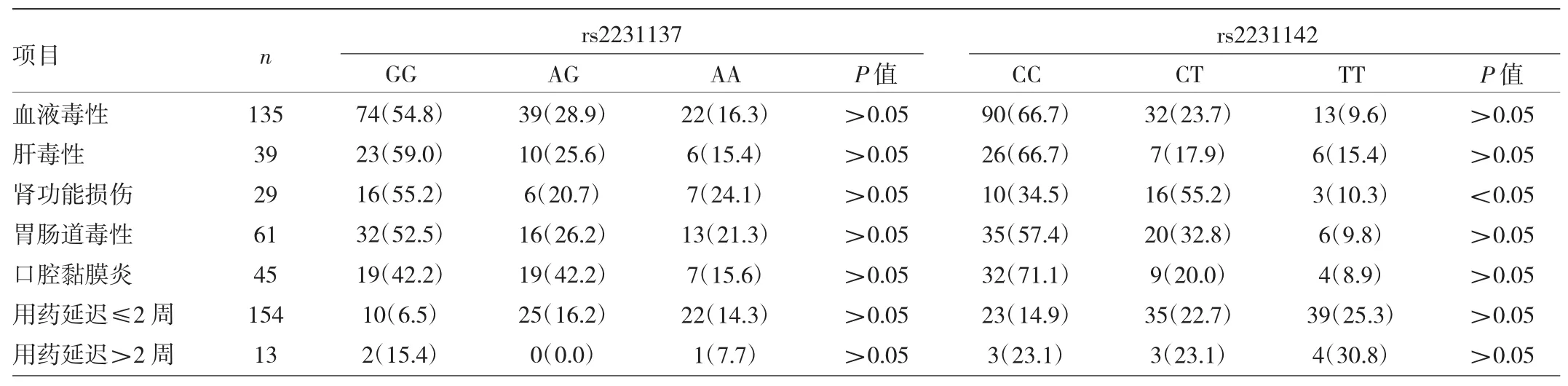
表3 不同基因型患儿大剂量MTX化疗毒性反应及用药延迟时间比较[例(%)]
2.4 不同基因型患儿大剂量MTX化疗后EFS比较 在rs2231137位点,GG与AG+AA基因型患儿72个月EFS比较[(88.5±1.7)%比(83.3±3.2)%],差异无统计学意义(P>0.05);在rs2231142位点,CC与CT+TT基因型患儿72个月EFS比较[(90.2±1.8)%比(81.5±4.6)%],差异亦无统计学意义(P>0.05)。
3 讨论
大剂量MTX在改善ALL的治愈率方面具有重要作用,但个体间差异也很大[5]。基因多态性是导致个体间差异的重要原因之一。在以往的研究中,涉及MTX转运体通路的基因中有多个单核苷酸多态性参与MTX的药代动力学和临床效应,但结果并不明确[11-12]。因此,本研究对接受CCLG-2008方案治疗的ALL患儿ABCG2基因多态性与大剂量MTX化疗效果及毒性反应的相关性作一探讨,结果显示ABCG2的rs2231142位点多态性与肾功能损伤发生率升高有关。Liu等[12]研究表明,ABCG2的rs2231142位点多态性与MTX化疗毒性反应无关,与本研究结果不同。目前也有其他研究分析ABCG2基因多态性与大剂量MTX化疗毒性反应的关系,但结果并不一致[12-13]。这种差异的解释可能是大剂量MTX化疗后服用四氢叶酸,从而降低了大剂量MTX的毒性反应。
大剂量MTX诱导的肾功能损伤常发生在稳态血浆浓度结束时或结束后不久,其诱导肾功能损伤的可能机制如下:(1)肾小管尿液中MTX的pH依赖性沉淀;(2)来自传入小动脉血管收缩的肾灌注减少;(3)直接小管毒性的肾小管内MTX摄取减少[14-15]。鉴于大剂量MTX诱导肾脏损伤的发生时间以及在大剂量MTX输注前、中、后通过碱化尿液和四氢叶酸补救均能有效预防大剂量MTX诱导的肾功能损伤,目前相对认可肾小管尿液中MTX的pH依赖性沉淀导致肾毒性发生的观点[16]。迄今为止,rs2231142多态性与大剂量MTX相关肾功能损伤机制尚未明确,不过已有研究表明TT基因型可能是大剂量MTX化疗毒性反应的倾向因子[12]。本研究结果也显示,rs2231142位点TT基因型与大剂量MTX相关肾功能损伤发生率升高相关。目前原因暂不明确,笔者查阅既往文献发现,rs2231142位点TT、TC基因型酶的活性分别是CC基因型的70%和40%,而rs2231137位点AA基因型酶的活性仅为GG基因型的30%[10]。可见,相比于rs2231137位点变异,rs2231142位点变异使ABCG2转运能力下降更为明显,可导致更多的MTX留在胞外,进而形成MTX沉淀,诱发肾功能损伤。
本研究还检测了48、72 h时MTX血药浓度,结果发现在rs2231142位点CT+TT基因型患儿MTX血药浓度均明显高于CC基因型患儿。在大剂量MTX化疗期间,MTX主要通过肾脏以原型排泄,足量的水化和碱化可以清除体内大部分MTX,但分布至各组织和间液中的MTX与血药浓度达到平衡的速度很慢,且清除率低[17],这部分MTX除通过肾脏排泄外,还需依赖于肝脏等其他代谢途径,而肝脏代谢途径中的转运体OATP1B1能起到有效限制MTX清除的作用[18]。可见,ABCG2基因多态性与MTX组织分布、肝脏摄取代谢、治疗效果等密切相关。因此,对于大剂量MTX化疗过程中血药浓度异常增高的患儿,当其他非基因因素不能解释时,可以用是否存在药物遗传学差异来解释,但仍需要在基因检测与遗传变异方面作进一步探究。
近年来,关于ABCG2基因多态性与ALL患儿生存预后关系的研究结果并不一致[12-13]。Liu等[12]发现rs2231142位点是ALL患儿生存预后的独立影响因素。Chang等[19]研究发现rs2231142位点与136例中国ALL患儿复发风险无关。但是,上述研究结果均显示TT+TC基因型患儿60个月EFS低于CC基因型患儿。基于这些数据,笔者推测具有rs2231142位点T等位基因的患儿可能具有更高的复发风险。本研究结果发现,TT+TC基因型患儿72个月EFS低于CC基因型患儿,但差异无统计学意义。本研究的中位随访时间长于上述2个研究的随访时间,理论上复发例数会增多,因为ALL复发往往发生在后期低风险患儿[20]。因此,目前结果可能表明ABCG2基因多态性并不能作为ALL患儿存活的有效标志物,针对rs2231142位点多态性与EFS之间的关系仍需要进一步研究明确。
综上所述,ALL患儿ABCG2的rs2231142位点基因多态性与大剂量MTX化疗毒性反应肾功能损伤相关,但与预后关系不大。但本研究也存在一定的局限性,如在MTX转运途径中仅选择ABCG2基因的外向转运蛋白进行分析,未包括其他内向和外向蛋白;样本量有限等。

