PD-1和CTLA-4 3′UTR基因交互作用在HBV感染中的作用*
张国妤 齐晓霞 陆宏伟 卢乐
(1.西安交通大学第一附属医院感染科,陕西 西安 710061;2.西安交通大学第二附属医院普外科,陕西 西安 710004)
乙型肝炎病毒(Hepatitis B virus, HBV)感染是全世界范围内的严重公共卫生问题之一。据 WHO统计,全世界约有20亿人曾感染过HBV,而其中超过2.96亿是慢性HBV感染者,每年全球大约有82万人死于HBV感染及其相关疾病[1]。HBV感染机体后,主要是由于细胞免疫对肝细胞的致病作用对机体造成损伤。近年来,与免疫调节呈负性相关的几个重要的免疫抑制性分子——程序性细胞死亡分子-1(programmed cell death-1, PD-1)、细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4, CTLA-4)、T 细胞免疫球蛋白及粘蛋白分子-3(T cell immunoglobulin and mucin domain 3,TIM-3)由于在慢性感染中发挥着重要作用而倍受关注[2-3]。miRNA 是一类非常重要的转录后调控因子,可以通过对靶mRNA 的负性调控作用,影响生物体的生长发育,细胞的凋亡,疾病的发生等。miRNA 与靶mRNA 分子3′非翻译区(3′untranslated region, 3′UTR)的特异性结合是调控mRNA 水平和蛋白表达的关键。miRNA 与靶基因mRNA 的结合效率依赖于mRNA 的序列以及分子内结构。而miRNA 靶基因SNP能够导致mRNA 侧翼区域结构的改变,建立新的miRNA 靶结合位点或去掉原有的靶结合位点,影响miRNA 的结合效率和靶基因的表达[4-5]。因此,miRNA 靶序列SNP 可以通过影响miRNA 与靶mRNA 3′UTR 的结合,参与基因功能的调控。有研究已经报道了PD-1 3′UTR的rs10204525位点和CTLA-4 3′UTR的rs3087243位点在HBV感染中分别发挥着作用[6-7]。因此,我们通过病例对照研究探讨慢性HBV感染者PD-1和CTLA-4 3′UTR的基因多态性分布,以及两者之间的交互作用。
1 资料与方法
1.1 一般资料 收集西安交通大学第一附属医院2011年8月~2013年6月慢性HBV感染者433例,其中男328例,女105例,平均年龄(39.33±13.20)岁。所有病例的诊断均符合2019年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒性肝炎诊断标准,并排除合并有其它肝脏疾病(甲型、丙型、丁型、戊型病毒性肝炎、药物性肝炎、脂肪性肝炎、酒精性肝炎、自身免疫性肝炎、Wilson's 病)、可引起高代谢的疾病(包括糖尿病, 获得性免疫缺陷综合症,甲状腺功能亢进)、伴随严重的心血管系统、呼吸系统以及肾功能损害和年龄不满18岁的患者。433例HBV感染者的临床分型为47例无症状携带者(Asymptomatic carriers,ASC),154例慢性肝炎(Chronic hepatitis,CH),130例肝硬化(Liver cirrhosis,LC)和102例肝癌(Hepatocellular carcinoma,HCC)。健康对照者208例,为中国陕西籍或长期居住在陕西地区无血缘关系的健康献血员和健康体检者,其中男151例,女57例;平均年龄(38.17±14.22)岁。两组在年龄与性别间的差异均无统计学意义(P>0.05)。所有研究对象均知情同意和自愿参加。
1.2 DNA提取 所有受试者清晨空腹抽血2 mL,用EDTA抗凝后,-20℃冷冻保存待提取人类基因组DNA。用天根血液基因组DNA提取试剂盒提取基因组DNA。
1.3 基因型分析 采用限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术进行基因型分析[8-9]。引物序列、内切酶、产物长度见表1。
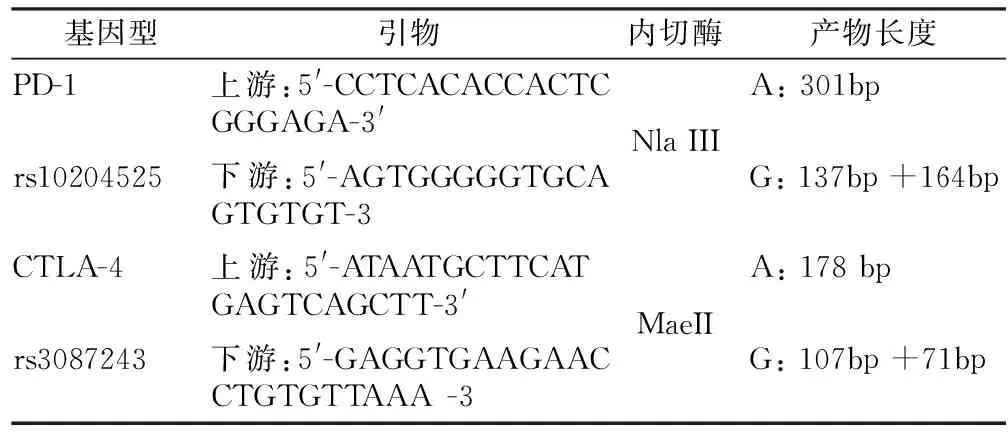
表1 PD-1和CTLA-4基因多态性使用的引物序列、内切酶、PCR产物长度Table 1 Primer sequences, endonucleases, PCR product lengths used for PD-1 and CTLA-4 gene polymorphisms
1.4 统计学分析 采用SPSS 16.0软件进行统计学分析。基因型频率用Hardy-Weinberg平衡检验。HBV感染组与健康对照组的基因型频率、等位基因频率、基因间的交互作用、与疾病严重程度的关系,用2检验进行计算。P<0.05为差异有统计学意义。
2 结果
2.1 PD-1和CTLA-4的基因型和等位基因频率 PD-1 rs10204525 A/G和CTLA-4 rs3087243 A/G基因型在HBV感染组和健康对照组的的分布符合Hardy-Weinberg遗传平衡定律,见表2。 PD-1 rs10204525、CTLA-4 rs3087243在HBV感染组和健康对照组中的差异均有统计学意义。PD-1 rs10204525:与GG基因型相比,慢性HBV感染组的AA基因型频率明显高于健康对照组(P=0.019,OR=2.231, 95%CI=1.127~4.418),A等位基因频率明显高于健康对照组(P=0.033,OR=1.334, 95%CI=1.024~1.739)。CTLA-4 rs3087243:与AA基因型相比,慢性HBV感染组的GG基因型频率明显高于健康对照组(P=0.016,OR=2.196, 95%CI=1.145~4.214),G等位基因频率明显高于健康对照组(P=0.040,OR=1.320, 95%CI=1.012~1.723)。见表3。
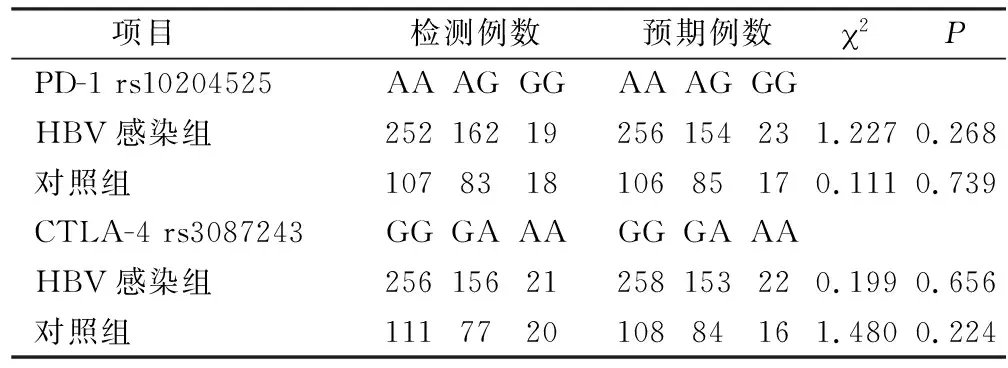
表2 H-W平衡检验Table 2 Hardy-Weinberg equilibrium

表3 PD-1和CTLA-4的基因型和等位基因分析[n,n(×10-2)]Table 3 Genotype and allele frequencies of PD-1 and CTLA4 polymorphisms
2.2 PD-1和CTLA-4的基因型交互作用 以HBV易感基因型PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)作为参照,因PD-1 rs10204525(GG)、CTLA-4 rs3087243(AA)基因型太少,遂分别将二者少见基因型合并分析。发现组合基因型在HBV感染组和健康对照组中的差异有统计学意义,见表4、5。与PD-1 rs10204525(GG)CTLA-4 rs3087243(GA+AA)组合基因型组相比,PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)组合基因型组在慢性HBV感染组的分布频率高于健康对照组(P=0.009,OR=5.298, 95%CI=1.338~20.983)。与PD-1 rs10204525(AA)基因型使乙肝的发病危险性升高2.231倍相比,CTLA-4 rs3087243(GG)基因型显著升高了基于PD-1 rs10204525基础上的乙肝发病危险。与PD-1 rs10204525(AG+GG)CTLA-4 rs3087243(AA)组合基因型组相比,PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)组合基因型组在慢性HBV感染组的分布频率高于健康对照组(P=0.002,OR=4.995, 95%CI=1.684~14.820)。与CTLA-4 rs3087243(GG)基因型使乙肝的发病危险性升高2.196倍相比,PD-1 rs10204525(AA)基因型显著升高了基于CTLA-4 rs3087243基础上的乙肝发病危险。
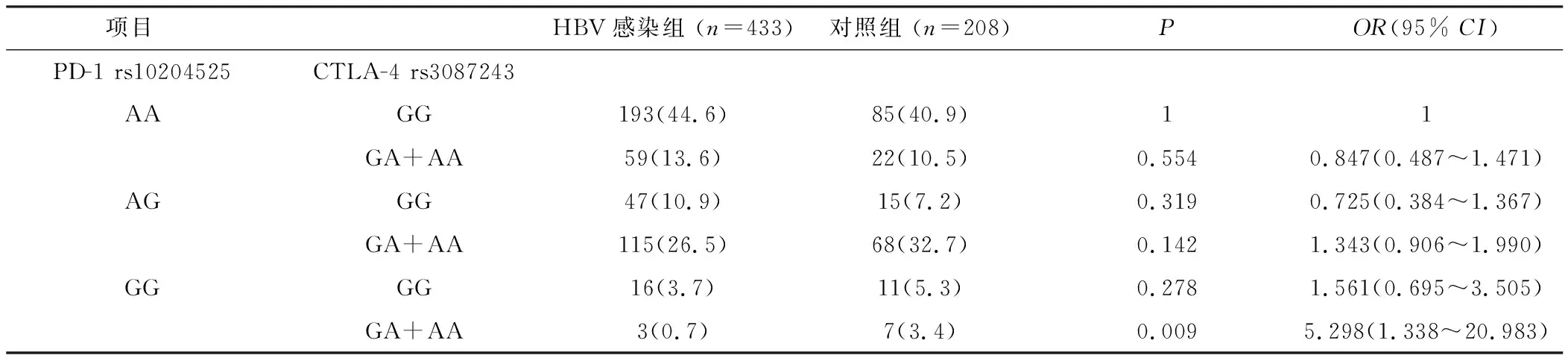
表4 将携带有CTLA-4少见基因型合并后的组合基因型分析Table 4 Combined genotype analysis after combining rare genotypes with CTLA-4
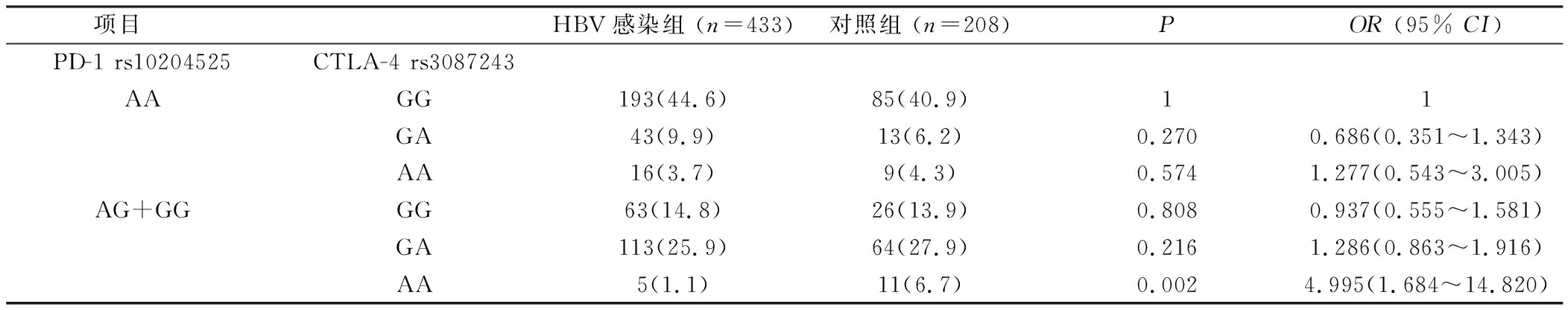
表5 将携带有PD-1少见基因型合并后的组合基因型分析Table 5 Combined genotype analysis after combining rare genotypes with PD-1
2.3 PD-1和CTLA-4基因型和等位基因与疾病严重程度的关系 将HBV感染组按疾病严重程度分为无症状携带者、慢性肝炎、肝硬化和肝癌组,发现PD-1 rs10204525各组间差异无统计学意义,CTLA-4 rs308724基因型和等位基因各组间差异有统计学意义(P<0.05),见表6。进一步组间分析发现,PD-1 rs10204525各组间差异无统计学意义(P>0.05)。而在CTLA-4 rs308724组中,与GA基因型相比,ASC组的GG基因型频率低于HCC组(P=0.026,OR=0.411, 95%CI=0.154~0.508),ASC组的G等位基因频率低于HCC组(P=0.018,OR=0.483, 95%CI=0.263~0.888);与GA基因型相比,CH组的GG基因型频率低于HCC组(P<0.001,OR=0.279, 95%CI=0.172~0.568),G等位基因频率低于HCC组(P<0.001,OR=0.442, 95%CI=0.277~0.704);与GA基因型相比,LC组的GG基因型频率低于HCC组(P<0.001,OR=0.336, 95%CI=0.182~0.620),G等位基因频率低于HCC组(P=0.012,OR=0.541, 95%CI=0.332~0.879)。提示CTLA-4 rs3087243的GG基因型和G等位基因可能与HCC感染相关。
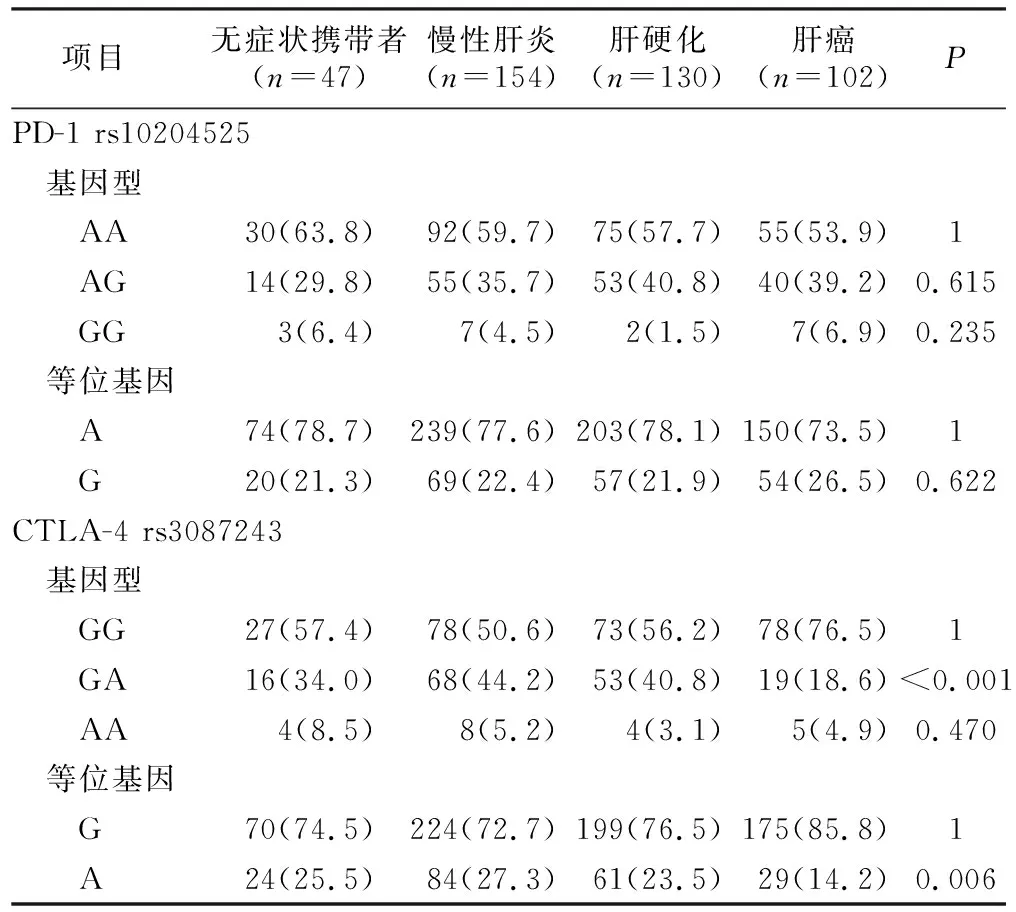
表6 PD-1和CTLA-4的基因型和等位基因与疾病严重程度的关系Table 6 Genotype and allele frequencies of PD-1 and CTLA-4 polymorphisms in hepatitis B virus infected patients with different clinical diagnoses
2.4 PD-1和CTLA-4组合基因型与疾病严重程度的关系 以HBV易感基因型PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)作为参照,因PD-1 rs10204525(GG)、CTLA-4 rs3087243(AA)基因型太少,遂将二者少见基因型合并分析,发现组合基因型在各组中的差异有统计学意义(P<0.05),见表7。进一步组间分析发现:与PD-1 rs10204525(AA)CTLA-4 rs3087243(GA+AA)组合基因型组相比,PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)组合基因型组在ASC组、CH组的分布频率分别低于HCC组(P=0.013,OR=0.233, 95%CI=0.070~0.779和P=0.001,OR=0.197, 95%CI=0.071~0.543);与PD-1 rs10204525(AG+GG)CTLA-4 rs3087243(GA+AA)组合基因型组相比,PD-1 rs10204525(AA)CTLA-4rs3087243(GG)组合基因型组在CH组的分布频率低于HCC组(P=0.045,OR=0.515, 95%CI=0.268~0.990);与PD-1 rs10204525(AG+GG)CTLA-4 rs3087243(GG)组合基因型组相比,PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)组合基因型组在LC组的分布频率高于HCC组(P=0.007,OR=2.847, 95%CI=1.314~6.165);与PD-1 rs10204525(AA)CTLA-4 rs3087243(GA+AA)组合基因型组相比,PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)组合基因型组在CH组的分布频率低于LC组(P=0.029,OR=0.452, 95%CI=0.219~0.932)。

表7 PD-1和CTLA-4组合基因型与疾病严重程度的关系Table 7 Combined analysis of PD-1 and CTLA-4 polymorphisms in hepatitis B virus infected patients with different clinical diagnoses
2.5 PD-1和CTLA-4组合基因型与肝癌的关系 以HCC易感基因型PD-1 rs10204525(AG+GG)CTLA-4 rs3087243(GG)作为参照,因PD-1 rs10204525(GG)、CTLA-4 rs3087243(AA)基因型太少,遂将二者少见基因型合并分析。发现组合基因型在肝癌组和非肝癌组中的差异有统计学意义(P<0.05),见表8。与PD-1 rs10204525(AG+GG)CTLA-4 rs3087243(GA+AA)、PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)、PD-1 rs10204525(AA)CTLA-4 rs3087243(GA+AA)组合基因型组相比,PD-1 rs10204525(AG+GG)CTLA-4 rs3087243(GG)组合基因型组在非肝癌组的分布频率低于肝癌组(分别为P<0.001,OR=0.240, 95%CI=0.119~0.482;P=0.006,OR=0.437, 95%CI=0.242~0.790;P<0.001,OR=0.116, 95%CI=0.041~0.328)。

表8 PD-1和CTLA-4组合基因型与肝癌的关系Table 8 Combined analysis of PD-1 and CTLA-4 polymorphisms in patients with or without HCC
3 讨论
PD-1是一种抑制性免疫受体,属于免疫球蛋白超家族,主要在活化的淋巴细胞,自然杀伤细胞和单核细胞中表达[10]。一旦与它的两个配体PD-L1(B7-H1)和PD-L2(B7-DC)连接,PD-1可以下调T细胞增殖和活性,抑制细胞因子分泌,诱导T细胞凋亡。PD-1基因位于染色体的2q37.3,由5 个外显子和4 个内含子组成。作为肿瘤免疫调节的关键靶点,PD-1和它的两个配体基因单核苷酸多态性(SNP)变异研究主要集中于肿瘤中,也包括本研究所探讨的rs10204525位点,如肺癌、结直肠癌、上消化道癌等[11-13]。随着对PD-1研究的不断深入,逐渐发现许多引起慢性感染的微生物都可能利用了PD-1-PD-L通路削弱抗感染免疫,并造成持续的感染状态[14-15]。因此,对PD-1基因多态性在慢性HBV感染中的研究也逐渐进入人们的视野。位于基因3′UTR的SNP可通过与miRNA特异性结合,进而调控mRNA和蛋白的表达。已有研究发现PD-1非编码区的基因多态性可以通过改变外周血单个核细胞(PBMC)的细胞因子产生和PD-1表达而与HBV感染的慢性和进展相关[16-18]。本研究也有类似发现,PD-1 rs10204525的AA基因型和A等位基因可能是慢性HBV感染的危险因素。
CTLA-4基因同PD-1 基因一样也位于2 号染色体上(2q33~q37),包含4 个内含子和3 个外显子,目前已发现若干个基因多态性位点,这些SNPs 可能影响CTLA-4 的表达量以及结构和功能。但有关CTLA-4非编码区的基因多态性的研究却相对较少,仅见于一些自身免疫性疾病和过敏性疾病[19-20]。本次研究探讨了CTLA-4基因3′UTR的SNP差异在HBV感染中的作用。发现CTLA-4 rs3087243的GG基因型和G等位基因可能是慢性HBV感染的危险因素。且CTLA-4 rs3087243的GG基因型和G等位基因可能与HCC感染相关,这与其他研究结果一致[21]。进一步将CTLA-4和PD-1基因进行联合分析,发现联合基因型可增加慢性HBV感染的危险因素,PD-1 rs10204525(AA)CTLA-4 rs3087243(GG)组合基因型分别增强了PD-1 rs10204525(AA)基因型(OR从2.231增至5.298)和CTLA-4 rs3087243(GG)基因型(OR从2.196增至4.995)的发病风险。
PD-1和CTLA-4作为作为T 细胞表面一种重要的抑制性共刺激分子,在免疫调节中发挥着重要的负性调节作用,并维持着外周免疫耐受[22-25],两者的表达水平与慢性HBV感染的发生发展密切相关。本研究发现PD-1和CTLA-4基因3′UTR的SNP差异与慢性HBV感染的发病风险相关,且两者间存在交互作用。可能通过影响基因3′UTR 与miRNA的结合,进而影响PD-1 和CTLA-4的表达水平,最终影响慢性乙型肝炎的发病风险。这可能有助于深入了解它们在遗传学上与HBV 感染易感性、疾病进展以及结局的关系,为HBV 感染基于基因信息的个体化防治提供新的策略。
4 结论
PD-1 rs10204525的AA基因型和A等位基因可能是慢性HBV感染的危险因素,CTLA-4 rs3087243的GG基因型和G等位基因可能是慢性HBV感染的危险因素。联合基因型可增加慢性HBV感染的危险因素。CTLA-4 rs3087243的GG基因型和G等位基因可能与HCC感染相关。

