1株褐藻胶降解菌的筛选、鉴定及产酶条件优化
刘海超, 张 健, 刘 芳, 王共明, 王艺欣, 赵云苹, 钟静诗
(1.上海海洋大学 食品学院,上海 200000;2.山东省海洋资源与环境研究院,山东 烟台 264006)
藻类是我国重要的海洋经济体系之一,褐藻胶是一种广泛存在于褐藻细胞壁中的酸性阴离子海洋结构多糖,含量约占干重的30%~60%[1]。此外,褐藻酸盐也存在于一些红藻中[2],可由固氮菌[3]、 假单胞菌[4]等几种细菌产生。由于其具有良好的增稠、乳化、稳定等功能,已日益在生物材料、化妆品以及医药等[5-7]行业广泛开发和应用。褐藻胶是由β-D-甘露糖醛酸(M)及其C-5-差向异构体α-L-古罗糖醛酸(G)为基础,通过1,4-糖苷键连接的嵌段式线性高分子聚合物,存在3种聚合方式:同聚β-D-甘露糖醛酸(poly M)、同聚α-L-古罗糖醛酸(poly G)以及两种单体交替排列聚合[8]。由褐藻胶降解而来的褐藻胶寡糖(Alginate oligosaccharide,AOS)因具有多种生物活性已成为近年来研究热点。褐藻胶的降解方法主要有物理降解法、化学降解法和生物降解法。物理降解法主要有超声波法、热液法、辐射法等;化学法主要有氧化降解法、酸降解法、碱降解法等。生物降解法中褐藻胶裂解酶是降解褐藻胶的关键,与物理和化学法相比褐藻胶裂解酶具有催化效率高,底物专一性强,环保节能,反应条件温和,产物活性高等优点[9],因此成为褐藻胶寡糖制备的主要方法。褐藻胶裂解酶可从多种来源分离得到,如海洋软体动物、海洋藻类及陆地真菌、细菌等[10]。但目前仍没有统一的褐藻胶降解工程菌,因筛选的大部分可降解褐藻胶菌株普遍存在产酶量低,酶活力不稳定、易失活等问题。达不到工业生产要求。因此开发具有高酶活力褐藻胶降解菌株一直是重点研究方向,对于海洋资源的高值化利用具有重要意义。本研究从海洋生物中分离筛选出一株具有高酶活力褐藻胶降解菌株B12,具有良好的酶活力稳定性,并研究其降解褐藻胶的最佳产酶条件,以期提高其酶活力,为褐藻胶生物酶解工业化生产和应用提供参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 仿刺参(Apostichopusjaponicus)购自烟台市八角海鲜市场;口虾蛄(Oratosquillaoratoria)、栉孔扇贝(Chlamysfarre)购自烟台市凤台小区市场;虾酱购自滨州市无棣县埕口镇;九孔鲍(Haliotisdiversicolor)购自烟台市开发区星颐广场某超市。
1.1.2 培养基 固体初筛培养基(g/L):海藻酸钠5,酵母膏1,蛋白胨5,琼脂20,NaCl 30,三级纯水配制,装入500 mL三角瓶中,自然pH值(约为6.2),121 ℃、20 min高压蒸汽灭菌。种子液培养基与液体复筛培养基均无琼脂,其他组分与固体初筛培养基组分相同。
1.1.3 主要试剂 API 20E肠杆菌科G-杆菌鉴定试剂盒购自梅里埃生物科技有限公司;Lowry蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;海藻酸钠(CP)、酵母膏、胰蛋白胨、琼脂粉、3,5-二硝基水杨酸、四水合酒石酸钾钠、十二水合磷酸氢二钠、亚硫酸氢钠、结晶酚购自国药集团化学试剂有限公司;叔丁醇、戊二醛25%水溶液购自西陇化工股份有限公司,以上试剂未作特殊说明均为分析纯。
1.1.4 仪器与设备 酶标仪(1510,美国Thermo Fisher Scientific);离心机(5453 Mini Spin Plus,德国Eppendorf AG);台式高速冷冻离心机(TGL-16M,湖南湘仪仪器有限公司);pH计(s210,瑞士Mettler-Toledo);立式自动压力蒸汽灭菌器(GR60DA,厦门致微仪器有限公司);生化培养箱(BSP-100F,沙鹰科学仪器(上海)有限公司);震荡培养箱(MQL-61R,上海旻泉仪器有限公司);数显电子恒温水浴锅(HH-4,常州国华电器有限公司);层析实验冷柜(YC-800,北京亚星仪科科技发展有限公司)。
1.2 方法
1.2.1 产酶菌种筛选 虾酱用磷酸缓冲盐溶液(Phosphate buffer saline,PBS,pH 7.4)按照1∶10(m/v)比例均质后选择不同稀释度涂布到固体初筛培养基;仿刺参、口虾蛄、栉孔扇贝、九孔鲍体表经75%酒精擦拭处理,取仿刺参和口虾蛄肠道,栉孔扇贝和九孔鲍内脏,用PBS按照1∶10(m/v)比例均质后选择不同稀释度涂布到固体初筛培养基,28 ℃恒温培养2~3 d,筛选有透明圈或者培养基凹陷明显的菌落继续划线培养分离纯化。纯化后挑取1个菌落接种到种子液培养基,28 ℃、200 r/min培养24 h,按照3%(体积分数)接种量接种液体复筛培养基中,28 ℃、200 r/min摇瓶培养48 h,8 000 r/min离心10 min,取上清液测定褐藻胶降解酶的酶活力。纯化菌种液用30%(体积分数)甘油于-80 ℃冰箱冷冻保存。
1.2.2 酶活力的测定 采用3,5-二硝基水杨酸(DNS)法[11]测定菌株酶活力,酶活力定义单位(U):每分钟释放1 μg还原糖所需的酶量为一个酶活力单位(U)。酶活力计算公式:

式中:m为还原糖量(mg)(根据OD值从标准曲线查得);N为稀释倍数(酶液为离心的发酵液);T为反应时间(20 min);V为酶液体积(0.2 mL)。
1.2.3 菌株生物量及其生长曲线测定 菌株于液体培养基中连续培养,每隔6 h取200 μL发酵液于600 nm下测其吸光值,记录生物量,以时间为横坐标绘制生长曲线。
1.2.4 发酵液蛋白质含量测定 Lowry蛋白浓度测定试剂盒进行测定。
1.2.5 菌种鉴定 将菌株B12纯菌落用无菌水从固体平板培养基中冲洗至离心管中,8 000 r/min离心5 min,重复3次,送至上海美吉生物医药科技有限公司进行16S rDNA基因测序,测序结果采用NCBI数据库在线程序BLAST进行分析,序列登录号为M9Z5VBYP014,与已知微生物进行16S rDNA基因序列比对,选择下载较高相似性的序列利用MEGAX软件并采用邻接法(Neighbour-joining,NJ)构建发育树,Bootstrap重复1 000次检验发育树稳定性。
1.2.6 菌株生理生化特征及电镜观察 采用API 20E肠杆菌科G-杆菌试剂盒研究菌株B12生理性状,对该菌株进行固定、脱水、干燥前处理用于电镜观察菌株形态。
1.2.7 产酶条件研究 发酵条件是决定发酵效率高低的重要因素,对菌株产酶条件进行优化有利于提高褐藻胶降解效率。通过单因素试验对影响产酶的5个培养条件(培养基初始pH值、NaCl质量浓度、培养温度、接种量和装液量)的最优参数进行探究,各因素水平见表1,酶活力及生物量测量采用1.2.2及1.2.3方法,每一步优化结果均用于后续试验,每个试验3个平行,重复3次。将培养液装入250 mL锥形瓶中,28 ℃、200 r/min恒温培养48 h。发酵液于4 ℃、8 000 r/min离心10 min,取上清液测酶活力,取菌悬液测生物量,研究各因素对B12菌株生长及其产酶条件的影响。

表1 单因素水平分布
1.2.8 酶活力稳定性的研究 将B12菌株的粗酶液分别置于4 ℃冷藏保存和最适产酶温度28 ℃恒温保存,每隔20 min检测其酶活力,观察该菌株的酶活力稳定性。
1.2.9 响应面法优化产酶条件研究 基于上述单因素试验结果进行响应面优化试验设计[12]。全面考察培养基初始pH值、NaCl质量浓度、培养温度、接种量、装液量对菌株B12产酶活力的影响。根据 Box-Behnken设计,进行5因素3水平的响应面分析试验,得出最佳酶解条件。试验因素水平见表2。
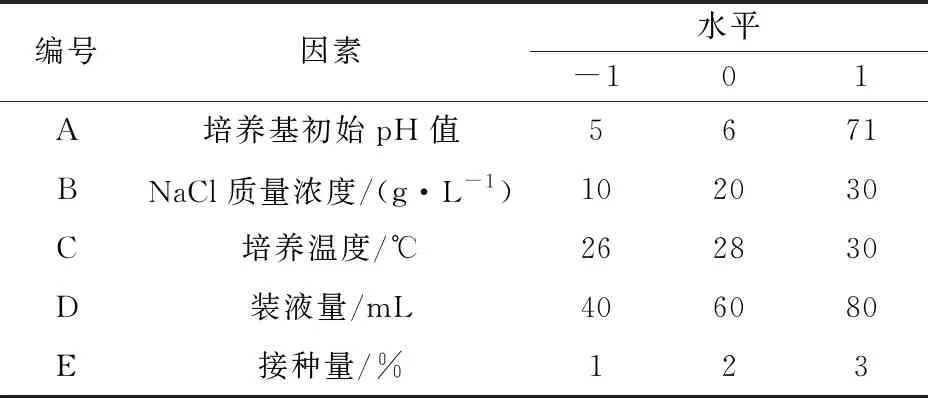
表2 试验因素水平
2 结果与分析
2.1 产酶菌株筛选
以海藻酸钠为唯一碳源的固体培养基进行菌种初筛,挑选代谢海藻酸钠使培养基表面产生凹陷或透明圈的不同形态菌落62个至新培养基中划线纯化培养。纯化后的菌株DNS法测其酶活力,结果见表3,获得的菌株B12酶活力为66.13 U/mL。
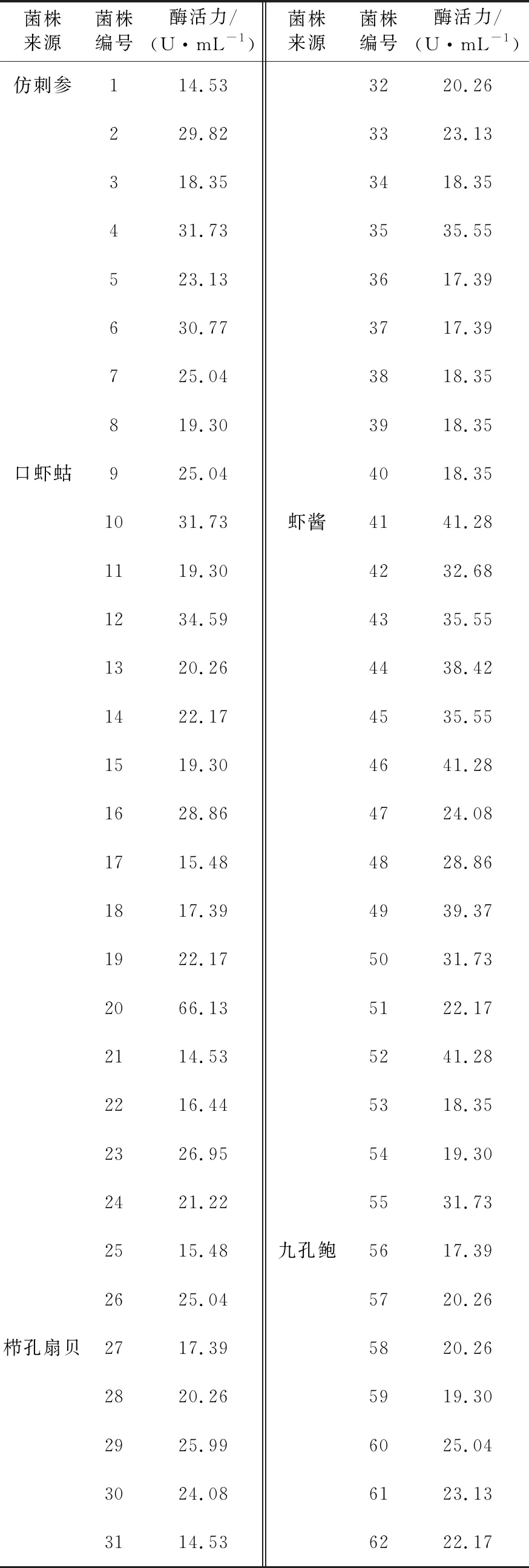
表3 DNS法检测酶活力
2.2 发酵液蛋白质含量
菌株经发酵培养48 h后测定培养基中蛋白质含量,以未接菌培养基为0基线,蛋白质变化分布于坐标轴上下两侧,如图1所示,部分菌株发酵液中蛋白质含量低于未接菌的空白培养基,推测为该菌株利用了培养基中的蛋白胨、酵母膏为其生长代谢提供能量,故消耗了发酵液中蛋白质的质量。另外大部分菌株发酵液中蛋白质含量高于空白组发酵液,说明该部分菌株可能产生褐藻胶裂解酶分泌到胞外培养基中,使其蛋白质含量增加。与表3对比,菌株蛋白质产生量与其酶活力高低不成正比,分析可能是产生的蛋白质不都是褐藻胶裂解酶,且不同裂解酶反应速率存在差异。

图1 发酵液蛋白质含量Fig.1 Protein content in fermentation broth
2.3 菌株16S rDNA鉴定结果分析
经测序结果可知,菌株B12的16S rDNA基因序列1 455 bp,通过NCBI中的BLAST程序比对发现与弧菌属的多个菌株序列相似性为99%,将其归属弧菌属。系统发育树如图2所示,该菌株与MN938231.1Vibrioowensiistrain 3-8亲缘关系最近。周敏[13]也从海洋动物中筛选到弧菌属高酶活力褐藻胶降解菌株,郭恩文等[14]从褐藻中筛得1株海洋弧菌(Vibriosp.QY107),且该菌株为双功能褐藻胶降解酶,降解产物为褐藻胶三糖。
2.4 菌株生理生化特征
菌株B12的生理生化鉴定结果如表4所示,该菌株为革兰阴性菌,菌落白色,光滑,不易挑取,B12电镜结果如图3所示,呈粗糙长杆状,直径约5 μm。
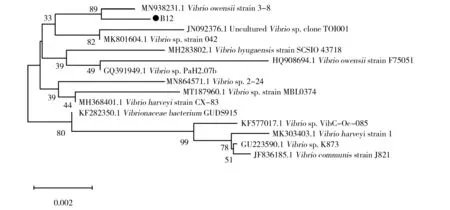
图2 基于16S rDNA序列的弧菌属系统发育进化树Fig.2 Phylogenetic tree of the Vibrio sp. based on 16S rDNA sequence

表4 菌株B12生理生化鉴定结果
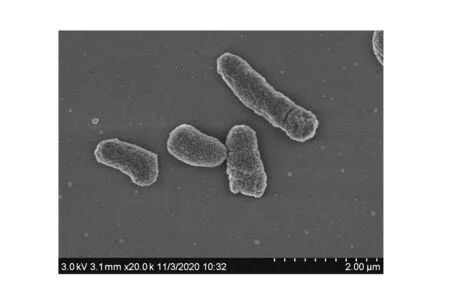
图3 菌株B12电镜扫描结果Fig.3 SEM results of strain B12
2.5 菌株B12单因素试验
2.5.1 培养基初始pH值对菌株B12生长及酶活力影响 pH值可影响微生物细胞膜电荷的变化,进而影响微生物对营养物质的吸收,影响生命活动中酶的活性。研究了B12菌株在不同pH值下的生长及产酶情况,如图4所示。菌株B12在pH值4~5范围内随着pH值的增加生物量快速增加,pH值5~6范围内生物量增加减缓,pH值为6时,生物量和酶活力都达到最高值,酶活力为67.44 U/mL。随着pH值的继续增加,生物量及其酶活力逐渐降低。由结果可知,微酸环境有利于菌株B12的生长及产酶。这与多数产褐藻胶降解酶菌株适于中性环境pH值6~9[15-17]相符。

图4 培养基初始pH值对菌株B12生长和产酶的影响Fig.4 Effect of initial pH of culture medium on growth and enzyme production of the strain
2.5.2 NaCl质量浓度对菌株B12生长及酶活力影响 培养基中的NaCl通过调节细胞渗透压来维持细胞的活性。如图5所示,NaCl质量浓度在10~20 g/L范围内,随着浓度的增加,菌株B12酶活力和生物量均有显著增加,并在NaCl质量浓度为20 g/L时达到最大,酶活力为68.91 U/mL。随着NaCl质量浓度继续增加,菌株生长及酶活力受到抑制而逐渐降低,与多数从海洋中筛选得到的褐藻胶降解菌株最适NaCl质量浓度为20~30 g/L[18-19]相符。可能是由于高质量浓度NaCl使处于高渗环境中的细胞失水收缩,影响微生物的正常生理功能,导致菌株生长繁殖受到抑制。而在低渗环境中,由于细菌有细胞壁保护,对其影响较小,且菌株B12为海洋动物中筛得,故NaCl质量浓度在20~30 g/L较适宜生长。

图5 NaCl质量浓度对菌株B12生长和产酶的影响Fig.5 Effect of NaCl concentration on the growth and enzyme production of the strain
2.5.3 培养温度对菌株B12生长及酶活力影响 温度会影响微生物细胞膜的流动性,影响细胞膜内外物质的交换和吸收,进而影响菌株的生长繁殖,同时,温度对酶活力具有一定影响,从而影响微生物的生理代谢等功能。如图6所示,随着温度的升高,菌株生长迅速,酶活力不断提高,28 ℃时,酶活力和生物量达到最大,最高酶活力为79.14 U/mL。随着温度的继续升高,菌株生物量增长减缓且呈下降趋势,酶活力显著下降。分析原因可能是菌株B12来源于海洋环境,温度过高影响其酶活力,且与多数已研究的褐藻胶降解菌株产酶最适温度在30~50 ℃之间相符[20-23]。温度继续升高对菌株生长量影响较小,分析可能原因是此温度范围在该菌株的耐受范围内,因此可正常生长繁殖。

图6 温度对菌株B12生长和产酶的影响Fig.6 Effect of temperature on the growth and enzyme production of the strain
2.5.4 接种量对菌株B12生长及酶活力影响 研究了接种量分别为1%、2%、3%、4%和5%对菌株B12生长和产酶的影响。如图7所示,随着接种量的增加,菌株酶活力先增加后下降,且在接种量为2%时达到最大,最大酶活力为53.74 U/mL。接种量超过2%之后,随着浓度的增加,该菌株生物量表现为放缓趋势。分析原因:一是菌株可能达到生长稳定期,接种量增加,使得在有限空间内菌株生长快速达到饱和状态并有加速进入衰退期的趋势,使其酶活力下降[24];二是接种量增加菌株生长迅速,菌株代谢产物不断增加,改变其生长环境,不利于菌株产酶[25-26]。

图7 接种量对菌株B12生长和产酶的影响Fig.7 Effect of inoculation amount on the growth and enzyme production of the strain
2.5.5 装液量对菌株B12生长及酶活力影响 装液量也是影响菌株生长和产酶的重要因素,装液量过少在摇瓶培养过程中导致水分蒸发快,影响菌株生长;装液量过多使培养基中溶氧量降低,影响菌株生理活性[27]。装液量对菌株的生长及酶活力情况如图8所示,随着装液量的增加,菌株B12的生长及酶活力呈先上升后下降趋势,250 mL锥形瓶中装液量为60 mL时,菌株生长及酶活力达到最大为61.51 U/mL。装液量20~ 60 mL时,酶活力增加缓慢,60~100 mL时,酶活力迅速下降,说明菌株B12为好氧菌且对氧气要求严格。

图8 装液量对菌株B12生长和产酶的影响Fig.8 Effect of liquid loading on the growth and enzyme production of strains
2.6 菌株B12酶活力稳定性
观察菌株B12的粗酶液在冷藏(4 ℃)和最适温度(28 ℃)下的酶活力稳定性。结果如图9所示,前40 min内随着时间的增加,酶活力趋于平缓,稳定性较好,40~60 min时,酶活力显著降低,60~100 min时酶活力下降变缓,100~120 min酶活力持续缓慢降低。4 ℃和28 ℃保存40 min后酶活力分别达到初始酶活力的97.3%和93.1%,与庞敏[11]所测菌株酶活力稳定性趋势一致,40 min内最适温度下,酶活力下降缓慢,说明菌株B12所产褐藻胶降解酶酶活力稳定性较好。120 min后酶活力分别为初始酶活力的57%和52.7%,两温度下剩余酶活力相差不大,120 min内,4 ℃冷藏保存相比于28 ℃恒温保存酶活力损失略低,需进一步探究最适的酶活力保存温度。

图9 菌株B12酶活力稳定性曲线Fig.9 Enzyme activity stability curve
2.7 响应面优化试验结果分析
2.7.1 回归模型建立及其显著性检验 采用Design Expert中Box-Benhnken(BBD)设计5因素3水平的试验方案,实验结果如表5所示。对表中实验数据进行多元回归拟合,获得二元多次回归模拟方程:酶活力(U/mL)=95.10+1.37A+0.32B+2.16C-0.82D+0.68E-0.017AB+0.067AC+0.53AD+1.04AE-0.45BC-0.31BD+7.500(E-003)BE-0.74CD-0.74CE+1.07DE-19.59A2-8.90B2-10.89C2-10.62D2-5.59E2。

表5 响应面试验优化模型与试验结果
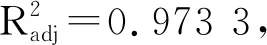
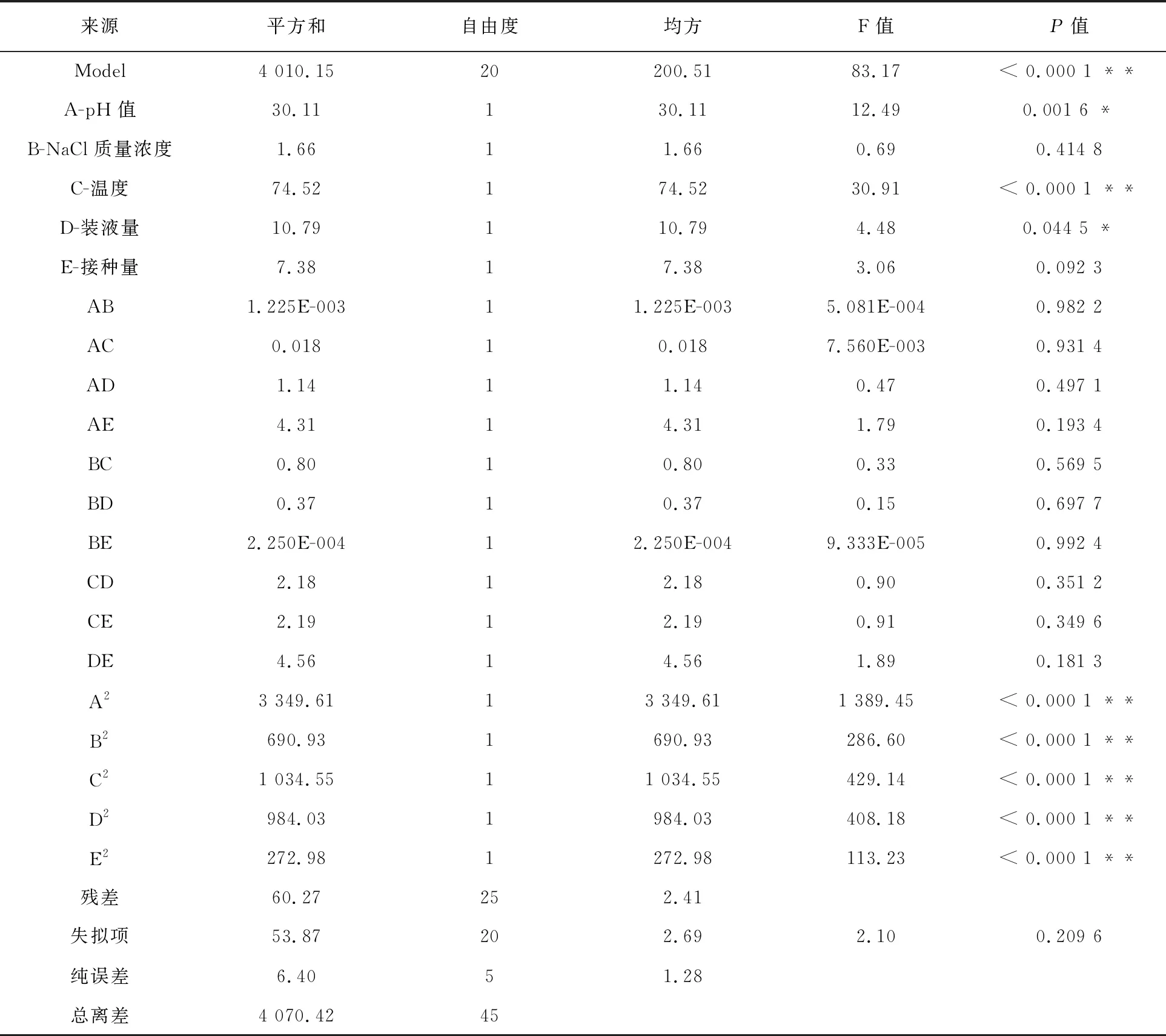
表6 回归模型方差分析
2.7.2 响应面优化分析 响应面中等高线可直接反应两因素交互作用的强弱,等高线呈椭圆形、等高线密集度越高表明两因素交互作用越显著,反之,交互作用越不显著。响应面中3D曲面图形可反应响应值随各影响因素及影响因素间的变化趋势。图10(a)、(c)和(d)中等高线图呈椭圆形,说明培养基初始pH值与接种量、装液量与接种量、培养温度与装液量间的交互作用显著。其中图10(d)的等高线等值线最为密集,说明培养温度与装液量间的交互作用极大,图10(a)3D曲面显示,pH值的变化曲面弧度相比较接种量的变化趋势更陡,说明培养基初始pH值对酶活力的影响较接种量显著。图10(b)3D曲线图形显示,培养温度变化曲面较培养基初始pH值平缓,说明培养温度没有培养基初始pH值对响应值的作用显著。其余各因素间等高线偏圆形(图略),说明交互作用不显著。
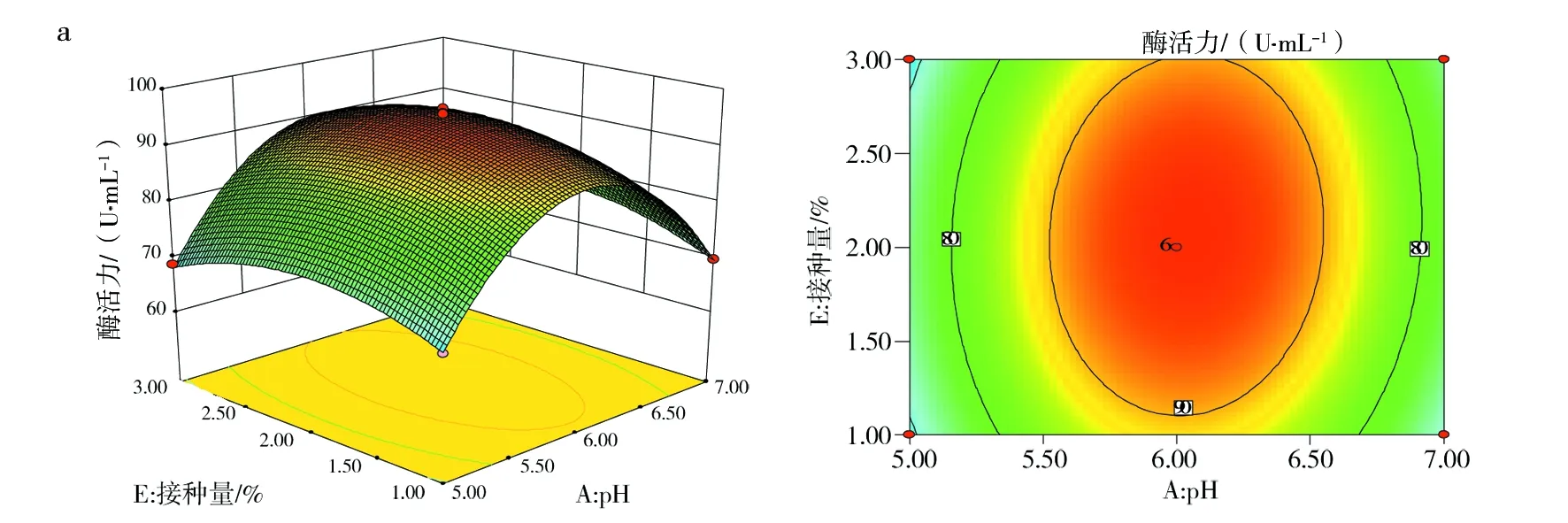
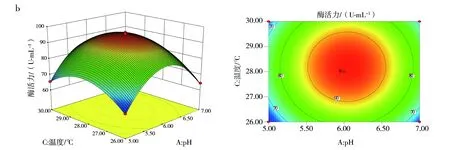
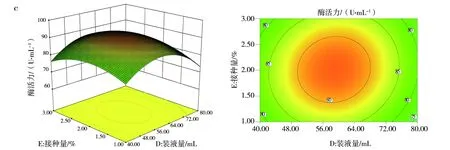
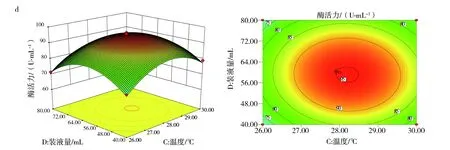
图10 各因素交互作用影响Fig.10 The interaction of various factorsa:培养基初始pH值与接种量;b:培养基初始pH值与温度;c:装液量与接种量;d:温度与装液量a:Initial pH of medium and inoculum quantity;b:Initial pH of medium and temperature;c:The amount of liquid loading and inoculat;d:Temperature and liquid volume
2.7.3 响应面优化验证试验结果分析 响应面模型预测最佳产酶培养条件:培养基初始pH值6.52,NaCl质量浓度20.1 g/L,培养温度28.2 ℃,接种量2.1%,装液量59.5 mL。将上述模型根据实际情况进行参数修正,调整为培养基初始pH值6.5,NaCl质量浓度20 g/L,培养温度28 ℃,接种量2%,装液量59.5 mL。进行3次平行试验,酶活力均值91.68 U/mL,与预测值90.62 U/mL接近,说明优化模型准确可靠,真实值与预测值拟合较好,回归方程可信度较好。
2.8 优化前后菌株B12生长及酶活力曲线
对菌株B12发酵培养基优化前后生长及产酶曲线进行比较,结果如图11所示,优化后相较于优化前,菌株生物量显著提高,生长曲线延滞期缩短6 h,酶活力显著提高,酶活力最高值达91.54 U/mL。起始产酶时间由优化前的12 h缩短至6 h,酶活力提高了1.38倍。

图11 优化前后菌株B12生长和酶活力曲线Fig.11 The growth and enzyme production curve of the strain before and after optimization
3 讨 论
利用生物法降解褐藻多糖生产具有天然活性褐藻胶寡糖的关键是筛选高酶活力褐藻胶降解菌株。近年来,褐藻胶降解菌株的筛选、褐藻胶裂解酶的开发依然是国内外研究热点,已报道的多糖降解菌株最适温度多在30~50 ℃之间,热稳定性较差[28],Yagi等[19]筛选出希瓦氏菌(Shewanella)产褐藻胶裂解酶60 ℃左右几乎没有酶活力。Yang等[29]在沿海土壤中分离得到1株微球菌(Microbulbifer),其酶活力最适温度为40 ℃,最适pH为9。多数海洋褐藻胶裂解酶喜好中性偏碱环境,部分适宜微酸环境,如严芬等[30]以透明圈法初筛,DNS法复筛,从海洋生物中分离出1株假交替单胞菌(Pseudoalteromonas),其最适培养基初始pH为5.5,优化后酶活力提高到71.94 U/mL。
本研究以海藻酸钠为唯一碳源配制选择性培养基,从多种海洋生物及其制品中取样,筛选得到62株具有褐藻胶降解能力的菌株,经发酵复筛,以DNS法测酶活力,得到来源于口虾蛄肠道菌株B12。通过16S rDNA序列分析、生理生化试验、电镜扫描鉴定菌株B12为弧菌属。通过蛋白质含量测定发现不同褐藻胶裂解酶降解速率不同,利用响应面法得到最佳产酶培养条件:培养基初始pH值6.52,NaCl质量浓度20.1 g/L,培养温度28.2 ℃,接种量2.1%,装液量59.5 mL。优化后菌株经发酵培养,酶活力达91.68 U/mL,较优化前提高38.5%。优化后菌株产酶时间缩短了6 h。本研究中菌株B12所产褐藻胶裂解酶量不是最多,但酶活力最高,因此有进一步研究其酶学性质的意义,为褐藻胶降解、褐藻胶寡糖制备的工程菌、褐藻胶裂解酶等的开发应用提供参考。