野野村氏菌FIM02-765的分类鉴定及Simaomicin α的抗肿瘤活性
彭 飞, 张文州, 陈琳琳, 林阳君, 庄月娥, 许 嵘
(泉州医学高等专科学校 药学院,福建 泉州 362011)
放线菌一直以来都是新天然产物的重要来源[1]。随着抗生素药物的广泛使用,持续出现的感染性疾病以及抗生素耐药性已成为威胁人类健康的医学与社会问题[2],超级耐药菌的出现使得新型抗生素药物的开发显得尤为迫切,而从传统链霉菌中发现新骨架活性化合物的几率越来越低,因此研究开发链霉菌以外的放线菌资源就显得尤为重要[3]。稀有放线菌作为重要的微生物药源具有巨大的开发潜力[4],尤其是生活在极端环境中的稀有放线菌,特殊的生长环境决定了其具有产生特殊结构代谢产物的能力[5]。野野村氏菌(Nonomuraeasp.)作为一类稀有放线菌,最早由Zhang等[6]于1998年命名, 属于链孢囊菌科,包含34个种和2个亚种[7]。已有的研究表明,野野村氏菌是天然活性代谢产物的重要来源[7]。Derewacz等[8]从Nonomuraeaspecus的发酵浸膏中获得4个新的由硫桥连接的萘醌二聚体衍生物Hypogeamicins A~D,细胞毒活性分析表明Hypogeamicins A具有较强的抗结肠癌细胞的活性。2019年,Khaled等[9]从陆生放线菌NonomuraeaendophyticaGW58/450的发酵液中分离得到3个具有萘酰胺噻唑环结构的新化合物(Karamomycins A~C),研究还表明,该类化合物具有较好的细胞毒活性。同年,Khomsan等[10]从沼泽土来源的NonomuraearhodomycinicaNR4-ASC07T的发酵提取物中获得2个新化合物——Nonomuric acid 和3-hydroxy deoxydaunorubicinol aglycone,研究表明,前者还表现出较显著的抗疟活性,其半数致死浓度(IC50值)达到8.00 μg/mL。本研究在挖掘海洋稀有放线菌资源的过程中,通过基因筛选从台湾海峡沉积物来源的100株海洋放线菌中获得1株稀有放线菌FIM02-765[11],报道了稀有放线菌FIM02-765的分类鉴定及其代谢产物Simaomicin α的抗肿瘤细胞分析,为后续的深入研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和肿瘤细胞来源 稀有放线菌(Rare actinomycetes)FIM02-765来自台湾海峡沉积物样品,由泉州医学高等专科学校微生物药物课题组分离、保藏并提供。人食管癌细胞株(KYSE30、KYSE180和EC109)、人肝癌细胞株(SMMC7721)、人膀胱癌细胞株(5637)、人白血病细胞株(HeLa-60)和人胃癌细胞株(SGC7901)作为测试细胞,均购自中国科学院细胞库(中国上海)。
1.1.2 培养基 ①形态特征观察采用ISP-2琼脂培养基;②斜面培养基为高氏天冬素琼脂培养基;③种子培养基:可溶性淀粉10 g,蛋白胨6 g,酵母提取物2 g,燕麦粉2 g,CaCO32 g,pH 7.5,1 000 mL自来水配制;④发酵培养基采用MS培养基:甘露醇20 g,黄豆饼粉20 g,K2HPO40.5 g,CaCO31 g,pH 7.5,1 000 mL自来水配制;⑤燕麦琼脂培养基:燕麦片40 g,琼脂15 g,pH 7.5,水1 000 mL,其他培养基见表1。
1.1.3 主要试剂 分析色谱柱(美国Welch,Ultimate XB-C18,5 mm×250 mm,5 μm);葡聚糖凝胶Sephadex LH-20(美国Amersham);大孔吸附树脂Diaion HP-20 (日本三菱);胎牛血清(北京元亨圣马生物技术研究所);顺铂(青岛捷世康生物科技有限公司);甲醇(色谱纯,Merck);其他试剂均为分析纯。
1.1.4 主要仪器与设备 高效液相色谱仪(20A-DAD,日本岛津公司);PCR扩增仪(S1000,Bio-RAD公司);电泳仪(6003EN,上海申能博彩生物科技有限公司);TECAN Infinite M200 Pro酶标仪(瑞士TECAN集团公司);二氧化碳培养箱(NuAir 8000,美国Nuaire公司);倒置显微镜(Motic,北京汗盟紫星仪器仪表有限公司);旋转蒸发仪(EYELA N-1100,日本东京理化);Olympus显微镜(BX-41,日本Olympus公司);扫描电镜(JSM-6380LV,日本JEOL公司)。
1.2 方法
1.2.1 形态特征与培养特征 形态特征采用ISP-2琼脂培养基,28 ℃插片培养,21 d后取片用Olympus显微镜和扫描电镜观察基内菌丝、气生菌丝、孢子和孢子丝的形态特征。扫描电镜样品制备采用Ismet等[12]的方法。培养特征采用Waksman等[13-14]、Shirling等[15]、Asano等[16]推荐的14种培养基,28 ℃分别培养7、14和21 d,观察并记录结果。颜色记录采用ISCC-NBS颜色标准[17]。
1.2.2 生理生化特征 菌株的生长温度、最适pH值以及NaCl耐受范围实验采用燕麦琼脂培养基。碳源利用实验采用不添加淀粉的ISP-9作为基础培养基,分别加入1.85%各种碳源,28 ℃培养,观察周期为1个月。明胶液化、牛奶凝固与胨化等生理生化指标的测定参考文献[18]。
1.2.3 全细胞糖分组成分析 采用Toru等[19]和王平[20]的TLC方法进行全细胞水解液的糖分分析实验。菌种于Bennett液体培养基中28 ℃培养4 d,离心收集菌体,并用蒸馏水洗涤2~3次,95%乙醇浸泡24 h。干燥后置入安瓿瓶中,加入0.1 mL 0.5 mol/L HCl,烘箱加热至120 ℃,约15 min,用于糖分析的水解液以黄棕色为宜。用毛细管将0.8~2 μL水解液点样薄层板,同时点样1%鼠李糖、核糖、木糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖的混合液0.2 μL作为标准对照。V甲醇∶V吡啶∶V冰乙酸∶V水=10∶1∶0.25∶5作为展开剂用于全细胞水解液DAP异构体分析,V乙酸乙酯∶V吡啶∶V冰乙酸∶V水=8∶5∶1∶1.5作为展开剂用于全细胞水解液糖组分分析,之后置于层析缸中展层约3 h,依据层析图谱确定菌种所含DAP及糖的种类。糖型分析采用苯胺邻苯二甲酸试剂显色法,105 ℃加热5 min后直接观察。
1.2.4 16S rRNA 序列测定与分析 采用刘志恒[21]的方法提取总DNA。采用通用引物(27f和1492r)[22]进行16S rRNA序列扩增。PCR产物经纯化后由金唯智生物科技公司完成测序。序列经BLAST比对,用软件MEGA7.0构建系统发育树。
1.2.5 菌株的发酵培养及代谢产物的分离纯化 菌株FIM02-765的发酵培养采用彭飞等[11]的方法进行。Simaomicin α的提取过程[11]如下:菌株发酵液5 000 r/min离心15 min,上清液行Diaion HP-20大孔吸附树脂,70%~90%甲醇水梯度洗脱,HPLC-DAD检测,合并相同紫外吸收峰的馏分,减压浓缩得棕色粗提物(700 mg),馏分经Sephadex LH-20凝胶柱层析,甲醇洗脱,合并相同组分后于4 ℃下析出淡黄色晶体(100 mg),晶体溶于甲醇后再行Sephadex LH-20进行纯化,得到单体化合物Simaomicin α(5.4 mg)。
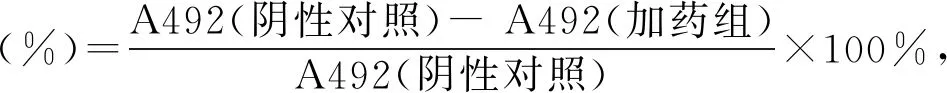
2 结果与分析
2.1 形态特征与培养特征
菌株FIM02-765在ISP-2培养基上插片培养,基内菌丝深黄色,气生菌丝淡黄色。菌株在ISP-2和ISP-4培养基上都可以产生丰富的气生菌丝。孢子链呈钩状,含7~13个孢子,呈球形或圆柱形,孢子表面光滑,无孢子囊(图1)。采用ISP-2、察氏琼脂等14种培养基对菌株FIM02-765进行初步形态和培养特征观察,培养特征见表1。结果表明,在14种培养基中,菌株FIM02-765均表现出生长迹象,其中在水琼脂、燕麦琼脂、察氏琼脂和营养琼脂培养基中生长较弱。菌丝观察结果表明,该菌的基内菌丝多呈黄粉色或黄棕色,而气生菌丝则多呈淡黄粉色。在所有的培养基中,菌株FIM02-765均未检测到可溶性色素。上述结果表明菌株FIM02-765具有典型的野野村氏菌培养特征。

图1 菌株FIM02-765的钩状孢子链形态Fig.1 Morphological characteristic of hooked spore chains of strain FIM02-765
2.2 生理生化指标
生理生化指标测定结果表明,菌株FIM02-765为需氧、革兰阳性菌,其生长最适pH范围为5.5~9.5,生长耐受温度范围为15~40 ℃。盐耐受分析表明,该菌在含4% NaCl的燕麦培养基中没有生长迹象。色素检测表明该菌不产生黑色素。该菌对明胶的液化和牛奶的胨化不明显;淀粉水解和硝酸盐还原呈弱阳性。碳源利用情况见表2。
2.3 细胞壁化学组分分析
全细胞水解液糖分分析表明,菌株FIM02-765的细胞壁肽聚糖含有内消旋的二氨基庚二酸 (DAP),属于胞壁III型。同时,在全细胞水解液中还检测到马杜拉糖、半乳糖、葡萄糖和甘露糖,糖型为B型。细胞壁类型和糖型均表现为典型的野野村氏菌特征[24-25]。

表1 菌株FIM02-765的培养特征

表2 菌株FIM02-765的碳源利用情况
2.4 16S rRNA 序列分析
菌株FIM02-765的16S rRNA基因序列全长1 449 bp(Accession number:KC568203)。基于该序列的系统发育树(图2)的分析结果表明,该菌株与典型菌株Nonomuraeabangladeshensis5-10-10T
和Nonomuraeacoxensis5-38-42T处于一个相同的进化分支,且与N.bangladeshensis5-10-10T模式菌的相似度达到99.44%,菌株FIM02-765与其他相关的典型菌株也表现出较高相似度,与N.maheshkhaliensis16-5-14T的相似度为98.45%,与N.kuesteriGW 14-1925T的相似度为98.05%,与N.coxensis5-38-42T的相似度为95.92%。上述结果表明菌株FIM02-765属于野野村氏菌 (Nonomuraeasp.)。
2.5 Simaomicin α的抗肿瘤活性分析
在前期的研究[11]中,本课题组从菌株FIM02-765中分离得到1个稠环氧杂蒽酮类化合物Simaomicin α(图3),并对该化合物的抗菌活性进行了报道。为了更深入地研究该化合物的生物学活性,本研究针对该化合物的抗肿瘤活性进行了分析(表3)。结果表明,Simaomicin α表现出较强的抑制肿瘤细胞增殖的能力,对人食管癌细胞株(KYSE180和EC109)、人肝癌细胞株(SMMC7721)、人膀胱癌细胞株(5637)、人白血病细胞株(HeLa-60)和人胃癌细胞株(SGC7901)的抑制活性都强于阳性对照药物顺铂。
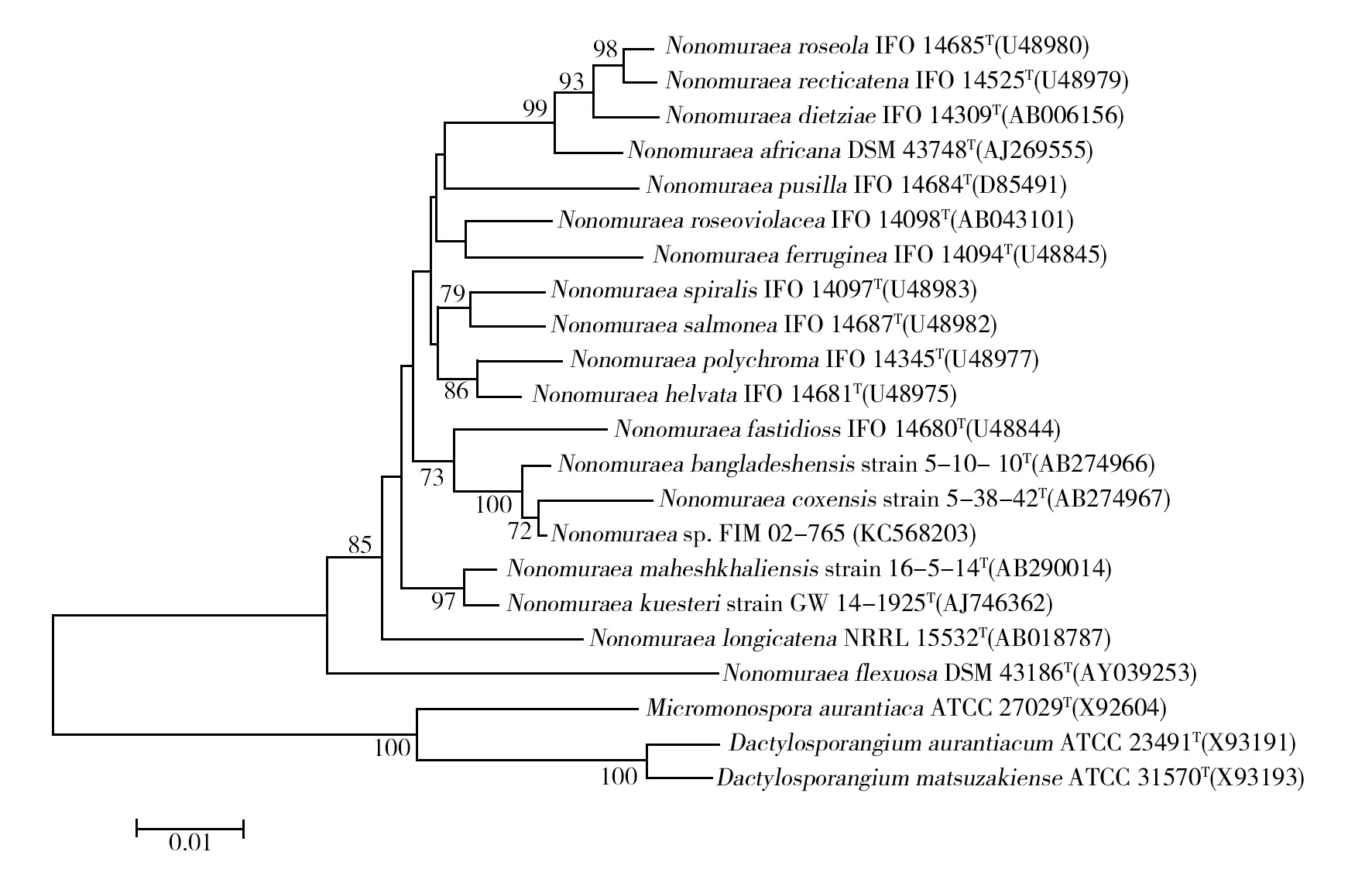
图2 菌株FIM02-765与相关菌种构建的基于16S rRNA基因序列的系统发育树Fig.2 Neighbour-joining tree based on nearly complete 16S rRNA gene sequences showing relationshipsbetween Nonomuraea sp. strain FIM 02-765 and all recognized species of the genus Nonomuraea
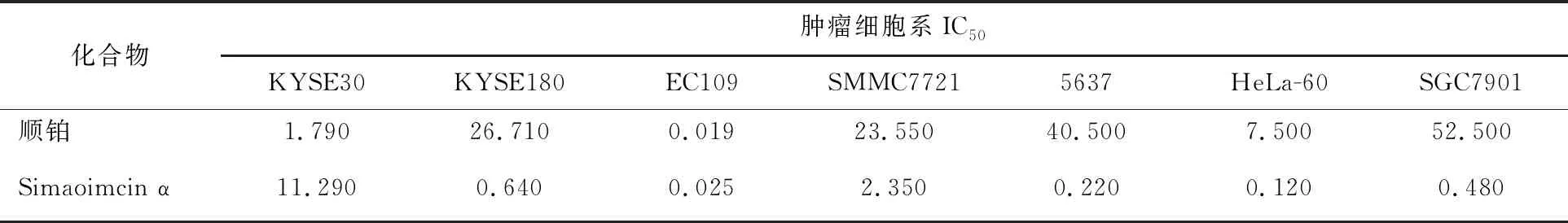
表3 Simaomicin α抑制肿瘤细胞增殖的活性
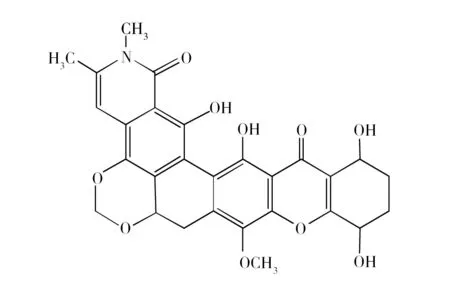
图3 化合物Simaomicin α的化学结构式Fig.3 Chemical structure of Simaomicin α
3 讨 论
野野村氏菌(Nonomuraeasp.)属于放线菌目(Actinobacterales)链孢囊菌亚目(Streptosporangineae)链孢囊菌科(Streptosporangiaceae),该属包括34个种和2个亚种[26]。绝大部分报道的野野村氏菌主要分离自水体、陆地环境的土壤和海底沉积物样品[27]。最近的研究表明,海底沉积物样品中存在一定数目的野野村氏菌[27-29]。本研究报道了1株台湾海峡海底沉积物样品来源的稀有放线菌FIM02-765,其形态和培养特征、生理生化特征和16S rRNA分析表明,该菌为野野村氏菌。同时,生理生化指标和全细胞水解分析进一步表明,菌株FIM02-765具有野野村氏菌典型的细胞壁III型和B型糖的特征[24-25]。许多研究表明,野野村氏菌是新天然产物的潜在来源,如Nonomuraeasp. 1808210CR 产生的β-咔啉衍生物nonocarbolines A~E[30],研究表明化合物nonocarboline B对冻土毛霉(Mucorhiemalis)具有中等强度的抑制活性,而nonocarboline D则对人肺癌细胞A-549具有较强的抑制细胞增殖的活性,其IC50达到1.7 μmol/mL;N.endophyticaGW58/450产生特异的萘乙酰胺噻唑类化合物Karamomycins A~C[31],研究还表明,Karamomycins A和C具有细胞毒活性。在前期的研究中,该菌产生的Simaomicin α具有较强的抗革兰阳性菌活性[11]。为了更深入地研究该化合物的生物学活性,本研究还探讨了Simaomicin α的抗肿瘤活性。结果表明,该化合物具有较强的抑制肿瘤细胞增殖的能力,其对人食管癌细胞株(KYSE180和EC109)、人肝癌细胞株(SMMC7721)、人膀胱癌细胞株(5637)、人白血病细胞株(HeLa-60)和人胃癌细胞株(SGC7901)的抑制活性都强于阳性对照药物顺铂。本研究进一步明确了该菌的分类地位,拓展了该菌代谢产物Simaomicin α的生物学活性,从而为菌株的遗传改良和开展Simaomicin α的生物合成研究提供参考。