纤维堆囊菌产埃博霉素B的发酵条件优化
龚国利,王 娜, 刘丽丽, 游银伟
(1.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 2.山东省农业科学院 高新技术研究中心, 山东 济南 250100)
0 引言
粘细菌是一类普遍存在于土壤、堆肥及腐败的树皮中的原核生物[1],属于革兰氏阴性细菌,具有复杂的多细胞行为[2].粘细菌是生物活性物质的生产者,能够产生广泛的具有活性的次级代谢产物,同时也是天然药物的优良资源之一.纤维堆囊菌是粘细菌中唯一能降解纤维素的种群[3],从中发现了许多作用机制独特、结构新颖的生物活性物质,引起了学者研究的兴趣.
埃博霉素(epothilone)是一类粘细菌纤维堆囊菌产生的天然大环内酯类物质[4,5],是一种新型的抗肿瘤药物.它的作用机制与紫杉醇相同,通过促微管聚合作用抑制肿瘤细胞的增殖[6,7],但它在水溶性、安全性以及抗肿瘤活性等方面优于紫杉醇[8].埃博霉素化学结构简单,易于进行修饰,引起了生物、医学、制药及有机合成等学科领域的高度重视.埃博霉素A和埃博霉素B是纤维堆囊菌产生的两种主要产物[9],因其在埃博霉素的类似物中活性较高而被广泛研究,其中埃博霉素B活性更高,大量体外实验的评价显示了埃博霉素B是紫杉醇最具希望的替代者[10].2007年,施贵宝公司开发的埃博霉素B衍生物Lxabepilone获得FDA批准在美国上市,在治疗乳腺癌方面具有明显的效果[11].
目前,埃博霉素产量低,不稳定,受培养条件和环境等因素的影响很大,这些因素为其开发和应用带来了很大的困难,所以在发酵生产过程中,主要通过菌种选育和优化发酵工艺条件来提高埃博霉素产量.微生物发酵的生产水平不仅取决于生产菌种本身的性能,而且要赋予合适的环境条件才能够使它的生产能力充分表现出来,这两个环节是相辅相成的.
为了提高埃博霉素B的产量,降低生产成本,本实验在前期优化培养基的基础上,通过单因素试验和正交试验设计对发酵条件进行优化,为其规模化生产奠定了基础.
1 材料与方法
1.1 材料
1.1.1 菌株
纤维堆囊菌SoF5-76(Sorangium cellulosum SoF5-76)本实验室保存菌.来源:由本实验室从土壤中筛选,经过基因组重组技术选育获得,埃博霉素B产量为14.3 mg/L[12].
1.1.2 培养基
(1)CNST培养基: KNO30.05%, Na2HPO40.025%,MgSO4·7H2O 0.1%, FeCl30.001%, 微量元素液1 mL/L, 琼脂2 %, pH 7.2.
(2)M26培养基:马铃薯淀粉0.8%,大豆蛋白胨0.2%,葡萄糖 0.2%, 酵母粉0.2%, MgSO40.1%,CaCl20.1%, EDTA-Fe3+1 mL/L, pH 7.2.
(3)发酵培养基:马铃薯淀粉3.9 g/L,脱脂奶粉2.2 g/L,无水氯化钙1.3 g/L,葡萄糖1 g/L,豆饼粉1.5 g/L,七水硫酸镁2.5 g/L,EDTA-Fe3+3 mL/L,微量元素(TE )0.5 mL/L,pH 7.2,树脂XAD-16 2% .1×105Pa高压蒸汽灭菌20 min.
1.1.3 主要试剂与仪器
(1)主要试剂:Epothilone B标准品购于Singma公司;XAD-16树脂购于美国Sigma公司.
(2)仪器: Waters-2487-2420-1525高效液相色谱仪,美国Waters公司.
1.2 试验方法
1.2.1 培养方法
(1)种子培养:将保藏在固体斜面培养基中的菌种接入放有已灭菌滤纸片的CNST平板上,倒置于恒温培养箱中在30 ℃条件下培养5~7 d后,转接于 M26培养基中,装液量为50/250 mL三角瓶,在30 ℃、170 r/min的条件下摇床培养72 h后,得到作为发酵培养的种子液.
(2)发酵培养:以5%(V/V)接种量将所得种子液接种到发酵培养基中进行摇床培养,发酵体系为300 mL三角瓶装液量为50 mL,在30 ℃、170 r/min的条件下摇床培养5 d.
1.2.2 埃博霉素B提取及含量测定
(1)埃博霉素B提取:发酵结束后,收集树脂,用10倍体积甲醇振荡浸提24 h后,弃去树脂,甲醇浸提液放入真空干燥箱中烘干,再加入500μL甲醇复溶,转移到离心管中.
(2)埃博霉素B检测:采用HPLC定量分析,液相色谱条件为:色谱柱,YWG,C18,10μm,250×4.6 mm;Waters-2487高效液相色谱仪;UV紫外检测器;检测波长,249 nm;流动相,甲醇∶水=65∶35(体积比);上样体积,20μL;时间,30 min;流速,1 mL/min.埃博霉素B的定量采用本实验室用的标准曲线,方程如下:
Y=0.132X+0.003 5
采用HPLC检测埃博霉素B所得的峰面积,根据标准曲线换算成埃博霉素B产量.
1.2.3 发酵条件优化
(1)单因素试验设计.采用单因素试验,分别考察发酵培养基的初始pH、装液量、转速、接种量、种龄、温度和发酵时间对埃博霉素B产量的影响.
(2)正交试验设计.在单因素试验的基础上,选取部分对埃博霉素B产量影响较大的因素(初始pH、装液量、接种量、温度)进一步进行发酵条件的优化,每个因素设定三个水平,采用四因素三水平正交设计L9(34)进行试验.正交试验因子与水平设计见表1.
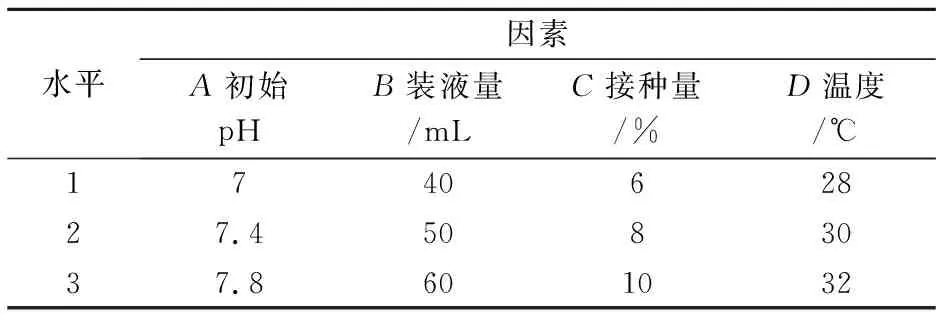
表1 正交试验因子与水平设计
2 结果与讨论
2.1 不同单因素对埃博霉素B发酵产量的影响
2.1.1 培养基初始pH对埃博霉素B产量的影响
pH是影响微生物正常生理活动的一个重要指标[13],纤维堆囊菌培养的pH范围是中性的,为了确定菌株发酵产埃博霉素B的最佳pH,选择了初始pH为5.0、5.8、6.6、7.4、8.2的发酵培养基进行试验,其他培养条件保持不变,即种龄为72 h,接种量5%(V/V),装液量为50 mL /250 mL,在30 ℃、170 r/min的条件下摇床培养5 d.试验结果如图1所示.分析可知,在发酵培养基初始pH为7.4时,埃博霉素B产量达到最大值为28.02 mg/L.
图1 培养基初始pH对埃博 霉素B产量的影响
2.1.2 装液量对埃博霉素B产量的影响
在微生物发酵过程中,控制溶氧,满足生产菌对养分的需求,是提高发酵水平的关键因素之一[14].摇瓶发酵时,培养基的装液量与摇床转速基本可以反映溶氧水平.在初始pH 7.4、转速170 r/min、种龄为72 h、接种量5%(V/V)、温度30 ℃、发酵时间为5 d的条件下,本次试验通过改变250 mL摇瓶装液量,研究不同装液量对埃博霉素B发酵产量的影响.实验结果见图2.结果显示,装液量对埃博霉素B产量影响显著,装液量为20 mL时,虽然溶解氧量充足,但由于养分不足,菌体生长缓慢,导致埃博霉素B产量较低.随着装液量增加,养分充足,埃博霉素B产量开始增加,装液量增加到50 mL时,产量达到最大为28.53 mg/L.继续增加装液量,由于溶解氧不足,菌体生长受限制,发酵产量开始下降.故选取50 mL为最适装液量.
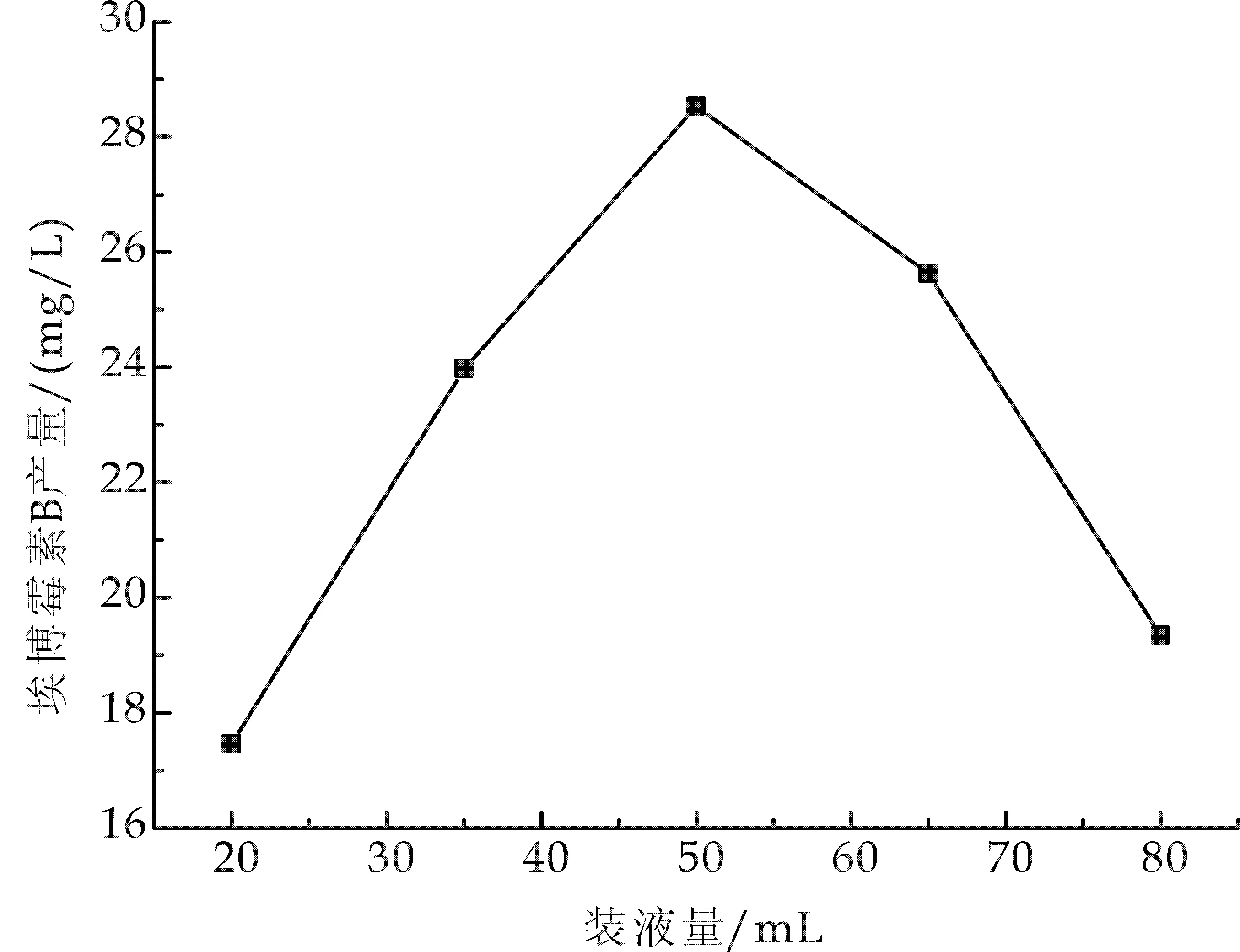
图2 装液量对埃博霉素B产量的影响
2.1.3 摇床转速对埃博霉素B产量的影响
摇床转速同样影响发酵液中氧气的溶解量.在初始pH为7.4、装液量为50/250 mL、种龄为72 h、接种量5%(V/V)、温度30 ℃、发酵时间为5 d的条件下,改变转速(140 r/min、160 r/min、180 r/min、200 r/min、220 r/min),进行发酵培养.发酵结束后进行埃博霉素B检测,结果如图3所示.经分析可知,当摇床转速较低时,发酵液中溶解氧量不足,不利于菌体生长,导致埃博霉素B发酵产量较低,当转速达到200 r/min时,产量达到最大值为29.81 mg/L.随着转速继续升高,发酵产量开始下降,可能是由于转速过高,使部分菌受到破坏,从而使发酵产量下降.所以选取200 r/min为摇床转速的最优值.

图3 摇床转速对埃博霉素B产量的影响
2.1.4 种龄对埃博霉素B产量的影响
在发酵过程中,种龄能够影响种子的质量及接入发酵培养基的效果,生命力旺盛的种子有利于菌体生长,老化的种子不利于菌体的生长繁殖,会影响菌株发酵产量.在初始pH为7.4、装液量为50/250 mL、转速为200 r/min、接种量为5%(V/V)、温度为30 ℃、发酵时间为5 d的条件下,本试验选取不同种龄的种子进行摇瓶发酵实验,结果见图4.经分析可知,种龄在36~60 h变化时,埃博霉素B产量随之增加,在60 h时,达到最大值为30.16 mg/L.种龄继续增大,埃博霉素B产量先缓慢下降,然后迅速降低.故最适种龄为60 h.

图4 种龄对埃博霉素B产量的影响
2.1.5 接种量对埃博霉素B产量的影响
在抗生素发酵过程中,采用较大的接种量可以缩短菌体增殖时间,提高抗生素产量.但是接种量过大会使菌体生长过快,造成营养基质缺乏或溶氧不足,影响抗生素的合成.为了提高埃博霉素B产量,必须选择合适的接种量.在初始pH为7.4、装液量为50/250 mL、转速为200 r/min、种龄为60 h、温度为30 ℃、发酵时间为5 d的条件下,研究不同接种量对埃博霉素B产量的影响.由图5可知,当接种量为2%时,由于菌体数量限制使得埃博霉素B产量较低,随着接种量增大,产量缓慢增加,当接种量为8%时,产量达到最大值为30.63 mg/L.接种量继续增大,产量却随之降低.因此本试验选取8%为最适接种量.

图5 接种量对埃博霉素B产量的影响
2.1.6 温度对埃博霉素B产量的影响
在初始pH为7.4、装液量为50/250 mL、转速为200 r/min、种龄为60 h、接种量为8%(V/V)、发酵时间为5 d的条件下,研究不同温度对埃博霉素B产量的影响.由图6可知,低温不利于纤维堆囊菌发酵产埃博霉素B,随着温度升高,菌体代谢加快,埃博霉素B产量大幅度提高,当温度达到30 ℃时,发酵产量最高为30.15 mg/L.随着温度继续升高,产量却大幅度降低,故最适温度为30 ℃.

图6 温度对埃博霉素B产量的影响
2.1.7 发酵时间对埃博霉素B产量的影响
埃博霉素B为纤维堆囊菌的次级代谢产物,稳定期开始大量积累,同时接种量也对发酵时间有一定的影响.本次试验在初始pH为7.4、装液量为50/250 mL、转速为200 r/min、种龄为60 h、接种量为8%(V/V)、温度为30 ℃的条件下,进行摇瓶发酵,分别培养3、4、5、6、7 d后进行埃博霉素B检测,试验结果如图7.结果分析可知,发酵时间为6 d时,埃博霉素B产量达到最高31.28 mg/L.继续增加培养时间,产量基本保持不变,故最适发酵时间为6 d.
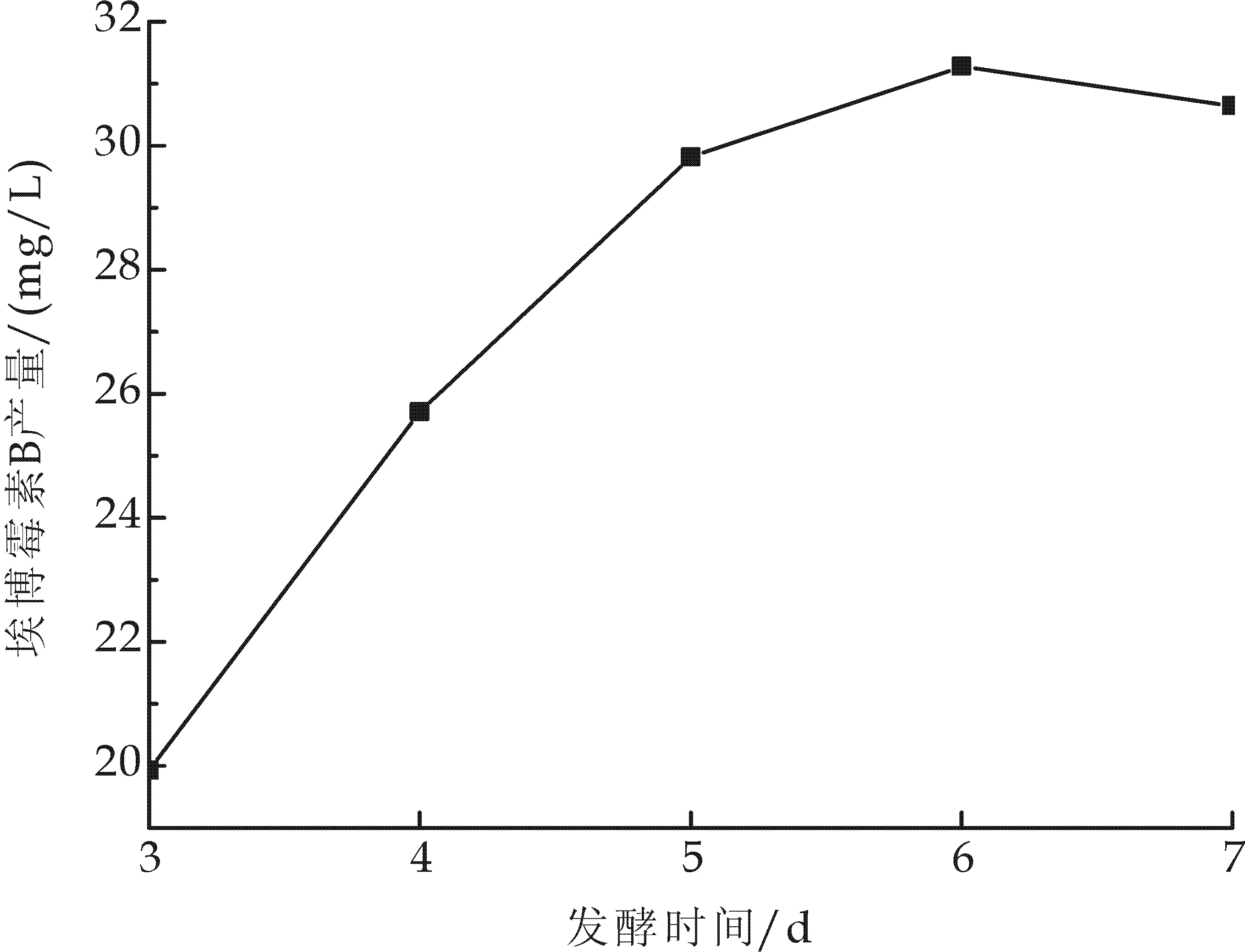
图7 发酵时间对埃博霉素B产量的影响
2.2 正交试验设计
根据上述单因素试验结果,初始pH、装液量、接种量、温度对纤维堆囊菌发酵产埃博霉素B的影响较大,将这4个因素进一步通过四因素三水平L9(34)正交试验进行优化,得到最优组合.正交试验结果以及直观分析结果见表2.
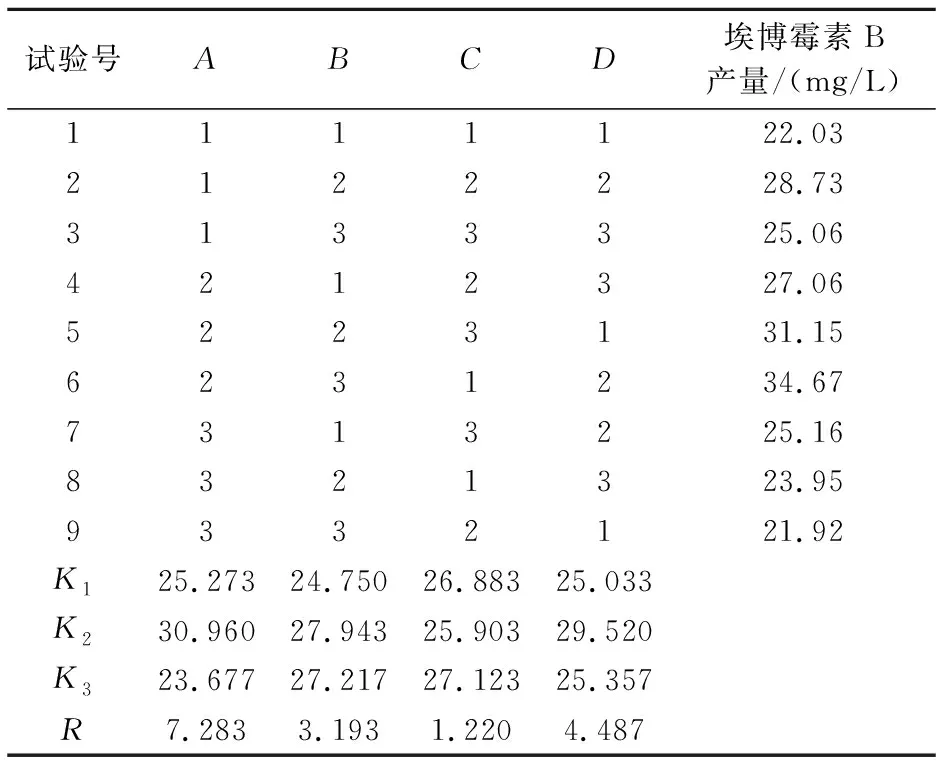
表2 正交试验结果与分析
由表2可知,RA>RD>RB>RC,即选取的4个因素对埃博霉素B产量影响的主次关系为:初始pH>温度>装液量>接种量,表明发酵培养基的初始pH对埃博霉素B发酵产量影响最为显著,最不显著的影响因子为接种量.此外从表中还可以看出发酵条件的最优组合为:A2B2C3D2,即初始pH为7.4,装液量为50 mL/250 mL,接种量为10%,温度为30 ℃.由于正交试验表中没有符合此发酵条件的方案,所以按照上述得到的最优发酵条件做验证试验.
2.3 验证试验
在上述所得到的最优发酵条件下进行摇瓶发酵,同时将优化前的发酵条件即在初始pH为7.2、种龄为72 h、接种量5%(V/V)、装液量为50 mL/300 mL、温度30 ℃、转速170 r/min、发酵时间5 d的条件下作为对照.试验结果见表3.由表3可知,最优发酵条件下埃博霉素B的产量为35.24 mg/L,与优化前(29.95 mg/L)相比产量提高了17.67%.
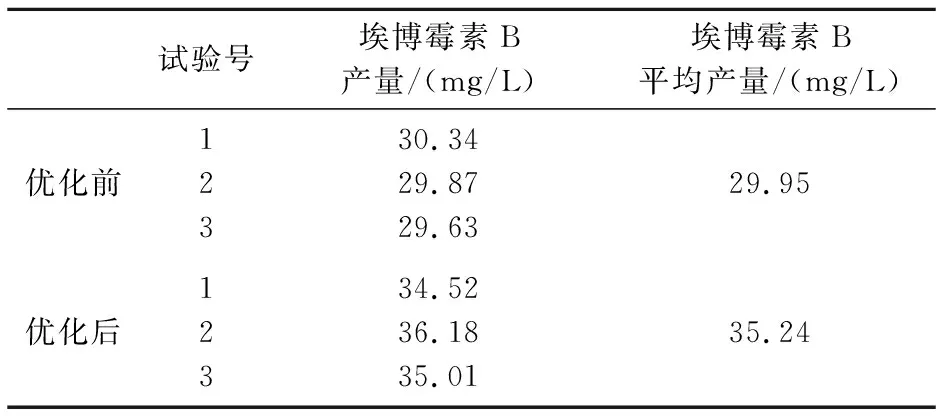
表3 验证试验
3 结论
纤维堆囊菌易受菌体本身以及环境条件的影响,进而影响菌体的生物合成能力.为了提高埃博霉素B的产量,以降低生产成本,本试验在前期优化发酵培养基的基础上,进一步对发酵条件进行优化.首先采用单因素试验考察初始pH、装液量、转速、种龄、接种量、温度、发酵周期7个因素对埃博霉素B产量的影响,得到各因子的最优水平.在单因素试验的基础上,将对埃博霉素B影响较大的因素(初始pH、装液量、接种量、温度)进一步进行正交试验,得到最优组合.最终确定最优发酵条件为:初始pH7.4、装液量50 mL、转速200 r/min、种龄60 h、接种量10%、温度30 ℃、发酵周期6 d.在此最优条件下进行摇瓶发酵,埃博霉素B产量达到35.24 mg/L,比优化前(29.95 mg/L)提高了17.67%.
[1] H Reichenbach.Myxobacteria,producers of novel bioactive substances[J].Journal of Industrial Microbiology & Biotechnology,2001,27:149-156.
[2] 吴斌辉,李越中,王溱圯,等.纤维堆囊菌生长及限制因素的研究[J].生物技术,2001,11(3):16-18.
[3] 韩莉莉,卢育新,王 赫,等.培养基组成对纤维堆壤菌产epothilone的影响[J].微生物学杂志,2008,28(6):103-106.
[4] Meng F X,Li Y X,Guo W L,et al.Optimization of fermentation medium for epothilones production with sequential statistical approach[J].Chemical Research in Chinese Universities,2010,26(1):86-91.
[5] Sang Woo Park,Se Jong Han,Dong-Shik Kimb,et al.Improvement of epothilone B production by in situ removal of ammonium using cation exchange resin in sorangium cellulosum culture[J].Biochemical Engineering Journal,2007,37:328-331.
[6] 罗立新,汪 薇,陆一鸣,等.纤维堆囊菌发酵产生epothilone条件的优化[J].华南理工大学学报(自然科学版),2006,34(5):48-52.
[7] Robert L.Arslanian,Charles D.Parker,Peter K,et al.Large-cale isolation and crystallization of epothilone D from myxococcus xanthus cultures[J].Journal of Natural Products,2002,65(4):570-572.
[8] 王向阳,陈少欣.埃坡霉素高产菌株的选育及发酵培养基的优化[J].中国医药工业杂志,2011,42(4):258-261.
[9] Regentin R,Frykman S,Lau J,et al.Nutrient regulation of epothilone biosynthesis in heterologous and native production strains[J].Applied Microbiology and Biotechnology,2003,61:451-455.
[10] 诸景光,罗立新.基于响应面法的Epothilone发酵优化[J].现代食品科技,2009,25(7):771-774.
[11] 王大红,原江锋,郭文杰.产Epothilone B纤维堆囊菌的选育与发酵优化[J].生物技术,2012,22(3):70-73.
[12] 龚国利,陈 松,李 慧,等.基因重组技术选育埃博霉素B高产菌株[J].中国抗生素杂志,2013,38(2):106-110.
[13] 杨生玉,王 刚,沈永红.微生物生理学[M].北京:化学工业出版社,2007.
[14] 骆健美.纳他霉素高产菌株选育、发酵条件优化、发酵动力学及溶解度的研究[D].杭州:浙江大学,2005.

