水杨梅中化学成分活性的研究
杨秀芳, 王改利, 马养民, 张 鑫, 刘建军
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.西北农林科技大学 林学院, 陕西 杨凌 712100)
0 引言
水杨梅(Geumaleppicum)为蔷薇科(Rosaceae)水杨梅属多年生草本植物,主要分布于我国西北、华北、东北、西南等地区[1].作为传统中药,民间以其全草或根入药,具有清热解毒、利尿、消肿止痛之功效[2].水杨梅的化学成分主要有三萜、黄酮、鞣质[3-5],该类化合物主要用于抗HIV(艾滋病毒)活性、抗HSV(疱疹病毒)活性[6,7].1994年,McCutcheon AR等[8]报道了水杨梅属植物GeummacrophyllumWilld. var.macrophyllum的甲醇提取物具有抑制微生物生长的作用.其同属近缘植物Geumrivale也显示出抗微生物的活性[9],结果表明其中的三萜类成分活性最强,其次为黄酮类和鞣质类成分.为了进一步研究水杨梅化学成分的活性作用,本文首次对从水杨梅分离纯化得到的化合物的抑菌活性和抗氧化活性进行研究,并分析其构效关系,期望从中获得抑菌活性或抗氧化活性好的化合物,为进一步开发利用水杨梅植物资源提供理论依据.
1 材料与方法
1.1 材料
1.1.1 样品
从水杨梅中分离纯化得到的β-谷甾醇、熊果酸、山奈酚、槲皮素、山奈酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷和胡萝卜苷[10];从其它植物样品中提取分离到的芹菜素、木犀草素、芹菜素-7-O-β-D-葡萄糖苷、木犀草素-7-O-β-D-葡萄糖苷[11].
1.1.2 供试菌种
细菌5株:大肠杆菌(Esherichiacoli)、绿脓杆菌(Pseudomonasaeruginosa)、乳链球菌(Streptococcuslactis)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacilussubtilis);
1.1.3 培养基
牛肉膏0.5 g,蛋白胨1.0 g,NaCl 0.5 g,琼脂2.0 g,水100 mL,pH7.0~7.2,121 ℃灭菌20 min.
1.2 仪器
SW-CJ-1FD超净工作台(上海博迅实业有限公司医疗设备厂)、YX280B手提式压力蒸汽灭菌锅(上海三申医疗器械有限公司)、DH5000B电热恒温培养箱(天津市泰斯特仪器有限公司)、HZQ-Q全温振荡器(哈尔滨东联电子技术开发有限公司)、DNM-9602A型酶标分析仪(北京普朗新技术有限公司).
1.3 实验方法
1.3.1 菌悬液制备
将在固体培养基上培养的大肠杆菌(E.c)、绿脓杆菌(P.a)、乳链球菌(S.l)金黄色葡萄球菌(S.a)、枯草芽孢杆菌(B.s)从恒温培养箱中取出,在灭菌后的超净工作台上将以上各菌接种至配制好的液体培养基中,再将接菌后的液体培养基转移至全温振荡器,温度恒定在28 ℃培养48 h,备用.
把高温灭过菌的培养基倒平板,冷却凝固,在无菌条件下,用接种环刮取少许的细菌接种到培养基上,再置于37 ℃的恒温培养箱中活化培养24 h.挑取少许的活化测试菌菌种放入5 mL无菌水中,摇匀,通过血球计数板配成含菌106CFU/mL的菌悬液.
1.3.2 试样制备方法
将从水杨梅中分离纯化得到的β-谷甾醇、熊果酸、山奈酚、槲皮素、山奈酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷和胡萝卜苷,分别称取0.2 mg,用2 mL二甲基亚砜溶解,配制成浓度为0.1 mg/mL溶液,备用.
精确称取山奈酚、槲皮素、山奈酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷、芹菜素、木犀草素、芹菜素-7-O-β-D-葡萄糖苷、木犀草素-7-O-β-D-葡萄糖苷,用乙醇分别配成质量浓度为1 000μg/mL的待测样品1和质量浓度为200μg/mL的待测样品2.同时配制相同浓度的抗坏血酸和BHT乙醇溶液作为对照,备用.
DPPH溶液的配制 准确称取DPPH(1,1-二苯基-2-三硝基苯肼)0.020 0 g,无水乙醇溶解定容至100 mL容量瓶,配成浓度为0.200 mg/mL的DPPH乙醇溶液,置于冰箱中冷藏备用.
1.3.3 最小抑菌浓度(MIC)的测定
(1)取紫外消毒的96孔板,竖排依次编号A、B、C、D、E、F、G、H、I,横排依次编号1、2、3、4、5、6、7、8、9、10、11(编号为A1、 A2、 A3、 A4、 A5、 A6、 A7、A8、A9、A10、A11,B1-B11……H1-H11,I1-I8).选取一种稀释过的菌悬液,在灭菌的超净工作台上,将编好号的96孔板用移液枪全部注入150μL液体培养基.
(2)取配制好的待测β-谷甾醇样品,用移液枪吸取150μL注入在已有菌悬液的A1孔中混匀.待菌悬液与β-谷甾醇样品混匀后,再用移液枪从A1孔中吸取混合液体150μL,注入A2孔中混匀.再从A2孔中吸取此混合液体150μL,注入A3孔中.重复上述操作过程,直到从A11孔中吸取出150μL混合溶液弃掉.A12孔则作为生长对照.经过此步操作A1-A11孔中β-谷甾醇样品浓度则依次倍半稀释.
(3)按照步骤(2),将B1-B11注入熊果酸,C1-C11注入山奈酚,D1-D11注入槲皮素,E1-E11注入山奈酚-3-O-β-D-葡萄糖苷,F1-F11注入槲皮素-3-O-β-D-葡萄糖苷,G1-G11注入胡萝卜苷.H1-H11为阳性对照,革兰氏阳性菌注入青霉素钠样品溶液,革兰氏阴性菌注入硫酸链霉素样品溶液,I1-I11为空白对照.
(4)向所有板孔中加入10μL一种菌悬液.再取96孔板,按照步骤(1)~(3)把其它4种测试菌与各个待测样品混合,完成后,将所有96孔板放入培养箱中,37 ℃恒温培养24 h.
(5)通过肉眼观察,判定该化合物的最小抑菌浓度(MIC).
1.3.4 抗氧化活性测定(DPPH法)
参考文献[12-14]的方法并稍加改变,采用倍半稀释法制备不同浓度待测液.
(1)取96孔板,竖排依次编号A、B、C、D、E、F、G、H,横排依次编号1-12.将编号的所有孔板用移液枪分别注入100μL无水乙醇.
(2)取配制好的山奈酚待测样品1,用移液枪吸取100μL注入在已有100μL无水乙醇的A1孔中混匀.从A1孔中吸取混合液体100μL,注入到A2孔中混匀.重复上述操作,直到最后从A11孔中吸取出100μL混合溶液弃掉,A12孔做空白对照.待测样品浓度A1-A11依次倍半稀释.按同样方法,将B1-B11也注入山奈酚待测样品1.其余板孔可注入其它待测样品(如C1-C11和D1-D11为山奈酚待测样品2;E-H为槲皮素待测样品1,2),同时测定.
(3)用移液枪分别吸取100μL配制好的DPPH溶液,加入到A1-A12孔中;分别吸取100μL无水乙醇,加入到B1-B12孔中.室温下避光35 min,在517 nm波长下酶标仪测定各个孔的吸光度.
(4)平行测定3次,按公式计算DPPH自由基清除率(E).
其中,Aj表示100μL不同浓度样品+100μL的DPPH溶液的吸光度;Ai表示100μL不同浓度样品+100μL溶剂(无水乙醇)的吸光度;A0表示100μL的DPPH溶液+100μL溶剂(无水乙醇)的吸光度.
(5)以试样浓度为横坐标,清除率为纵坐标,绘制散点图.选取清除率在20%~80%的点进行线性回归,并计算清除率为50%时的浓度值,即IC50值.
2 结果与讨论
2.1 化合物的抑菌活性
水杨梅中分离得到的β-谷甾醇(Ⅰ)、熊果酸(Ⅱ)、山奈酚(Ⅲ)、槲皮素(Ⅳ)、山奈酚-3-O-β-D-葡萄糖苷(Ⅴ)、槲皮素-3-O-β-D-葡萄糖苷(Ⅵ)和胡萝卜苷(Ⅶ)的MIC测试结果见表1.山奈酚对所有测试菌均有不同程度的抑制活性,尤其是对大肠杆菌的最小抑菌浓度达到7.8μg/mL;槲皮素对金黄色葡萄球菌的最小抑菌浓度为31.2μg/mL,对其它测试菌为125μg/mL;熊果酸、山奈酚-3-O-β-D-葡萄糖苷和槲皮素-3-O-β-D-葡萄糖苷对所有测试菌的活性均在250μg/mL左右;β-谷甾醇和胡萝卜苷对绿脓杆菌的最小抑制浓度为250μg/mL,对其它测试菌则未显示出抑制作用.结果表明山奈酚具有良好的抑菌作用.
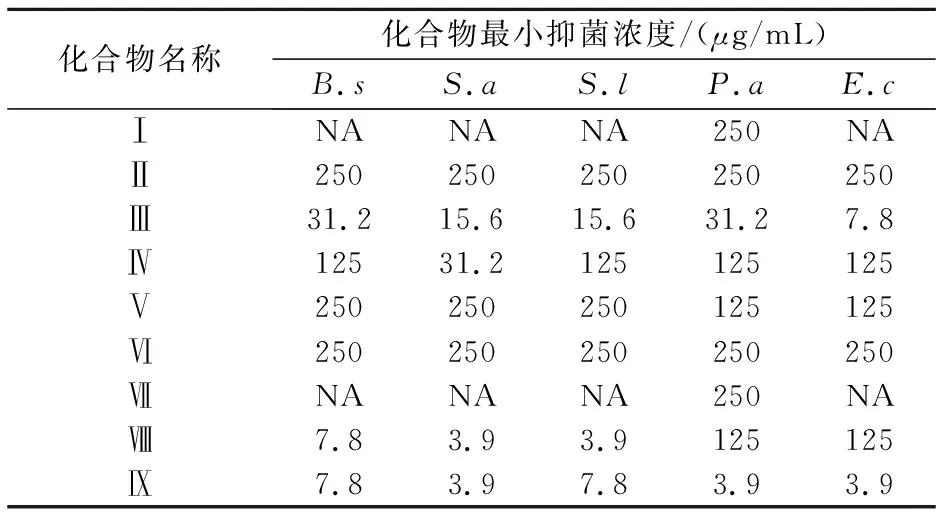
表1 不同化合物对细菌最小抑菌浓度
注:Ⅷ-青霉素钠,Ⅸ-硫酸链霉素,NA-未检出.
2.2 化合物的抗氧化活性
通过DPPH法,按照1.3.4,测试不同化合物的抗氧化能力,结果见表2.
通过测定不同质量浓度的山奈酚、槲皮素、山奈酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷以及芹菜素、芹菜素-7-O-β-D-葡萄糖苷、木犀草素-7-O-β-D-葡萄糖苷对DPPH自由基清除率,并计算得各化合物的IC50值.发现:这些黄酮类化合物的抗氧化能力由强到弱排序为槲皮素>槲皮素-3-O-β-D-葡萄糖苷>山奈酚>木犀草素>木犀草素-7-O-β-D-葡萄糖苷>山奈酚-3-O-β-D-葡萄糖苷>芹菜素>芹菜素-7-O-β-D-葡萄糖苷.

表2 各化合物抗氧化能力的IC50值
2.3 黄酮类化合物抗氧化能力的构效关系
黄酮类化合物主要泛指2个苯环(A与B环)通过中央三碳链相互连结而成的一系列化合物[15].对比各黄酮类化合物的化学结构以及实验测定结果(见表3)可以发现有以下构效关系:
(1)酚羟基多,活性强,五羟基黄酮槲皮素>四羟基黄酮山奈酚和木犀草素>三羟基黄酮芹菜素.
(2)黄酮醇大于黄酮.山奈酚、槲皮素优于芹菜素和木犀草素,特别是同为四羟基的山奈酚要大于木犀草素.
(3)B环酚羟基活性高于A环,且邻二酚羟基最为明显.木犀草素糖苷为A环一个羟基,B环两个羟基,其活性大于A环两个羟基,B环一个羟基的山奈酚糖苷.
(4)苷元的活性大于糖苷,各个黄酮苷与其苷元均是如此.

表3 黄酮类化合物的化学结构及IC50值
续表3
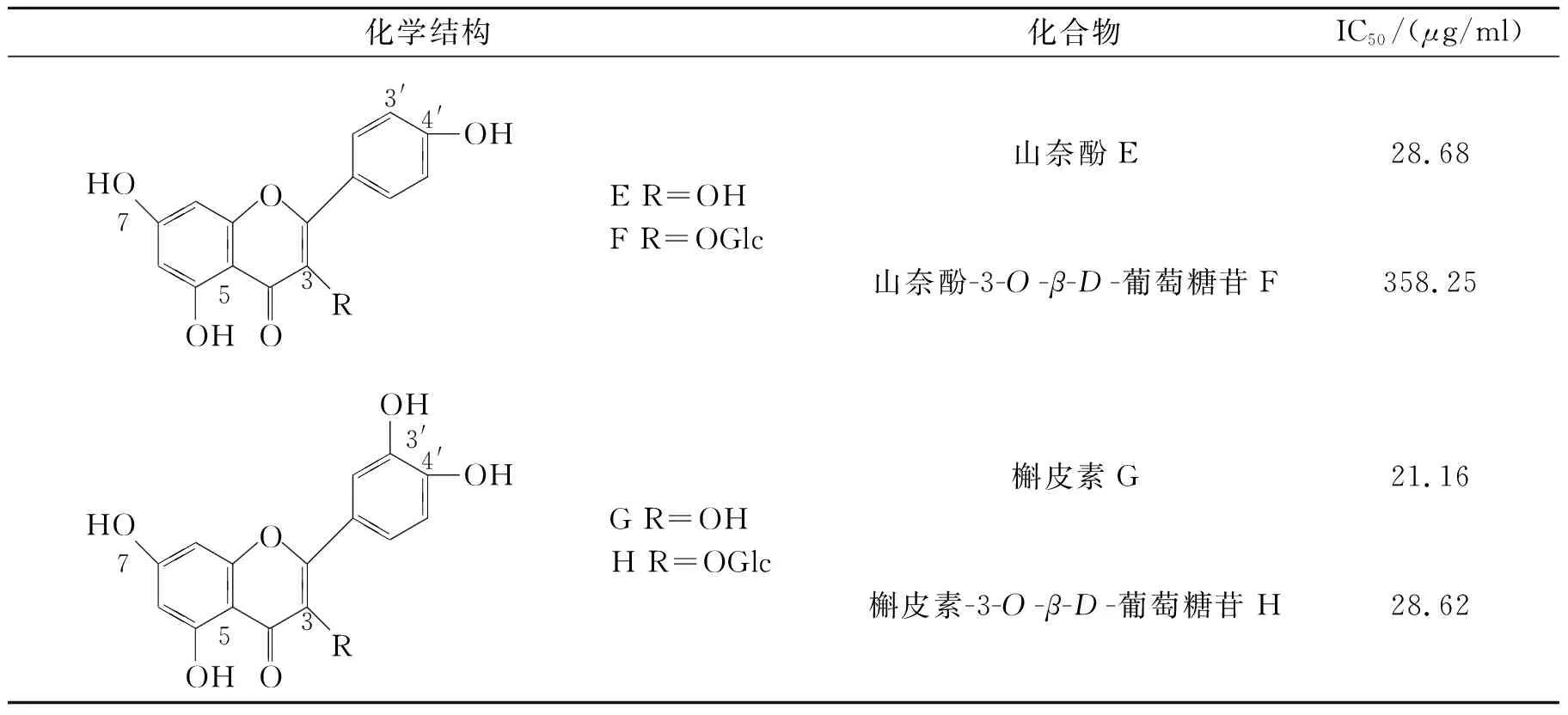
化学结构化合物IC50/(μg/ml)OH 57 HOOOR33'4'OHE R=OHF R=OGlc山奈酚E山奈酚-3-O-β-D-葡萄糖苷F28.68358.25OH 57 HOOOR3OH 3'4'OHG R=OHH R=OGlc槲皮素G槲皮素-3-O-β-D-葡萄糖苷H21.1628.62
3 结论
(1)水杨梅中含有丰富的具有生物活性的物质.分离纯化得到的系列化合物(β-谷甾醇、熊果酸、山奈酚、槲皮素、山奈酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷和胡萝卜苷)对细菌均有不同的抗菌活性.相比之下,山奈酚的抑菌活性最好,对革兰氏阳性菌和阴性菌都具有较好的活性;槲皮素的活性较山奈酚相对弱些;黄酮苷和三萜类的熊果酸对所有测试菌的活性都不强;β-谷甾醇和胡萝卜苷这类甾体化合物基本没有抑菌活性.
(2)黄酮类化合物因结构不同而具有不同的抗氧化能力.从水杨梅中分离得到的黄酮醇类化合物具有良好的抗氧化性,可以作为天然的抗氧化剂植物原料开发利用.
[1] 中国科学院中国植物志编辑委员会.中国植物志(37卷)[M].北京:科学出版社,1985:221-223.
[2] 《全国中草药汇编》编写组.全国中草药汇编[M].北京:人民卫生出版社,1975:608-609.
[3] 李建宽,刘宏伟,王乃利,等.柔毛水杨梅化学成分研究(Ⅱ)[J].中国药物化学杂志,2009,19(2):135-139.
[4] 赵 晶,高文远,段宏泉,等.日本水杨梅的化学成分研究[J].中草药,2008,39(7):978-981.
[5] 牟凤辉.草本水杨梅中黄酮类化学成分的研究[D].长春:吉林大学,2007.
[6] Xu H X,Ming D S,Dong H,et al.A new anti-HIV triterpene from Geum japonicum[J].Chem Pharm Bull,2000,48(9):1 367-1 369.
[7] Xu H X,Kadota S,Wang H,et al.New hydrolyzable tannin from Geum japonicum and its antiviral activity[J].Heterocycles,1994,38(1):167-175.
[8] Mccutcheon A R,Ellis S M,Hancock R E,et al.Antifungal screening of medical plants of british columbian native peoples[J].J Ethnopharmacol,1994,44(3):157-169.
[9] Oszmianskia J,Wojdyloa A,Lamer Zarawskab E,et al.Antioxidant tannins from Rosaceae plant roots[J].Food Chemistry,2007,100(2):579-583.
[10] 张 鑫,马养民,王冬梅,等.水杨梅化学成分的研究(Ⅰ)[J].西北林学院学报,2012,27(6):124-127.
[11] 王 媛,马养民,刘建军,等.太白山地区木姜子枝叶的化学成分[J].中国实验方剂学杂志,2012,18(18):124-126.
[12] Wang H,Cao G H,Prior R L.Total antioxidant capacity of fruits[J].J Agric Food Chem,1996,44:701-705.
[13] 郭雪峰,岳永德,汤 锋,等.用清除有机自由基DPPH法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(7):1 578-1 579.
[14] 孙丽萍,穆雪峰,施海燕,等.北京洋槐蜜化学成分及其抗氧化活性[J].食品科学,2012,33(9):77-80.
[15] 张红雨.黄酮类抗氧化剂结构活性关系的理论解释[J].中国科学,1999,29(1):91-96.

