高效液相色谱法检测金花菌固态发酵中他汀类物质
吕嘉枥, 王 珊, 王 柳
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
金花菌属于益生菌,是茯砖茶“发花”过程中的优势菌[1],存在于茯砖茶断面,呈大量肉眼可见的金黄色亮黄菌群状[2].有研究证明金花菌发酵液表现出了强的调脂减肥功能[3-8].他汀类物质为有效降血脂成分,呈白色针状晶体,易溶于甲醇、乙醇、三氯甲烷、苯、碱性水溶液等[9、10].目前常用检测方法有紫外分光光度法、薄层色谱法、高效液相色谱法[11-13],但研究对象大多集中于红曲霉、土曲霉、青霉等霉菌代谢物的研究,而对金花菌的研究却没有涉及[14-16].
本文在前人对金花菌研究的基础上对金花菌进行固态发酵培养, 通过HPLC法对金花菌乙酸乙酯提取液进行他汀类物质的快速准确检测,得到了最佳的色谱分析条件并测其含量,为优化生产工艺提供了一定的研究基础.
1 材料与方法
1.1 菌种
陕西科技大学微生物实验室提供冠突散囊菌菌种.
1.2 材料
1.2.1 主要设备与试剂
(1)设备: KH-100B型超声波清洗器(昆山禾创超声仪器有限公司),DHP9080电热恒温培养箱(上海佳胜实验设备有限公司),SW-CG-1D型超净工作台(苏净集团安泰公司制造),HC-3018R高速冷冻离心机(安微中科中佳科学仪器有限公司),UV-2600紫外分光光度计(龙尼柯仪器有限公司),HPLC高效液相色谱仪(美国安捷伦科技有限公司).
(2)试剂:乙酸乙酯、甲醇、氯仿、氨水、碘等,均为分析纯;甲醇,色谱纯.
1.2.2 培养基
(1)CZG(5%NaCl)培养基:分别称取蔗糖4 g、NH4NO30.3g、K2HPO40.1 g、MgSO4·7H2O 0.05 g、NaCl 5 g、琼脂2 g、水100 mL,121 ℃灭菌20 min.
(2)固体培养基:麸皮10 g,水7 mL,放入250 mL的三角瓶中,用玻璃棒搅拌使水分散均匀,121 ℃灭菌30 min.
1.3 方法
1.3.1 冠突散囊菌的培养
取冰箱保藏菌种于28 ℃的斜面培养基CZG(5%NaCl)活化5 d,制备孢子菌悬液,孢子数106个/mL,吸取1 mL菌悬液接种于麸皮培养基,于28 ℃培养7 d.
1.3.2 对照品溶液的制备
洛伐他汀标准品溶液的制备:精密称取2 mg的洛伐他汀标准品,于10 mL的容量瓶中用甲醇溶液定容,超声10 min使之溶解完全,配制成浓度为0.2 mg/mL的标准溶液.
1.3.3 样品溶液的制备
称取干燥的金花菌固体培养物适量,置于研钵中粉碎至细粉状,称取已粉碎好的金花菌粉末5 g置于500 mL试剂瓶中,按1∶20的料液比加入100 mL乙酸乙酯溶液,超声20 min使之提取完全,过滤,重复上述操作2次,合并滤液,滤液中加入活性炭除色素后真空浓缩,用甲醇定容于25 mL的容量瓶中.于冰箱中放置24 h,底层沉淀,离心,取上清液,用0.45μL的有机滤膜过滤后待用.
1.3.4 HPLC色谱条件选择
洛伐他汀易溶于甲醇、乙醇、三氯甲烷、苯、乙酸丁酯、乙酸乙酯等溶液.提取剂的不同对洛伐他汀的提取影响很大,其中乙酸乙酯提取液中洛伐他汀含量提取率高,杂质含量小,洛伐他汀峰与杂质峰的分离度良好,且乙酸乙酯低沸点有利于后期浓缩,所以本实验选用乙酸乙酯作为提取剂.
色谱柱型选择C18柱.因为洛伐他汀在甲醇溶液中 48 h内稳定性良好,有利于保存,且酸型洛伐他汀不易转化为内酯型洛伐他汀,色谱图出峰良好,所以选择甲醇∶水=80∶20为流动相.洛伐他汀紫外吸收峰分别为230 nm、 238 nm、246 nm,其中238 nm为最大吸收峰,所以检测波长选择238 nm.流速选择1.0 mL/min.柱温为室温.进样量20μL.
2 结果与讨论
2.1 他汀类物质色谱条件的影响
2.1.1 流动相种类的选择
在室温下,当流动相比例为80∶20,流速1 mL/min时,分别使用甲醇∶水、甲醇∶磷酸水、乙腈∶水、乙腈∶磷酸水为流动相,记录保留时间,如表1所示.由表1可知,得出的保留时间相差不大.

表 1 流动相种类的影响
图2、图4显示加入磷酸水影响到洛伐他汀的转型,出峰不稳定且峰型杂乱;而图1、图3则显示出峰型良好.所以在甲醇∶水和乙腈∶水等中,选择了保留时间为15.419, 且无毒的甲醇∶水,从而使组分分离度良好.
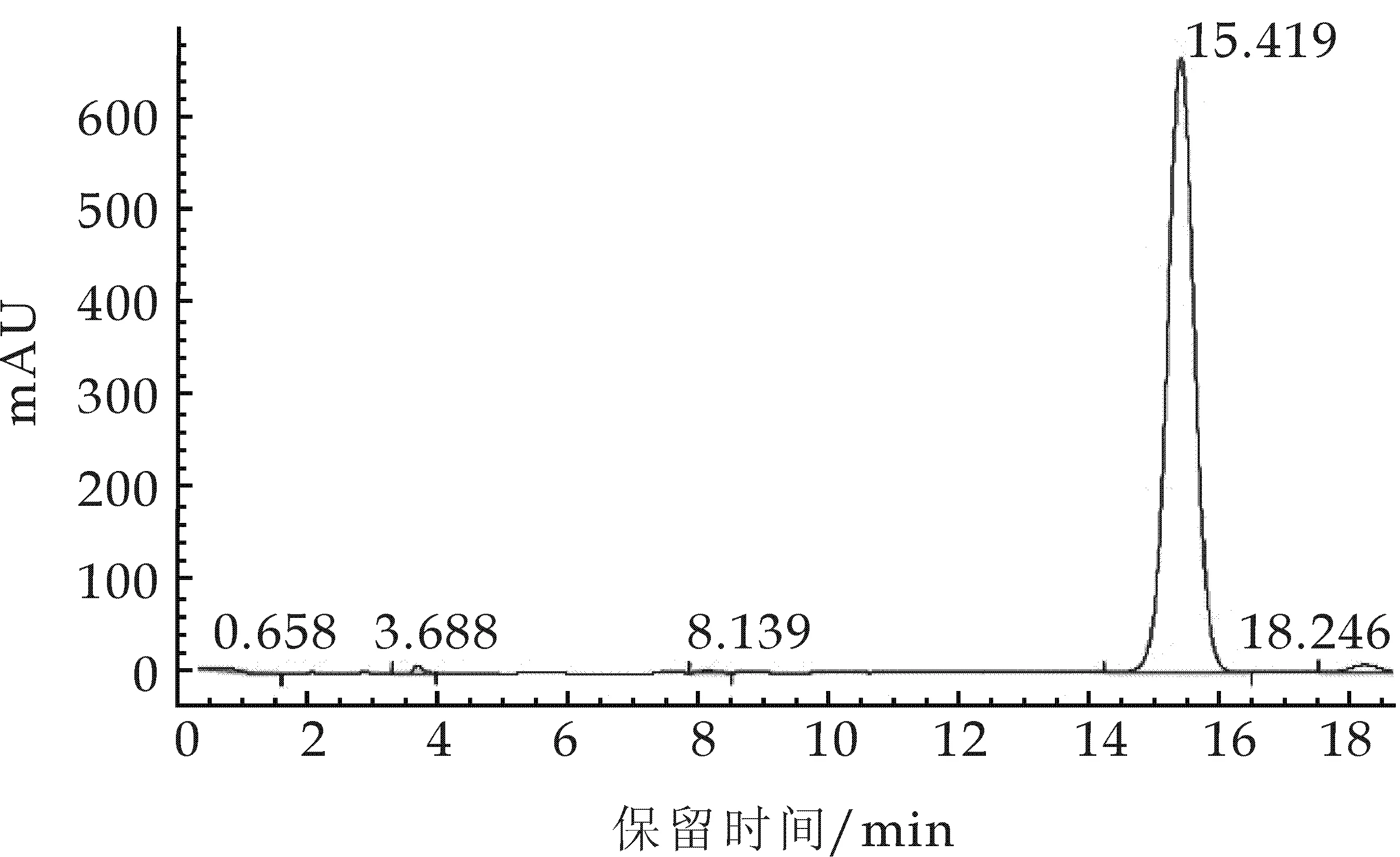
图1 流动相为甲醇:水的高效液相色谱图

图2 流动相为甲醇:磷酸水的高效液相色谱图
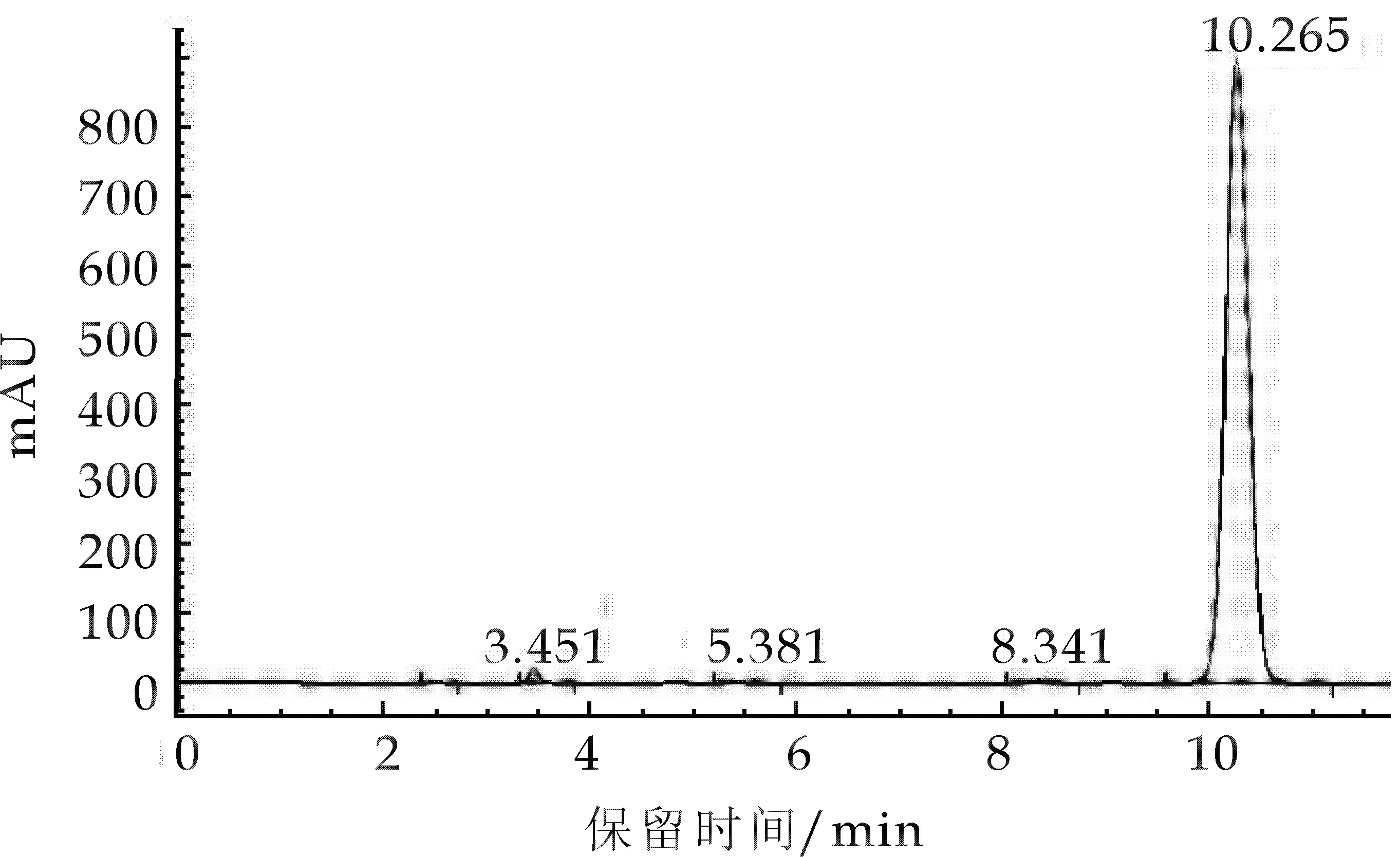
图3 流动相为乙腈:水的高效液相色谱图
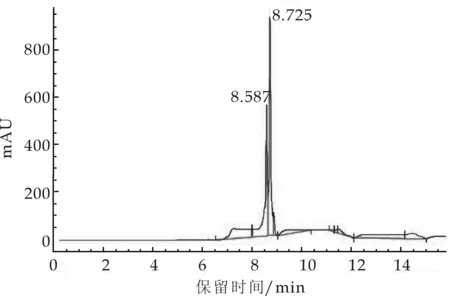
图4 流动相为乙腈:磷酸水的高效液相色谱图
2.1.2 流动相比例的选择
在25 ℃室温,1 mL/min流速,甲醇∶水为流动相,样品溶液进样量为20μL等条件下,依次改变流动相比例,分别为70∶30、75∶25、80∶20、85∶15、90∶10,得出保留时间为5.853、8.669、15.419、4.818、6.69,如表2所示.
当比例为80∶20时,分离度良好,而时间低于10 min时,因出峰时间太快影响组分的分离,分离度较差,所以选择80∶20为最佳流动相比例.

表2 流动相比例的影响
2.1.3 流速的选择
在室温25 ℃,甲醇∶水=80∶20等条件下,选择不同的流速0.6 mL/min、0.8 mL/min、1 mL/min,进样20μL时,记录保留时间,如表3所示.
从表3可得出结论:洛伐他汀组分的出峰时间随着流速的增大而增大.虽然出峰时间越长分离度越好,但是会影响测定的效率.所以,本实验选择流速1 mL/min.

表3 流速的影响
2.1.4 柱温的选择
不同的温度对洛伐他汀提取率影响较大,当温度低于25 ℃时,洛伐他汀提取率随着温度的增高逐渐增加;当大于25 ℃时,提取率趋于平稳.同时,温度过低影响组分的分离度,温度过高影响测定效率.所以,不同温度对洛伐他汀保留时间的影响如表4所示.
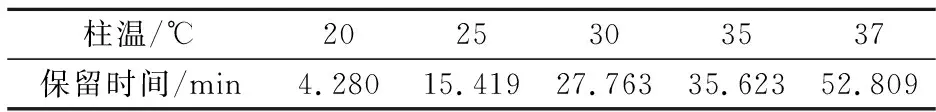
表4 柱温的影响
保持甲醇∶水=80∶20的流动相,流速1 mL/min,从表4可得出结论:随着温度的增加,洛伐他汀保留时间延长,当温度为20 ℃时,洛伐他汀出峰时间为4.280,因时间太短,影响组分分离;37 ℃时,洛伐他汀的保留时间为52.809,保留时间太长,影响测定效率.所以,选择室温25 ℃为最佳测定温度.
2.2 色谱条件结果
将洛伐他汀标品、金花菌乙酸乙酯提取液按章节1.3.4所述色谱条件进行实验,得出结果如图5和图6所示.
在HPLC过程中,采用简单经济的流动相甲醇和水效果良好,图5显示洛伐他汀的保留时间为4.073 min,图6中在相对应的位置4.309处也有峰出现.
所以,可以得出结论:金花菌乙酸乙酯提取液中有洛伐他汀物质的存在,含量可以通过外标法计算得知,得出洛伐他汀含量为0.049 mg/kg.同时,本实验所使用金花菌发酵品为固态发酵初级制品,含色素较高,而洛伐他汀的含量较低.
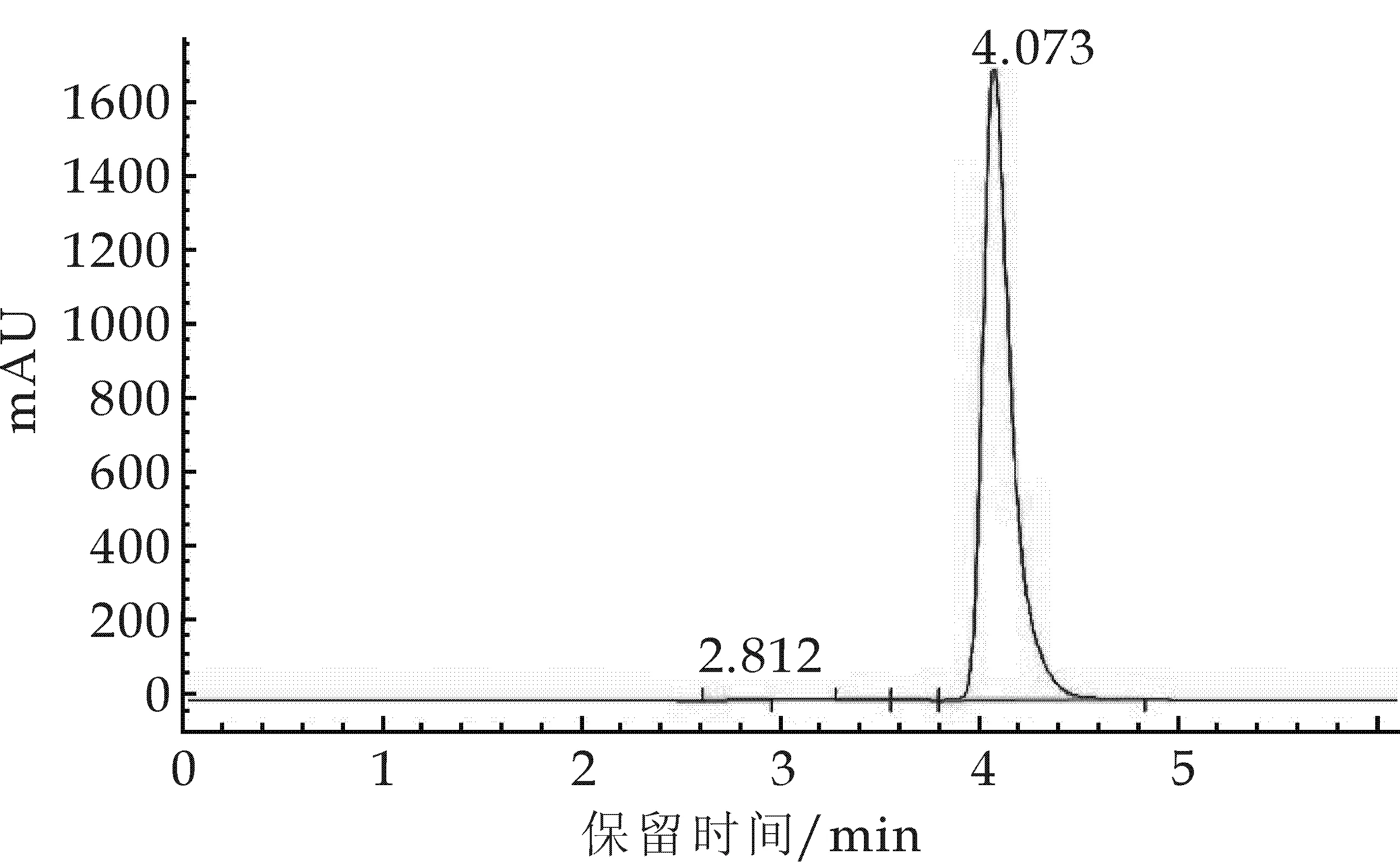
图5 洛伐他汀标准品高效液相色谱图

图6 金花菌固体培养物高效液相色谱图
2.3 方法学验证
2.3.1 线性相关性
分别量取章节1.3.2中配置的洛伐他汀标准溶液1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL置10 mL量瓶中,加甲醇稀释至刻度,摇匀,得到浓度分别为0.02 mg/mL、0.03 mg/mL、0.04 mg/mL、0.05 mg/mL、0.06 mg/mL的稀释溶液.
按章节1.3.4中所述高效液相色谱条件实验,分别吸取以上稀释溶液各 20μL,经 0.45μL 微孔滤膜过滤后,注入液相色谱仪,记录相应的峰面积响应值,以洛伐他汀浓度为横坐标,峰面积值为纵坐标,绘制洛伐他汀标准曲线,回归方程为Y=1 513.4x+5 615.9,r2=0.996 1.且洛伐他汀的标准液浓度在2.0~30μg/mL时,与峰面积线性关系良好.标准曲线如图7所示.
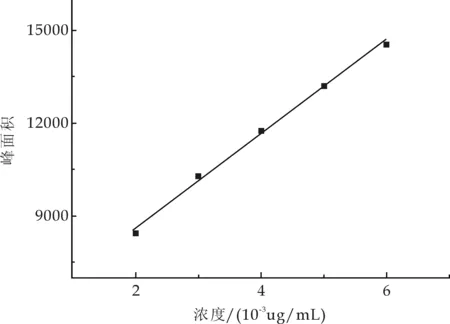
图7 洛伐他汀标准曲线
2.3.2 回收率
精密称取4份金花菌固体培养物5.0 g,分别加入不同倍数的洛伐他汀标准溶液,按章节1.3.3所述实验条件制备样品溶液,按章节1.3.4所述色谱条件进样,用加标样品的测定结果减去未加标样品的测定结果计算标准品的回收率,结果如表5所示.
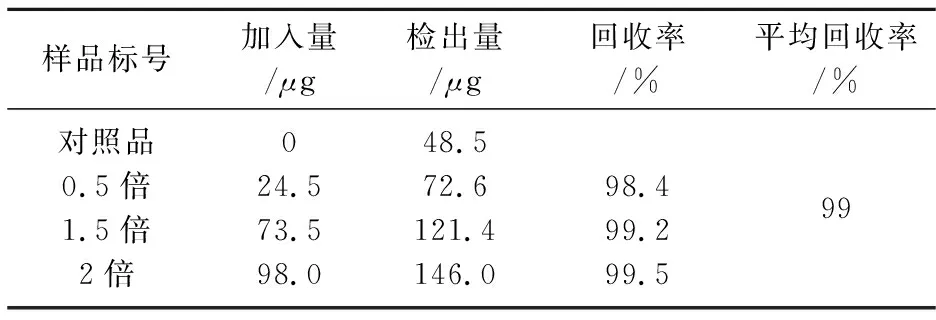
表5 回收率
表5显示,本实验方法符合微量分析的要求.
2.3.3 精密度
精密量取0.2 mg/mL的标准溶液平行进样6次,记录保留时间和相应的峰面积响应值,结果如表6所示.
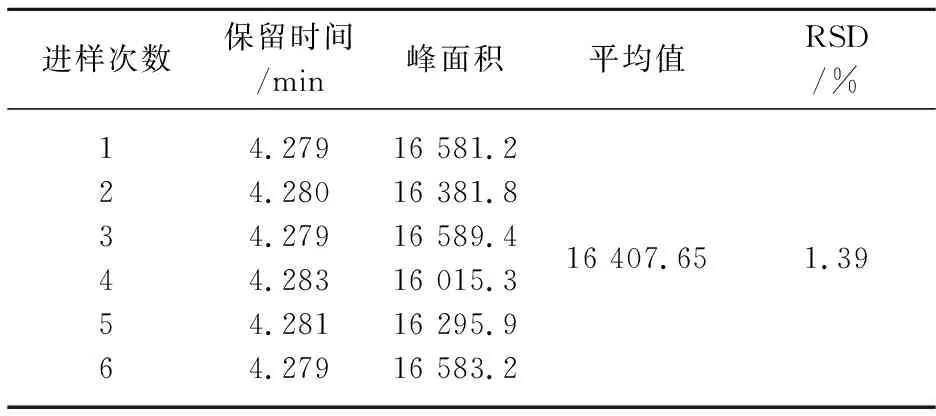
表6 精密度
标样的相对标准偏差为1.39%,该方法的精密度符合HPLC的定性要求.
2.3.4 重现性
精密称取5份金花菌固体培养物5.0 g,在相同的实验条件下对样品进行相同处理后按章节1.3.4所述的色谱条件进样,记录峰面积值,结果如表7所示.
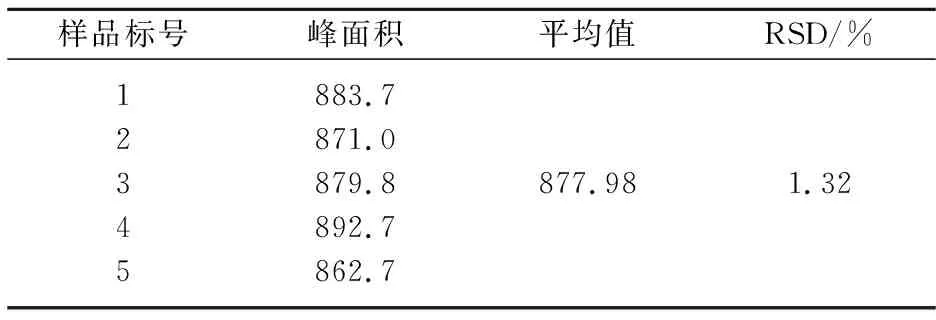
表7 重现性
上述结果显示该方法重现性符合要求.
3 结论
通过对陕西茯砖茶中金花菌的降脂类物质的方法学验证实验,确定该菌种含有具备降脂功能的洛伐他汀,同时还确定了高效液相色谱法检测金花菌固态发酵物中洛伐他汀的最佳色谱条件:即选用色谱柱C18柱,以甲醇∶水=80∶20为流动相,检测波长238 nm.
该方法具有良好的线性关系和分离度,重现性好,平均回收率为99%,RSD为1.39%.本文对金花菌固态发酵样品进行测定,最高洛伐他汀含量为0.049 mg/kg.
[1] 杨抚林,邓放明,赵玲艳,等.茯砖茶发花过程中优势菌的研究进展[J].茶叶科学技术,2005(1):4-7.
[2] 王融初,彭雄根.茯茶生产科技发展与西北民族情缘[J].茶叶通讯,2007,34(1):44-47.
[3] 王 蝶,黄建安,叶小燕,等.茯砖茶减肥作用研究[J].茶叶科学,2012,32(1): 81-86.
[4] 刘子音,许爱清,李宗军,等.茯砖茶中冠突散囊菌及其代谢产物研究进展[J].茶叶通讯,2010,37(1):23-26.
[5] 黄 浩, 刘仲华, 黄建安,等.“发花”散茶中“金花”菌的分离鉴定[J].茶叶科学,2010,30(5):350-354.
[6] 傅冬和, 余智勇, 黄建安,等.不同年份茯砖茶水提取物的抑菌效果研究[J].中国茶叶,2011,33(1):10-12.
[7] 黄怀生,郑红发,栗本文,等.茯砖茶中冠突散囊菌的代谢产物研究I冠突散囊菌的液体培养[J].茶叶通讯,2010,37(2):15-17.
[8] Endo A.Monacolin K.A new hypocholesterolemic agent produced by a monascus species[J].Antibiot,1979,32(8):852-854.
[9] 文 镜,顾晓玲,常 平,等.双波长紫外分光光度法测定红曲中洛伐他汀(Lovastatin)的含量[J].中国食品添加剂,2000(4):11-17.
[10] 文 镜,常 平,顾晓玲,等.红曲中内酯型Lovastatin的HPLC测定方法研究[J].食品科学,2000,21(12):100- 102.
[11] 袁 勇,黄建安,徐小江,等.茯茶中“金花”孢子粉提取物对体外诱导的非酒精性脂肪肝细胞内甘油三酯代谢的影响[J].茶叶科学,2011,31(2):129-135.
[12] 黄亚辉,陈建华,周 筠,等.不同年代茯砖茶感官品质和化学成分的差异性[J].食品科学,2010,31(2):228-232.
[13] 胡治远,赵运林,刘素纯,等.不同品种茯砖茶中优势微生物的分离鉴定[J].江西农业学报,2011,23(12):60-64.
[14] 孙 伟,刘爱英,梁宗琦,等.红曲中莫纳可林K(Monacolin K)的研究进展[J].西南农业学报,2003,16(3):112-116.
[15] 王伟平,王莉平,彭其安,等.红曲霉菌种选育及固态发酵法生产Monacolin K研究[J].中国酿造,2006(8):21-23.
[16] Hajjaj H,Niederberger P,Duboc P.Lovastatin biosynthesis by Aspergillus terreus in a chemically defined medium[J].Appl Environ Microb,2001,67(6):2 596-2 602.

