胸腔积液中微RNA-29a和腺苷脱氨酶联合检测对结核性胸膜炎的临床诊断效能
高景利,崔俊伟,石卓林,高 远,贾睿岐
(1.新乡医学院第一附属医院结核科,河南 卫辉 453100;2.新乡医学院第一附属医院全科医学,河南 卫辉 453100;3.新乡医学院第一附属医院呼吸重症监护室,河南 卫辉 453100)
结核病是由结核分枝杆菌导致的慢性免疫性、传染性疾病,中国结核病发病率约为58.83/10万[1]。结核性胸膜炎是临床上常见的结核杆菌感染性疾病,结核性胸膜炎所导致的胸腔积液与其他恶性胸腔积液在临床上难以区分[2-3],因此,积极寻找鉴别2种胸腔积液的相关检测指标至关重要。微RNA(microRNA,miRNA)属于非编码RNA,在机体血清、体液中稳定性较高,易于检测[4]。miR-29a属于较早发现的且与肿瘤相关的miRNA之一,在不同肿瘤中表达异常上调或下调[5-7],但关于miR-29a在结核性胸腔积液(tuberculous pleural effusion,TPE)和恶性胸腔积液(malignant pleural effusion,MPE)中表达水平的研究报道较少。腺苷脱氨酶(adenosine deaminase,ADA)在机体免疫反应的调控过程中作用显著,TPE中ADA表达水平显著升高,但ADA诊断TPE的敏感度仍较低,尚不足75%[8]。基于此,本研究探讨miR-29a联合ADA检测在鉴别TPE和MPE中的临床效能,为TPE临床早期诊断提供理论依据。
1 资料与方法
1.1 一般资料选择2018年1月至2019年6月新乡医学院第一附属医院结核科、呼吸科及肿瘤科收治的胸腔积液患者142例为研究对象,其中男80例,女62例;年龄49~61(54.26±10.23)岁。病例纳入标准:(1)TPE患者具有低热、盗汗、乏力等结核中毒症状,依据“WS288-2017肺结核诊断”中的标准[9]以及胸水病理细胞学、胸膜活检可见典型的上皮干酪样肉芽肿、抗结核治疗后胸水消失等确诊;(2)MPE患者X线或者胸部CT检查后发现肺部有肿块,胸水为渗出性,且抗酸染色阴性,胸水中可查到肿瘤细胞,肺部组织病理学确诊为肺癌;(3)首次发病;(4)年龄>18岁;(5)肝肾功能及心脏功能指标均正常;(6)同意进行胸腔穿刺胸水检查;(7)临床资料完整。排除标准:(1)胸水量较少,不足以进行穿刺并完善相关检查;(2)免疫缺陷者;(3)合并其他部位肿瘤。依据患者原发病最终确诊情况分为TPE组和MPE组。TPE组63例,其中男37例,女26例;年龄49~60(53.14±8.69)岁。MPE组79例,其中男43例,女36例;年龄49~61(55.38±11.14)岁。2组患者性别分布及年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,患者均签署知情同意书。
1.2 方法
1.2.1 酶速率法检测患者胸腔积液中ADA水平2组患者入院后进行胸腔穿刺,收集胸腔积液10 mL,无菌滤网去除胸腔积液中的凝块和絮状沉淀物,将标本转移至离心管中,12 000 r·min-1(离心半径 4 cm)离心10 min,使用加样枪吸取3 mL上清液后转移至新的离心管中,采用酶速率法检测ADA水平,试剂购自科华生物科技股份有限公司,严格按试剂盒说明步骤操作。
1.2.2 反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测胸腔积液中miR-29a相对表达量收集胸腔积液100 mL,按上述上清液采集方法采集胸腔积液上清液50 mL,应用RT-PCR检测miR-29a表达水平,RT-PCR试剂盒购买自北京天根生化科技有限公司,引物由上海生工生物技术有限公司合成,参考文献[10]设计引物,miR-29a上游引物序列为5′-CGCGTAGCACCATCTGAAAT-3′,下游引物序列为5′-AGTGCAGGGTCCGAGGTATT-3′;内参U6上游引物序列为5′-AGAGAAGATTAGCATGGCCCCTG-3′,下游引物序列为5′-ATCCAGTGCAGGGTCCGAGG-3′。反应体系10 μL:正向和反向引物(浓度为10 μmol·L-1)各0.4 μL,cDNA(质量浓度为50 mg·L-1)模板1.0 μL,双蒸水3.0 μL,SYBR GREENⅠ荧光染料5.2 μL。反应条件: 95 ℃预加热10 min, 94 ℃变性5 s,55 ℃ 退火30 s, 70 ℃延伸30 s,共循环40次。以U6为内参,应用2-△△Ct法计算miR-29a相对表达水平。
1.2.3 TPE患者治疗及预后不良情况分析对TPE患者给予标准化抗结核治疗方案,同时抽取胸腔积液,每周1次,每次不超过1 000 mL,当低于1 000 mL时可一次性抽完,直至患者住院期间不再产生新的胸腔积液。治疗结束后采用彩色超声检测胸腔内胸膜最厚处,当胸膜厚度超过3 mm时,定义为胸膜增厚,将出现胸膜增厚定义为预后不良。根据治疗后预后将TPE患者分为预后不良组(n=14)和预后良好组(n=49例),比较2组患者治疗前胸腔积液中miR-29a 相对表达量及ADA水平。

2 结果
2.1 2组患者胸腔积液中miR-29a相对表达量和ADA表达水平比较结果见表1。TPE组患者胸腔积液中miR-29a相对表达量和ADA表达水平高于MPE组,差异有统计学意义(P<0.05)。
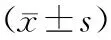
表1 2组患者胸腔积液中miR-29a相对表达量和ADA表达水平比较
2.2 2组患者胸腔积液中miR-29a相对表达量与ADA水平相关性结果见图1和图2。TPE组患者胸腔积液中miR-29a相对表达量与ADA水平呈显著正相关性(r=0.314,P>0.05)。MPE组患者胸腔积液中miR-29a相对表达量与ADA表达水平无相关性(r=0.234,P>0.05)。
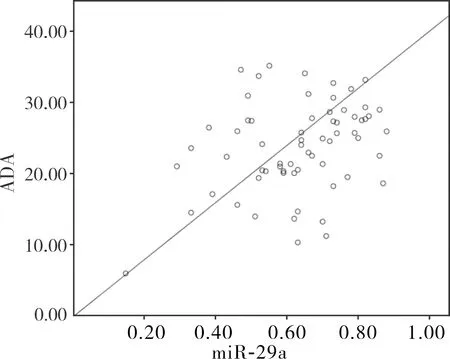
图1 TPE患者胸腔积液中miR-29a相对表达量与ADA水平相关性
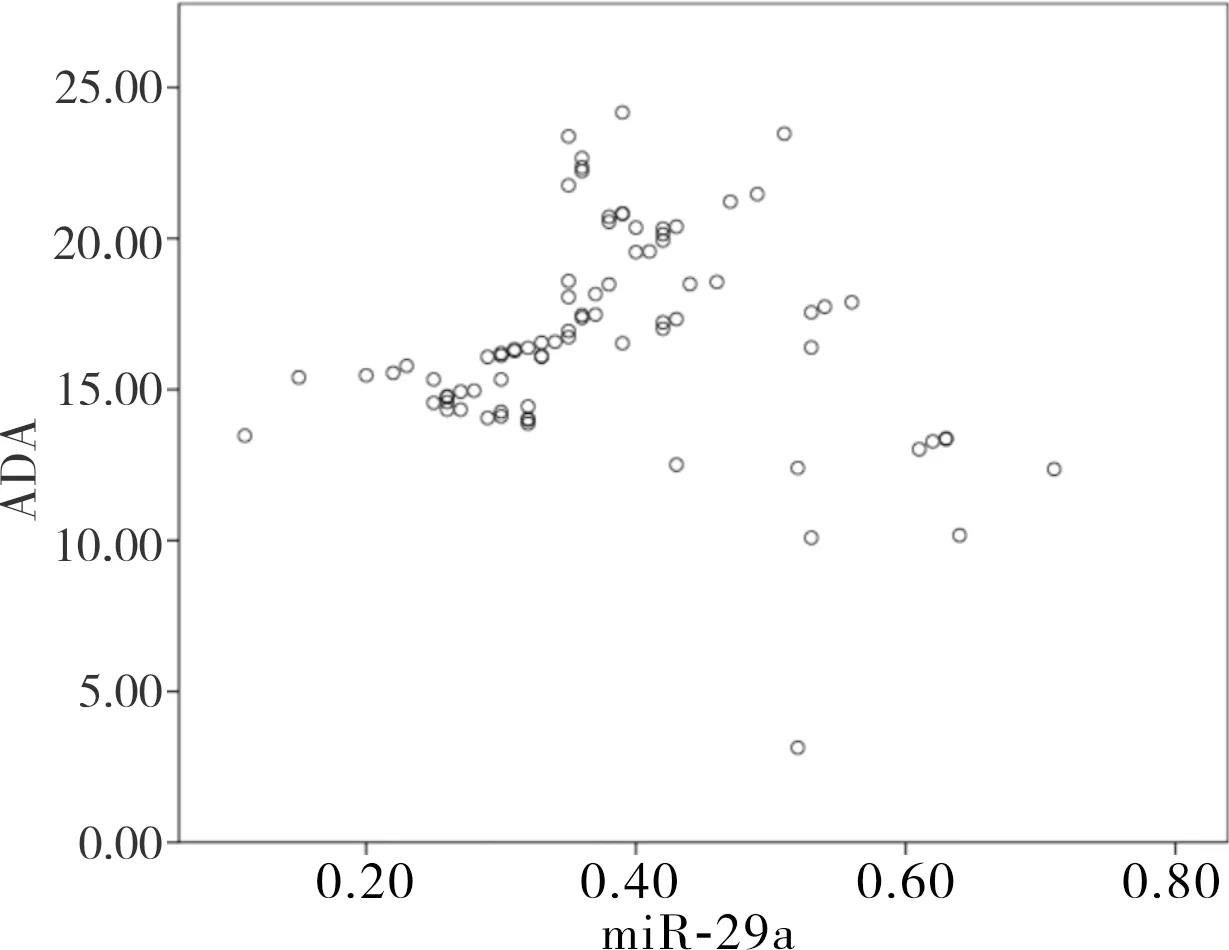
图2 MPE组患者胸腔积液中miR-29a相对表达量与ADA水平相关性分析
2.4 miR-29a和ADA单独及联合诊断TPE的临床效能结果见图3和表2。ROC曲线显示,miR-29a诊断TPE的曲线下面积(area under the curve,AUC)为 0.903,95%置信区间(95% confidence interval,95%CI)为0.853~0.954,当截断值为0.46时,敏感度和特异度分别为90.50%和79.70%;ADA诊断TPE的AUC为0.840(95%CI:0.767~0.913),当截断值为 18.63 U·L-1时,敏感度和特异度分别为 84.10%和74.70%;miR-29a联合ADA诊断TPE的AUC为 0.943,敏感度和特异度分别为94.90%和92.40%。
图3 胸腔积液中miR-29a、ADA水平单独及联合诊断TPE的ROC曲线

表2 胸腔积液中miR-29a、ADA单项及联合诊断TPE的效能
2.5 TPE患者治疗前胸腔积液中miR-29a和ADA表达水平与预后的关系预后不良组和预后良好组TPE患者治疗前胸腔积液中miR-29a相对表达量分别为0.67±0.13、0.51±0.12,ADA水平分别为(23.98±5.26)、(24.13±6.21)U·L-1;预后不良组患者治疗前胸腔积液中miR-29a相对表达量显著高于预后良好组,差异有统计学意义(t=4.321,P<0.05);2组患者胸腔积液中ADA水平比较差异无统计学意义(t=0.082,P>0.05)。ROC曲线显示,miR-29a诊断TPE患者治疗后出现胸膜增厚的AUC为0.832(95%CI:0.727~0.939),当截断值为0.615时,敏感度和特异度分别为 73.50%和78.60%;ADA诊断TPE患者治疗后出现胸膜增厚的AUC为 0.614(95%CI:0.432~0.795),当截断值为 22.59 U·L-1时,敏感度和特异度分别为46.28%和52.56%,见图4。
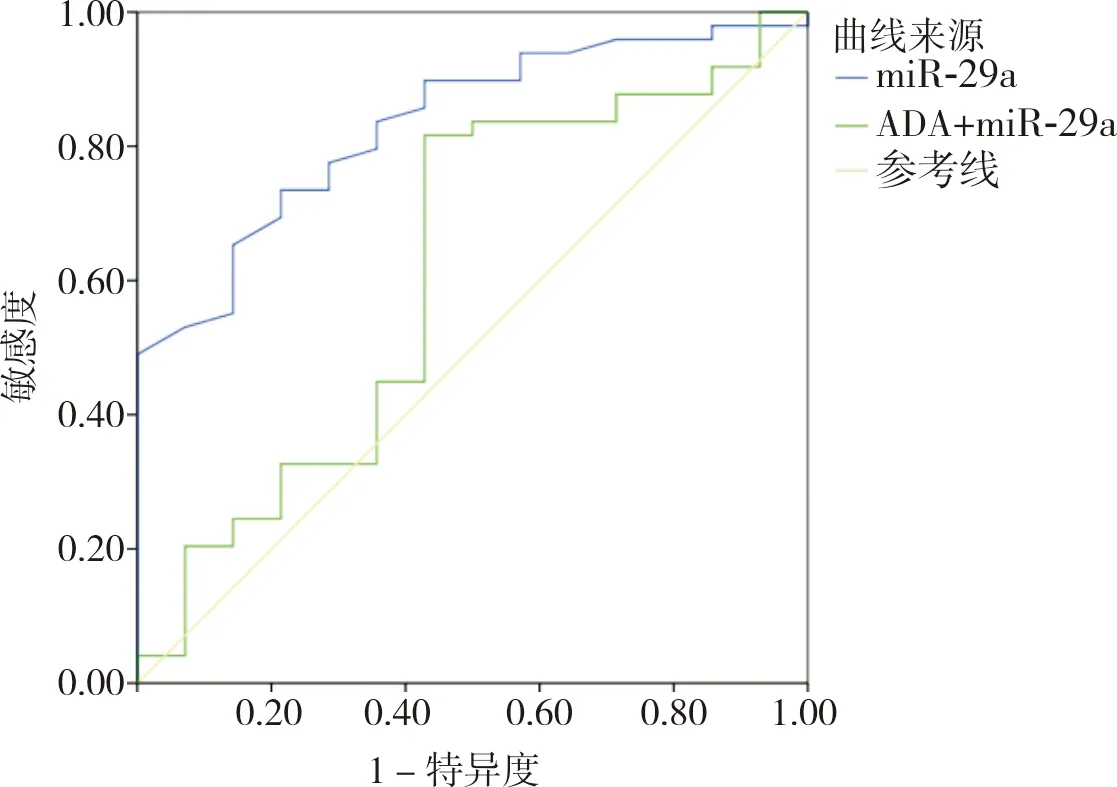
图4 TPE患者治疗前胸腔积液中miR-29a相对表达量和ADA水平诊断治疗后发生胸膜增厚的ROC曲线
3 讨论
结核性胸膜炎是常见的肺外结核之一,主要是结核分枝杆菌感染胸膜后导致的慢性炎症反应所致,在疾病的不同发展阶段,以渗出性结核性胸膜炎即胸腔积液最为常见;恶性肿瘤如肺癌所导致的MPE在临床上也较为常见,二者在临床表现和影像学检查上无明显差异,对于肿瘤原发灶不明确的MPE和肺内结核不典型的TPE鉴别较为困难[11]。尽管胸腔积液病原学检查如胸水凃片寻找抗酸杆菌及肿瘤细胞、胸水中结核分枝杆菌培养对于二者的鉴别具有一定价值,但也存在阳性率较低和耗时过长等缺陷[12-13]。因此,积极寻找一种敏感度和特异度均较高、操作性强、可用于快速诊断结核性胸膜炎的新方法尤为重要。
miRNA不仅存在于细胞中,还存在于机体各种血液及体液中,不同种类的miRNA均可在TPE[14]和MPE[15-16]中呈高表达或低表达。MiR-29家族主要包括miR-29a、miR-29b和miR-29c,miR-29a在肺癌和肺结核的发病机制中均起重要作用。MiR-29a能通过多种信号通路抑制肺癌细胞的增殖与迁移,发挥显著的抑癌作用[5,17];有研究报道,结核分枝杆菌感染人巨噬细胞后可上调miR-29a的表达水平[18],活动性肺结核患者外周血白细胞中miR-29a相对表达水平显著升高,且与干扰素-α(interferon-α,IFN-α)存在显著负相关性,miR-29a能通过靶向结合IFN-α mRNA从而负向调节机体对结核分枝杆菌的免疫应答[19]。刘永明等[20]研究结果显示,外周血白细胞中miR-29a相对表达水平在健康对照组、肺结核组和肺癌组中依次显著升高。焦昕等[10]研究证实,与MPE患者相比,TPE患者胸腔积液中miR-29a表达水平显著升高,且经过抗结核治疗后胸腔积液中miR-29a表达水平显著降低。本研究结果显示,TPE组患者胸腔积液中miR-29a相对表达量显著高于MPE组,与焦昕等[10]研究结果基本一致,提示miR-29a可能参与了结核分枝杆菌感染胸膜的病理生理过程。ADA广泛存在于胸腺、淋巴细胞和淋巴组织中,TPE和MPE患者胸腔积液中ADA水平均显著升高,且胸腔积液中ADA水平鉴别TPE和MPE的临床效能显著[8,21]。本研究结果显示,TPE患者中miR-29a与ADA呈现显著正相关性,而MPE患者胸腔积液中miR-29a相对表达量与ADA表达水平无相关性,推测miR-29a在一定程度上也可作为鉴别TPE和MPE的标志物之一。ROC曲线分析结果显示,miR-29a诊断TPE的AUC为 0.903(95%CI:0.853~0.954),敏感度和特异度分别为90.50%和79.70%,miR-29a联合ADA诊断TPE的AUC高达0.943,敏感度和特异度分别为94.90%和92.40%,说明miR-29a联合ADA诊断TPE的效能显著增高。TPE患者经过抗结核治疗后,部分患者可出现胸膜增厚现象,本研究中14例患者出现胸膜增厚,该14例患者治疗前胸腔积液中miR-29a相对表达量显著高于治疗后无胸膜增厚患者,但ADA水平在胸膜增厚和无胸膜增厚患者间无明显差异,提示TPE患者治疗前胸腔积液中miR-29a高表达与预后不良相关。ROC曲线分析结果显示,治疗前胸腔积液中miR-29a表达水平诊断TPE患者治疗后出现胸膜增厚的AUC为0.832(95%CI:0.727~0.939),当截断值为0.615时,敏感度和特异度分别为 73.50%和78.60%,证实治疗前胸腔积液中miR-29a高表达可作为TPE患者预后不良的一项标志物。
综上所述,miR-29a在TPE患者胸腔积液中高表达,有望成为鉴别TPE和MPE的一项新指标,联合检测ADA能进一步提高诊断效能;胸腔积液中miR-29a可作为TPE患者预后不良预测的一项标志物。

