盐酸安罗替尼联合信迪利单抗治疗标准治疗失败后微卫星稳定型结直肠癌疗效观察
姬颖华,杨晓煜,孟祥丽,谢晋玲,王 瑾,张 敏,杨留中,路 平,张景航
(1.新乡医学院第一附属医院肿瘤科,河南 卫辉 453100;2.新乡医学院基础医学院病理学教研室,河南 新乡 453003;3.新乡医学院第一附属医院病理科,河南 卫辉 453100)
使微卫星高度不稳定性(microsatellite height instability,MSI-H)或错配修复基因缺失(mismatch repair gene deletion,dMMR)型肿瘤免疫原性增强在肿瘤免疫治疗中可获得较好的临床治疗效果。研究报道,约95%以上的肝癌或结直肠癌为微卫星稳定型(microsatellite stable,MSS),其中5%为dMMR,免疫治疗效果较差[1],因此,有效改善此类患者免疫原性是目前临床研究重点。研究显示,瑞戈非尼联合纳武利尤单抗治疗MSS型肠癌患者疗效显著,可获得33%的(objective response rate,ORR)[2],这为打破MSS型肠癌患者的免疫治疗难题提供了新思路,但仍有免疫治疗与抗血管联合治疗效果不佳者,需要更多的临床试验进一步深入研究。安罗替尼是一种新型的口服抗肿瘤血管生成类多靶点受体酪氨酸激酶抑制剂,对多种肿瘤均有良好的治疗效果;信迪利单抗注射液在多种肿瘤的Ⅰ、Ⅱ期临床研究中也有良好的疗效。有报道指出,安罗替尼联合信迪利单抗注射液治疗晚期非小细胞肺癌患者的疾病控制率可达100%[3]。基于此,本研究探讨盐酸安罗替尼联合信迪利单抗治疗标准治疗失败后MSS型结直肠癌患者的临床疗效及安全性,旨在寻找MSS型结直肠癌患者新的免疫治疗方案,以改善MSS型结直肠癌患者预后,为临床治疗提供参考。
1 资料与方法
1.1 一般资料选择2019年5月至2020年2月新乡医学院第一附属医院肿瘤科收治的MSS型结直肠癌患者为研究对象。病例纳入标准:(1)符合MSS型结直肠癌诊断标准[4],并经CT检查确诊;(2)经标准治疗失败后至少具有1个可测量病灶;(3)所有研究对象临床资料、实验室资料完整;(4)患者知情同意并签署知情同意书。病例排除标准:(1)存在有活动性感染、免疫缺陷性疾病;(2)既往使用过安罗替尼或信迪利单抗治疗;(3)有其他影响本研究病史及合并症;(4)哺乳期妊娠期妇女;(5)4周内参加过其他抗肿瘤药物临床试验;(6)相关研究药物过敏者。共纳入MSS型结直肠癌患者36例,根据治疗方式将患者分为对照组与观察组。对照组17例,其中男9例,8例;年龄18~75(40.63±10.32)岁;病理类型:溃疡型11例,隆起型4例,浸润性2例;病理分期:Ⅰ~Ⅱ期12例,Ⅱ~Ⅳ期5例。观察组19例,其中男10例,9例;年龄20~75(41.55±10.20)岁;病理类型:溃疡型14例,隆起型3例,浸润性2例;病理分期:Ⅰ~Ⅱ期15例,Ⅱ~Ⅳ期4例。2组患者年龄、性别分布、病理类型及病理分期比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院医学伦理委员会审核批准。
1.2 治疗方法2组患者均进行姑息化学治疗,在此基础上对照组患者给予盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180002),口服,每日1 次,每次10 mg,连续给药2周后停用1周,第2次调整剂量为12 mg,连续给药2周后停用1周,共治疗6个月。观察组患者在对照组治疗基础上使用信迪利单抗注射液[信达生物制药(苏州)有限公司,国药准字S20180016]静脉输注治疗,每次 200 mg,每3周给药1次。每3个周期进行1次疗效评价,治疗3个周期。疾病控制且不良反应可耐受患者持续用药,直至患者不适合继续用药或疗效评价为疾病进展(disease progression,PD)时用药结束;未出现PD前,不进行其他抗肿瘤治疗。
1.3 观察指标(1)临床治疗效果: 治疗3个月后,使用实体瘤疗效评定标准1.1(response evaluation criteria in solid tumors,RECIST1.1)评估疗效[5]。完全缓解(complete remission,CR):所有靶病灶消失;部分缓解(partial remission,PR):靶病灶最大直径总和减少30%;疾病稳定(disease stability,SD):病灶缩小未达PR或增加未达 PD;PD:靶病灶最大直径总和增加 20%或出现新病灶;计算ORR和疾病控制率(disease control rate,DCR),ORR =(CR例数+PR例数)/总例数×100%, DCR=(CR例数+PR例数+SD例数)/总例数×100%。(2)生活质量:对患者进行6个月随访,采用肿瘤病人生活质量评分(quality of life score of cancer patients,EOETC QOL-30)评估患者生活质量,量表总共30个项目,包含躯体功能、角色功能、认知功能、情绪功能、社会功能5个功能子量表,疲乏、疼痛、恶心呕吐3个症状子量表,以及总体生命质量子量表和呼吸困难、失眠、食欲丧失、便秘、腹泻、经济因素6个单项。功能子量表和总体生命质量子量表得分数越高代表生活质量越高,症状以及单项目得分越高代表生活质量越低。(3)不良反应:在治疗6个月后,使用常见不良反应事件评价标准(common terminology criteria for adverse events,CTCAE)4.0版标准[5]评估药物不良反应,根据患者不良反应严重程度分为1~5级,级别越高,代表不良反应越严重;比较2组患者不良反应发生率,不良反应发生率=不良反应例数/总例数×100%。
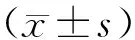
2 结果
2.1 2组患者治疗后临床效果比较结果见表1。对照组患者的ORR、DCR分别为5.88%、35.29%;观察组患者的ORR、DCR分别为15.79%、52.63%;对照组与观察组患者ORR及DCR比较差异无统计学意义(P>0.05)。
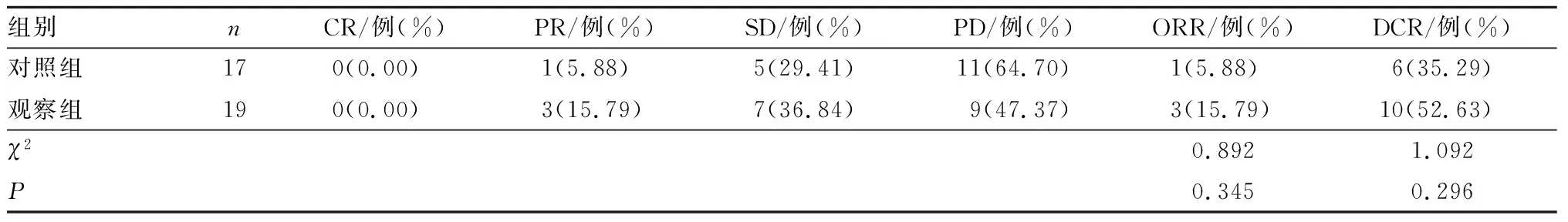
表1 2组患者治疗后临床治疗效果比较
2.2 2组患者治疗前后生活质量比较
2.2.1 2组患者治疗前后症状子量表评分比较结果见表2。治疗前,2组患者症状子量表评分情况比较差异无统计学意义(P>0.05)。治疗6个月后,2组患者疲乏评分高于治疗前,疼痛评分低于治疗前,差异有统计学意义(P<0.05);2组患者恶心呕吐评分与治疗前比较差异无统计学意义(P>0.05)。治疗6个月后,观察组患者疼痛评分低于对照组,差异有统计学意义(P<0.05);2组患者治疗6个月后疲乏评分及恶心呕吐评分比较差异均无统计学意义(P>0.05)。
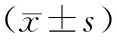
表2 2组患者治疗前后症状子量表评分比较
2.2.2 2组患者治疗前后5个功能子量表、总体生命质量评分比较结果见表3。治疗前,2组患者5个功能子量表及总体生命质量评分比较差异均无统计学意义(P>0.05)。2组患者治疗6个月后躯体功能、情绪功能、总体生命质量评分高于治疗前,差异有统计学意义(P<0.05);治疗6个月后,观察组患者躯体功能、情绪功能、总体生命质量评分高于对照组,差异有统计学意义(P<0.05);治疗6个月后,2组患者角色功能、认知功能、社会功能评分比较差异无统计学意义(P>0.05)。
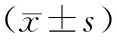
表3 2组患者治疗前后5个功能子量表、总体生命质量评分情况比较
2.2.3 2组患者治疗前后单项评分比较结果见表4。治疗前,对照组与观察组患者各单项评分比较差异均无统计学意义(P>0.05)。治疗6个月后,2组患者呼吸困难评分、失眠评分低于治疗前,食欲丧失评分高于治疗前,差异有统计学意义(P<0.05);2组患者便秘、腹泻、经济影响评分与治疗前比较差异均无统计学意义(P>0.05)。治疗6个月后,观察组患者呼吸困难评分、失眠评分及食欲丧失评分低于对照组,差异有统计学意义(P<0.05);观察组患者便秘评分、腹泻评分、经济因素评分与对照组比较差异无统计学意义(P>0.05)。
表4 2组患者治疗前后6个单项评分比较
2.3 2组患者治疗后不良反应情况比较对照组患者出现乏力5例(其中4例为3级,1例为1级),高血压2例(3级),手足综合征1例(2级),黏膜炎1例(2级),厌食1例(2级),白细胞减少1例(3级),不良反应发生率为64.17%(11/17);观察组患者出现乏力3例(其中2例为3级,1例为1级),高血压6例(3级),手足综合征1例(1级),厌食1例(3级),白细胞减少1例(1级),蛋白尿1例(2级),不良反应发生率为68.42%(13/19);对照组与观察组患者不良反应发生率比较差异无统计学意义(χ2=0.056,P>0.05)。
3 讨论
在生理状态下,促血管生成分子[如血管内皮生长因子(vascular endothelial growth factor,VEGF)]、抗血管生成分子的动态稳定调节血管生成[6]。在肿瘤内环境中,当促血管生长因子表达超过抗血管生长因子时,肿瘤内新血管生成并为肿瘤细胞提供高代谢所需的氧和营养,促进肿瘤生长;同时新生血管也是肿瘤向远处转移的基础。许多分子通路直接或间接参与肿瘤血管生成过程,通过阻断分子通路来抑制肿瘤的血管生成,可达到抗肿瘤的目的,这是肿瘤的治疗一个新的方向[7-8]。
VEGF是重要的肿瘤血管生成通路的促血管生成分子[9],VEGF与血管内生长因子受体2(vascular growth factor receptor 2,VEGFR-2)结合激活血管内皮的下游效应,从而促进细胞的增殖、迁移和通透性,在血管发生和血管生成中起重要作用[10]。抗血管生成药物可通过靶向作用于VEGF等信号因子,抑制其过度表达,从而减少肿瘤内新生血管,发挥抗肿瘤效应[11]。盐酸安罗替尼是我国自主研发的新型小分子多靶点酪氨酸激酶抑制剂,不仅对VEGFR-2、VEGFR-3活性有着较强的抑制作用,而且还可抑制血小板衍生生长因子受体(platelet derived growth factor receptor,PDGFR)和成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR),从而抑制新生血管的生长[12]。HUSSAR等[13]研究表明,使用安罗替尼治疗软组织肉瘤患者,可延长患者无进展生存时间,使疾病的进展风险降低至约60%。有研究认为,在临床中盐酸安罗替尼可作为晚期非小细胞肺癌患者的三线治疗药物[14]。
免疫细胞表面可表达抗程序性死亡受体-1(programmed cell death 1,PD-1)蛋白,肿瘤细胞可表达免疫球蛋白样分子细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1),PD-1 蛋白与PD-L1结合可降低免疫细胞的活性,造成癌症细胞逃脱免疫细胞的追捕[14]。因此,在临床治疗中可通过调节患者免疫系统杀伤肿瘤细胞来达到治疗的目的。将患者T细胞、自然杀伤细胞等杀伤性淋巴细胞活化后靶向肿瘤细胞对肿瘤的治疗效果显著,为目前肿瘤治疗的新手段[15]。信迪利单抗药物为重组全人源免疫球蛋白G4型PD-1单克隆抗体,可通过结合PD-1来阻断PD-1与PD-L1和PD-L2的结合,解除免疫抑制效应,激活T细胞功能,增强T细胞对肿瘤的免疫监视能力和杀伤能力,产生肿瘤免疫应答[16]。研究表明,信迪利单抗药物可应用于多种肿瘤的治疗,且亲和力高、靶点占位率高[17]。有研究报道,以贝伐珠单抗联合化学治疗为代表的免疫治疗可有效延长野生型肿瘤患者的无进展生存时间,提高ORR、DOR,使死亡风险降低约22%,且无其他不良反应出现[18]。因此,推测盐酸安罗替尼联合信迪利单抗治疗可通过抗血管生成作用来降低髓源性抑制细胞和调节性T细胞的活性,重塑肿瘤微环境,使免疫抑制改变为免疫许可模式,阻断VEGF介导的对树突细胞成熟的抑制,从而更有效地启动和活化(抗原识别)结合肿瘤抗原的T细胞,使肿瘤血管结构正常化,促进T细胞浸润进入肿瘤(细胞招募)[19]。但目前关于盐酸安罗替尼联合信迪利单抗治疗MSS型结直肠癌患者的效果研究报道较少。因此,本研究观察盐酸安罗替尼联合信迪利单抗治疗标准治疗失败后MSS型结直肠癌患者的临床疗效及安全性。
本研究结果显示,观察组患者ORR、DCR高于对照组,但2组间比较差异无统计学意义,分析可能与本研究时间较短而近期疗效无明显差异有关。2组患者治疗前躯体功能、情绪功能、角色功能、认知功能、社会功能5个功能子量表及总体生命质量评分比较差异均无统计学意义,治疗6个月后观察组患者躯体功能、情绪功能、总体生命质量评分高于对照组,2组患者角色功能、认知功能、社会功能评分比较无明显差异,提示盐酸安罗替尼联合信迪利单抗治疗可在一定程度上改善MSS型结肠癌患者临床症状,显著提高总体生命质量。在临床症状方面,本研究结果显示,2组患者治疗前症状子量表评分比较差异无统计学意义,2组患者治疗后疲乏评分高于治疗前,疼痛评分低于治疗前,恶心呕吐评分与治疗前无明显差异;治疗后,观察组患者疼痛评分低于对照组;提示盐酸安罗替尼联合信迪利单抗治疗可显著改善患者疼痛情况,而对于疲乏和恶心呕吐的改善与单独应用盐酸安罗替尼相比并不显著。2组患者治疗后呼吸困难评分、失眠评分低于治疗前,食欲丧失评分高于治疗前;治疗6个月后,观察组患者的呼吸困难评分、失眠评分及食欲丧失评分显著低于对照组;这可能是由于药物不良反应所导致,提示在治疗过程中需考虑药物控制不良反应,做好监测和应对措施。此外,本研究结果显示,2组患者治疗后均未出现影响治疗进程的严重不良反应,2组患者不良反应总发生率比较差异无统计学意义,与以往文献研究相符[20],说明由于药物联合加之患者抵抗力较差,可导致一些药物不良反应,但在经过相关干预治疗以及药物调整后患者不良反应可得到缓解,提示二者联合治疗安全性较好。
综上所述,盐酸安罗替尼联合信迪利单抗治疗标准治疗失败后MSS型结直肠癌患者,可有效改善患者生命质量,缓解临床症状,且不良反应可控。

