信迪利单抗药物利用评价标准的建立与应用
李 阳,邱 季,葛 磊,胡如波
免疫治疗在2013 年被《Science》杂志评为年度十大科学突破之首,是继手术、放疗、化疗之后第4大抗肿瘤治疗手段,而免疫检查点抑制剂(ICIs)作为第4 代肿瘤免疫治疗方法,开启了肿瘤治疗的新时代,包括CTLA-4、PD-1 以及其配体PD-L1 的抑制剂[1-2]。近年来,国内外相继有多个品种的程序性细胞死亡受体-1(programmed cell death receptor-1,PD-1)抑制剂上市,给肿瘤患者带来曙光的同时,不合理使用也随之越来越多。国家卫健委于2018 年、2019 年、2020、2021 年连续发布 《新型抗肿瘤药物临床应用指导原则》, 指导新型抗肿瘤药物合理使用;同时,组织制定《抗肿瘤药物临床应用管理办法(试行)》(国卫医函〔2020〕487 号),进一步规范和管理抗肿瘤药物使用。
信迪利单抗是1 种靶向PD-1 的全人源化免疫球蛋白G4(IgG4)单克隆抗体,于2018 年12 月上市,截止2021 年9 月,有4 项适应证经国家药品监督管理局批准应用,疗程为3 周给药1 次,每次200 mg(2 支),持续治疗直至疾病进展或出现不可耐受不良反应。由于信迪利单抗上市时间短、临床应用经验较少、适应证较局限。本研究以药物利用评价(drug use evaluation,DUE)为工具,结合患者和临床应用等实际情况,初步建立信迪利单抗DUE 标准,评价信迪利单抗应用的合理性,再进一步完善信迪利单抗DUE 标准,促进临床合理应用信迪利单抗。
1 对象与方法
1.1 对象 选取2020 年7 月~2021 年6 月合肥市第一人民医院滨湖院区应用信迪利单抗注射液治疗的全部出院患者。纳入标准:应用信迪利单抗注射液治疗次数≥2 次,有较详细的用药记录:用药医嘱、用法用量、给药时间等,相关检查记录,较完整的病程记录评价疗效。
1.2 信迪利单抗 信迪利单抗注射液, 商品名:达伯舒,规格:10 ml:100 mg,生产企业:信达生物制药(苏州)有限公司,批准文号:S20180016,在国家医保(2020 版)目录中。
1.2.1 建立信迪利单抗DUE 标准 参考信迪利单抗药品说明书 (最新修改日期:2021 年06 月25日)、《CSCO 免疫检查点抑制剂临床应用指南2021》、《新型抗肿瘤药物临床应用指导原则(2021)》、相关肿瘤诊疗规范、专业书籍以及国内外有关信迪利单抗的相关文献,根据美国医院药剂师协 会 (American society of hospital pharmacists,ASHP)对DUE 标准的基本要求,结合实际情况,初步建立信迪利单抗DUE 标准,并通过本院抗肿瘤药物管理工作组专家讨论和修订,确定最终的信迪利单抗DUE 标准。信迪利单抗DUE 标准根据用药指证、用药过程、用药结果的3 个指标,分为13 个子标准。具体内容见表1。
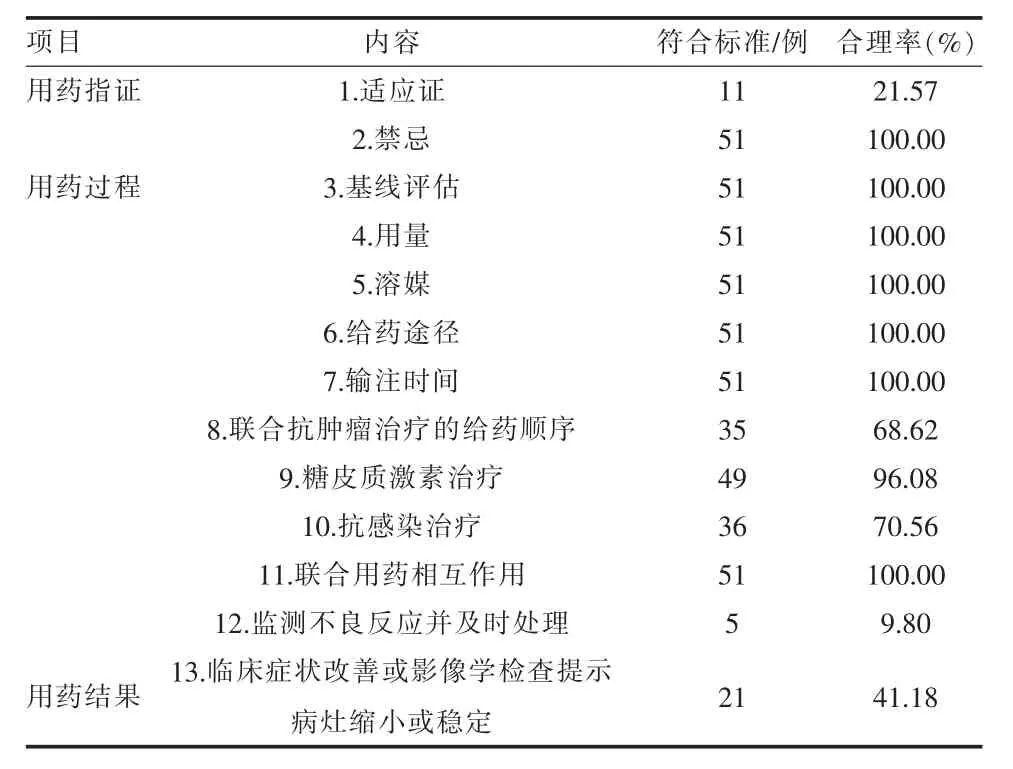
表1 信迪利单抗评价标准
1.2.2 设计《信迪利单抗注射液点评表》 根据表1内容,设计《信迪利单抗注射液点评表》,内容包括患者姓名、住院号、科室、年龄、性别、出院诊断、住院时间以及信迪利单抗DUE 标准涉及的全部条款。
1.2.3 信迪利单抗DUE 标准的应用 采用回顾性调查方法,参照信迪利单抗DUE 标准,填写《信迪利单抗注射液点评表》, 对病例资料的相关数据进行收集、分析和合理性评价。
评价用药指证,包括适应证:(1)适用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗;(2)联合培美曲塞和铂类化疗,用于未经系统治疗的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的晚期或复发性非鳞状细胞非小细胞肺癌治疗;(3) 联合吉西他滨和铂类化疗,用于不可手术切除的晚期或复发性鳞状细胞非小细胞肺癌的一线治疗;(4) 联合贝伐珠单抗用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗。禁忌:(1)对信迪利单抗注射液的活性成份或辅料过敏者;(2)18 岁以下儿童及青少年。
评价用药过程, 包括基线评估, 用量:200 mg q3w,溶媒:100 ml 0.9%氯化钠注射液,给药途径:静脉输注,输注时间:30 ~60 min,联合抗肿瘤治疗的给药顺序:先信迪利单抗治疗,糖皮质激素:治疗前等效日剂量<10 mg 泼尼松片,抗感染药物:治疗前未感染,联合用药相互作用,监测不良反应并及时处理。评价用药结果,临床症状改善或影像学检查提示病灶缩小或稳定。
2 结果
2.1 基本情况 符合标准的出院患者51 例, 共接受治疗205 次,平均每位患者用药次数4.02。男性38 例,女性13 例,年龄34 ~84 岁。应用信迪利单抗治疗的科室有2 个:肿瘤内科、介入科。其中,肿瘤内科49 例,介入科2 例。
2.2 合理性评价结果 100%符合信迪利单抗药物利用评价标准的指标有:基线评估、用量、溶媒、给药途径、输注时间、联合用药相互作用。其余指标未达到100%符合评价标准,具体见表1。适应症合理率为21.57%,涉及19 个癌种,包括食管癌16 例、直肠癌1 例、非小细胞肺癌8 例、中耳癌1 例、肝癌3例、左颊癌1 例、结肠癌3 例、子宫癌1 例、前列腺癌3 例、阴茎癌1 例、鼻咽癌3 例、软组织恶性肿瘤1 例、恶性黑色素瘤2 例、下颌骨癌1 例、胃癌2 例、头颈部肿瘤1 例、小细胞肺癌1 例、胸腺瘤1 例、贲门癌1 例,总计51 例。35 例患者应用信迪利单抗联合抗肿瘤治疗的给药顺序合理,合理率为68.62%;2例患者行信迪利单抗治疗前给予等效日剂量≥泼尼松片10 mg 的糖皮质激素;36 例患者治疗前没有抗感染治疗,合理率为69.23%;仅有5 例患者的病程记录信迪利单抗治疗后出现的不良反应,提示患者病程记录不完整;21 例患者治疗有效, 有效率为41.18%。
3 讨论
肿瘤免疫治疗是目前非常热门的肿瘤治疗方法,国内免疫治疗新药不断上市。因免疫治疗药物的药理学、药动学、药效学相近,在临床治疗中,常常一种免疫治疗药物的适应症用于另一种免疫治疗药物,导致超适应症用药,降低疗效,增加患者用药风险和经济负担。通过制定信迪利单抗DUE 标准, 对信迪利单抗治疗进行分析和合理性评价,可规范临床合理应用信迪利单抗,提高用药合理性。
3.1 用药指征 超说明书用药是指临床实际使用药品的适应证、给药方法或剂量不在具有法律效力的说明书之内的用法,包括给药剂量、适应人群、适应证或给药途径等与药品说明书中的用法不同的情况[3]。因药品说明书有滞后性,未能及时更新具有高级别循证医学证据的用法,超说明书用药行为在国内外临床医疗工作中十分普遍。超说明书用药在给患者带来获益的同时,也给患者及医务人员带来风险。2021 年8 月,新版《医师法》第二十九条规定:医师应当坚持安全有效、 经济合理的用药原则,遵循药品临床应用指导原则、临床诊疗指南和药品说明书等合理用药。在尚无有效或者更好治疗手段等特殊情况下,医师取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据的药品用法实施治疗。抗肿瘤药物超说明书用药循证学证据在 《新型抗肿瘤药物临床应用指导原则(2021 年版)》有明确的要求:其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、临床诊疗指南,国家级学协会发布的经国家卫生健康委员会认可的诊疗规范、临床诊疗指南和临床路径等[4]。信迪利单抗为国产的PD-1单克隆抗体,在国外指南、规范以及广东省药学会发布的《超药品说明书用药目录(2021 年版)》中均无超说明书用药记录。所以,临床治疗中信迪利单抗超说明书用药,应视为不合理用药。本研究回顾性调查中, 信迪利单抗用药指征合理率21.57%,存在比较严重的超适应证用药现象。
3.2 用药过程 基线评估:在治疗前,行必要的体格检查、实验室检查和影像学检查,作为用药过程发生任何改变的参考依据, 可用于评价疗效和鉴别、治疗免疫相关不良反应[5-6]。但临床工作中,检查多不全面,主要原因为医师意识不强、医疗费用过高及患者依从性差。
信迪利单抗的用量、溶媒、给药途径、输注时间在说明书中有明确的规定,医师在用药前会参考说明书给药,所以合理率达到100%。本研究联合抗肿瘤治疗的给药顺序合理率为68.62%,糖皮质激素治疗的合理率为96.08%。信迪利单抗价格较高,患者及家属常需要考虑后使用,先给予其他抗肿瘤药物治疗控制症状, 导致联合治疗的符合标准率较低,常发生在首次治疗阶段。Arbour 等[7]使用PD-1 抑制剂治疗前30 d 内患者使用糖皮质激素(等效剂量为泼尼松片≥10 mg/d),生存期明显缩短。Ricciuti等[8]研究显示,影响PD-1 抑制剂疗效的患者PS 评分, 而不是应用糖皮质激素。在PD-1 抑制剂治疗前,如果没有使用糖皮质激素应用指证,尽可能不使用;如果与需要行糖皮质激素预处理的抗肿瘤药物联合治疗时,优先使用PD-1 抑制剂,而且信迪利单抗注射液说明书明确提示,在化疗前使用。
15 例患者行信迪利单抗治疗前应用抗菌药物,抗菌治疗合理率为70.56%。文献报道,虽然PD-1/PD-L1 不会增加感染风险,但可能会增加已存在潜伏感染重新激活的风险,所以对已出现严重感染或机会性感染的患者, 在行PD-1/PD-L1 治疗前应审慎考虑[9-11]。本院为省会市级三甲医院,收治的患者多为晚期肿瘤患者,一般情况差,常合并有感染症状,导致合理率较低。
信迪利单抗是人源化的单克隆抗体,不经细胞色素P450(CYP)酶或其他药物代谢酶代谢,因此,与其他药物相互作用较小。PD-1 抑制剂激活人体免疫系统杀伤肿瘤的同时,还产生独特的炎症性毒性,引起相应器官出现炎症症状,称为免疫相关性不良反应(immune-related adverse events,irAEs),以1 ~2 级常见,3 ~4 级较少,大部分为可逆性,多在4 ~12 周出现,最常见的表现为疲劳、腹泻、皮疹、瘙痒[12-15]。ORIENT-1 研究显示93%患者出现不良反应, 最常见的是发热, <18%患者出现3 级或4级不良反应,比传统化疗低了17% ~36%[16-18]。本研究记录5 例患者出现不良反应,发生率为9.80%,远低于上面的文献报道。考虑与医生观察病情不仔细、记录不及时、临床药师药学查房不全面、对患者用药教育不清晰明确导致患者未主动告知等因素有关。
3.3 用药结果 ORIENT-1 研究显示,行信迪利单抗单药治疗的患者,6 个月无进展生存期达到77.6%[16]。本研究21 例患者用药后临床症状改善或影像学检查提示病灶缩小或稳定, 有效率41.18%。其中,14 例患者持续行信迪利单抗治疗超过4 次,最长给药次数达16 次,有效率低于临床研究,可能与收治的晚期肿瘤患者多,一般情况较差有关。
通过建立信迪利单抗DUE 标准, 分析评价其在临床应用情况,发现存在的问题,需要在以下方面加以改进:严格把控治疗适应证,避免超适应证用药;基线评估要全面;病程记录及时、详细;持续改进和完善DUE 标准。希望DUE 能促进临床合理用药,提高肿瘤治疗疗效,促进临床药学发展,利于开展药学服务。

