虫草素对卵巢癌细胞中Fra-1和 p53表达的影响
张谷香,李书萍,李 波
(长沙市第四医院妇产科,湖南 长沙 410006)
卵巢癌是女性生殖系统恶性肿瘤之一,发病率和病死率均较高,严重危害女性健康[1]。卵巢生理结构复杂,隐藏较深不易触及,多数卵巢癌患者确诊时已是中晚期,患者5 a生存率为40%~50%[2]。目前,卵巢癌以手术及放射治疗和化学治疗为主,但有研究显示,手术后50%以上的卵巢癌患者出现复发,且多数伴随肿瘤细胞淋巴结转移;放射治疗和化学治疗虽然效果较好,但其毒副作用较大,影响预后[3-4]。因此,研发新的抗卵巢癌药物已经成为众多学者研究的重点。
中国传统医学为肿瘤的临床治疗提供了新的思路。虫草素是从冬虫夏草和蛹虫草中提取的有效成分,其具有广谱抗肿瘤活性[5]。但虫草素抗卵巢癌的作用机制尚不明确,需要进一步研究。Fra-1是转录因子激活蛋白-1(activator protein-1,AP-1)家族中的一员,其作为原癌基因,能够促进肿瘤的浸润及发展[6]。p53基因具有促进损伤细胞修复、调节细胞基因合成及诱导细胞凋亡的作用[7]。基于此,本研究通过探讨虫草素对卵巢癌细胞增殖、凋亡及Fra-1、p53表达的影响,进一步分析其对卵巢癌的作用机制。
1 材料与方法
1.1 细胞、药品、试剂与仪器人卵巢浆液性囊腺癌细胞株SKOV3购自中国科学院上海细胞所;虫草素购自河南希望生物技术有限公司;p53抗体购自深圳豪地华拓生物科技有限公司,Fra-1抗体购自上海士峰生物科技有限公司,Hoechst试剂盒购自北京晶美科技,RPMI-1640培养基和胎牛血清(fetal bovine serum,FBS)、2.5 g·L-1胰蛋白酶消化液购自中盛溯源生物技术有限公司;二氧化碳(carbon dioxide,CO2)培养箱购自济南来宝医疗器械有限公司,EPS200电泳仪购自北京原平皓生物技术有限公司。
1.2 实验方法
1.2.1 SKOV3细胞培养将低温冷藏的SKOV3细胞快速移入37 ℃水中溶解,3 000 r·min-1离心10 min后弃上清液,加入含体积分数10%FBS的RPMI-1640培养基,置于37 ℃含体积分数5% CO2恒温加湿培养箱中培养,每2~3 d传代1次。
1.2.2 细胞计数试剂盒-8(cell counting kit-8,CCK-8)检测SKOV3细胞活性取生长良好的对数生长期SKOV3细胞,加入2.5 g·L-1胰蛋白酶100 μL消化后,将SKOV3细胞制成悬浮液,以每孔5×103个细胞接种于96孔板中,培养24 h后将细胞分为A组、B组、C组和D组,分别加入0、10、30、60 μmol·L-1虫草素,培养48 h后,每孔加入10 μL CCK-8 试剂盒溶液,然后置于37 ℃、含体积分数5% CO2的培养箱中再培养4 h,使用酶标仪于450 nm波长下测吸光度值,并计算细胞活性,具体计算公式参考文献[6]。
1.2.3 Hoechst染色检测SKOV3细胞凋亡率将0、10、30、60 μmol·L-1虫草素处理后的SKOV3细胞以每孔5×103个接种于96孔板,40 g·L-1多聚甲醛固定0.5 h,采用TrintonX-100透明处理,Hoechst荧光染料室温染色30 min后,荧光显微镜观察细胞凋亡情况,计算细胞凋亡率,细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.2.4 Transwell实验检测SKOV3细胞侵袭能力将50 mg·L-1的Mtrigel胶用磷酸盐缓冲液(phosphate buffered saline,PBS)按照18比例进行稀释,自然风干后吸出残存的液体。将4组细胞全部接种在处理好的上室内,细胞密度为 1×106L-1,在下室内加入FBS进行培养。使用棉签将 Transwell小室内壁膜上的细胞拭去,体积分数95%乙醇固定30 min,结晶紫染色,显微镜视野中出现的有核细胞即为侵袭细胞,随机选取5个视野计数侵袭细胞数。
1.2.5 免疫印迹法检测SKOV3细胞中Fra-1、p53蛋白相对表达量培养72 h的SKOV3细胞,PBS冲洗,300×g离心5 min;加入100 μL 2.5 g·L-1胰蛋白裂解液,二辛可宁酸定量试剂盒进行蛋白定量,1 200×g离心10 min,用5×上样缓冲液混合于PBS稀释蛋白样品中,按照41的比例进行混合,然后在沸水浴中煮沸5 min,采用蛋白质定量法检测总蛋白浓度,每孔蛋白上样量20 μg,行十二烷基硫酸钠-聚丙烯酰胺钠凝胶电泳,质量分数5%的脱脂牛奶室温封闭60 min,分别加入稀释后的Fra-1一抗(11 000)、p53一抗(11 000),4 ℃封闭过夜;加入稀释后过氧化物酶标记的二抗(15 000),室温摇床孵育2 h,缓冲液振荡清洗(3×10 min),增强电化学发光试剂反应 3 min,最后用X线胶片压片,显影、定影后摄片并分析。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,以目的蛋白条带灰度值与内参蛋白条带灰度值的比值作为目的蛋白相对表达量。
1.2.6 实时荧光定量反转录聚合酶链反应(real-time reverse transcription polymerase chain reaction,qRT-PCR)法检测SKOV3细胞中Fra-1、p53 mRNA表达量将2 mL密度为1 × 109L-1的SKOV3细胞接种于6孔板中,将培养板置于37 ℃、体积分数为5%CO2饱和湿度的细胞培养箱中培养24 h,按照TRIzol说明书进行总RNA提取和纯化。应用反转录试剂盒将1 μg RNA反转录为cDNA,使用SYBR Green qRT-PCR试剂盒进行qRT-PCR反应。Fra-1上游引物序列为5′-GAACCGGAGGAAGGAACTGACC3′,下游引物序列为5′-CCCAGATTTCTCATCTTCCAGTTTG-3′;p53上游引物序列为5′-GGACAGCCACGTCTGTGACTTG-3′,下游引物序列为5′-CCAGTGGTTTCTTCTTTGGCTG-3′;内参β-action上游引物序列为5′-CGCTGCGCTGGTCGTCGACA-3′,下游引物序列为5′-GTCACGCACGATTTCCGCT -3′。扩增条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃15 s,60 ℃ 60 s,95 ℃15 s。采用2-ΔΔCt法计算Fra-1、p53 mRNA相对表达量。
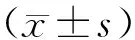
2 结果
2.1 不同浓度虫草素对SKOV3细胞活性的影响A组、B组、C组、D组SKOV3细胞活性分别为(100.00±10.50)%、(94.35±8.85)%、(65.01±6.44)%、(48.90±5.22)%,各组间总体比较差异有统计学意义(F=47.610,P<0.001)。A组与B组SKOV3细胞活性比较差异无统计学意义(P>0.05);C组及D组SKOV3细胞活性低于A组及B组,差异有统计学意义(P<0.05);D组SKOV3细胞活性低于C组,差异有统计学意义(P<0.05)。
2.2 不同浓度虫草素对SKOV3凋亡率的影响结果见图1。A组、B组、C组、D组SKOV3细胞凋亡率分别为(6.63±0.55)%、(8.44±1.25)%、(23.90±3.22)%、(37.50±4.01)%,各组间总体比较差异有统计学意义(F=149.200,P<0.001)。A组与B组SKOV3细胞凋亡率比较差异无统计学意义(P>0.05);C组及D组SKOV3细胞凋亡率高于A组及B组,差异有统计学意义(P<0.05);D组SKOV3细胞凋亡率高于C组,差异有统计学意义(P<0.05)。
图1 不同浓度虫草素对SKOV3细胞凋亡率的影响(Hoechst染色,×200)
2.3 不同浓度虫草素对SKOV3细胞侵袭能力的影响结果见图2。A组、B组、C组、D组穿膜细胞数分别为(245±12)、(233±10)、(160±11)、(95±8)个,各组间总体比较差异有统计学意义(F=215.600,P<0.001)。A组与B组穿膜细胞数比较差异无统计学意义(P>0.05);C组及D组穿膜细胞数少于A组、B组,差异有统计学意义(P<0.05);D组穿膜细胞数少于C组,差异有统计学意义(P<0.05)。

图2 不同浓度虫草素对SKOV3侵袭数目的影响(结晶紫染色,×200)
2.4 4组SKOV3细胞中Fra-1、p53蛋白相对表达量比较结果见图3。 A组、B组、C组、D组SKOV3细胞中Fra-1及p53蛋白相对表达量总体比较差异有统计学意义(FFra-1蛋白=191.300,Fp53蛋白=160.900;P<0.001)。A组与B组SKOV3细胞中Fra-1、p53蛋白相对表达量比较差异均无统计学意义(P>0.05);C组及D组SKOV3细胞中Fra-1蛋白相对表达量低于A组及B组,p53蛋白相对表达量高于A组、B组,差异均有统计学意义(P<0.05);D组SKOV3细胞中Fra-1蛋白相对表达量低于C组,p53蛋白相对表达量高于C组,差异均有统计学意义(P<0.05)。
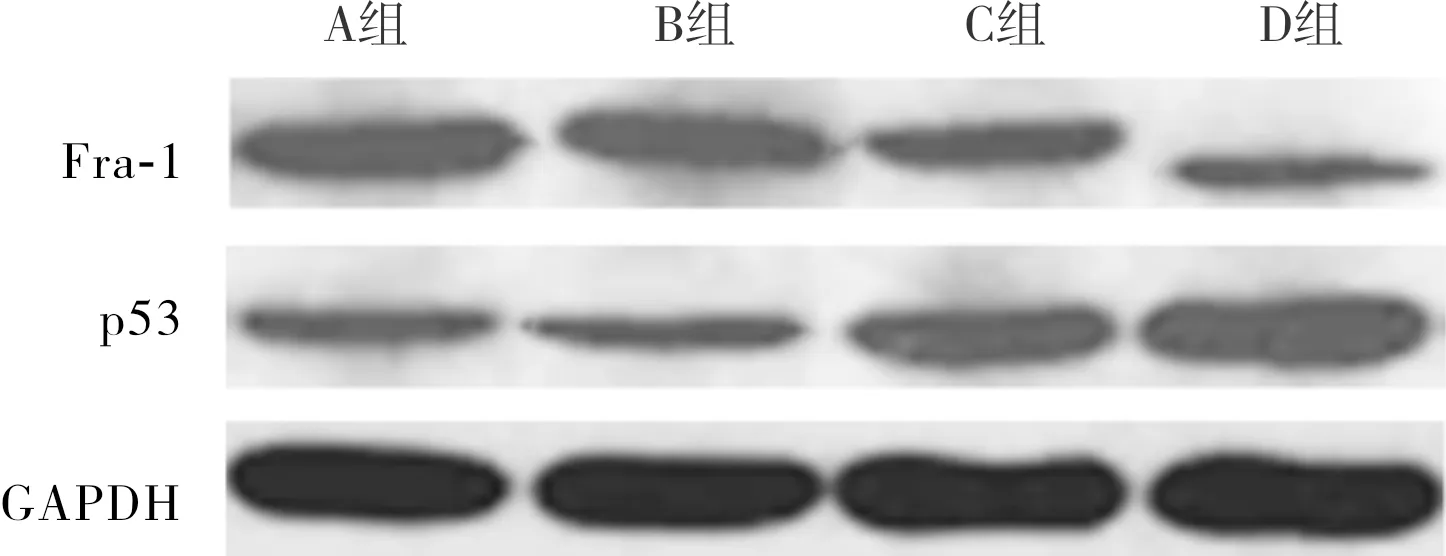
图3 4组SKOV3细胞中Fra-1、p53蛋白的表达(Western blot)
表1 4组SKOV3细胞中Fra-1、p53蛋白相对表达量比较
2.5 4组SKOV3细胞中Fra-1、p53 mRNA相对表达量比较结果见表2。A组、B组、C组及D组SKOV3细胞中Fra-1、p53 mRNA相对表达量总体比较差异有统计学意义(FFra-1 mRNA=142.300,Fp53 mRNA=113.500,P<0.001)。A组与B组SKOV3细胞中Fra-1、p53 mRNA相对表达量比较差异均无统计学意义(P>0.05);C组及D组SKOV3细胞中Fra-1 mRNA相对表达量低于A组及B组,p53 mRNA相对表达量高于A组及B组,差异均有统计学意义(P<0.05);D组SKOV3细胞中Fra-1 mRNA相对表达量低于C组,p53 mRNA相对表达量高于C组,差异均有统计学意义(P<0.05)。
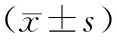
表2 4组SKOV3细胞中Fra-1、p53 mRNA相对表达量比较
3 讨论
近年来,随着人们饮食结构的改变及环境因素的影响,恶性肿瘤患者不断增多。肿瘤的发生与细胞活性升高、凋亡机制失衡等密切相关。卵巢癌是导致女性死亡率逐年攀升的主要诱因,患者手术治疗后易复发,需要反复治疗,严重影响患者的生存质量[8]。传统中医在恶性肿瘤的治疗中越来越受到重视。虫草素是我国较为名贵的中药提取物,既往体外实验表明,虫草素能够抑制乳腺癌、宫颈癌细胞增殖,起到抗肿瘤效果,改善患者预后[9]。本研究通过体外培养SKOV3细胞,并经不同浓度虫草素干预,观察其对SKOV3细胞生物活性及信号通路的影响。
卵巢癌细胞存在多种表型异常,最显著的特征是癌细胞生长异常,细胞凋亡失调,发生机制与癌细胞生长缺少对调控信号应答有关。卵巢癌细胞快速增殖,主要表现特征是促癌基因快速复制,蛋白质加快合成,细胞体积增大后不断分裂,促进肿瘤生长[10]。临床通常采用药物干预加快肿瘤细胞凋亡,达到治疗疾病的目的。肿瘤细胞侵袭是癌细胞从原有宿主细胞内分离出来,向癌旁组织或细胞内呈现浸润生长。有研究显示,癌细胞能够进入淋巴,通过特有的通道进入靶向部位,黏附后又穿过血管壁,在基质层内不断增殖,形成与原发肿瘤相似的继发肿瘤[11]。虫草素起初是由德国学者从蛹虫草提取的腺苷类似物抗生素,生物活性广泛。近期研究发现,虫草素能够抑制卵巢癌细胞增殖、侵袭并加快其凋亡,其机制可能为通过结合A3腺苷受体,激活G蛋白,抑制环单磷腺苷形成,减少糖原合酶激酶-3β/β-联蛋白及细胞周期蛋白D1表达,从而达到抑制细胞增殖的效果[12-13]。WANG等[14]研究表明,虫草素通过结合DR3受体诱导卵巢癌细胞凋亡,从而激活促凋亡蛋白caspase-8/-3,抑制癌细胞活性。本研究结果显示,随着虫草素浓度的升高,SKOV3细胞生物活性减弱,凋亡加剧,说明虫草素能够抑制卵巢癌细胞活性,控制肿瘤生长。
Fra-1基因存在于转录因子AP-1家族的Fos亚家族中,其可通过激活促分裂原活化蛋白激酶等信号通路调控细胞增殖、凋亡而促进细胞恶性转化。有研究显示,Fra-1在多种癌细胞内呈过表达,并参与癌细胞的恶性侵袭及分裂等过程[15]。Fra-1能够加快卵巢癌细胞活性,促进癌细胞有丝分裂,对肿瘤的发展有正向促进作用[16]。在人乳头状瘤病毒(human papilloma rirus,HPV)感染相关的舌癌中,外源性敲除Fra-2基因,舌癌细胞中基质金属蛋白酶-9、cyclinD和HPV E6/E7下调,细胞增殖率、迁移及侵袭数量均显著降低,表明沉默Fra-1具有抗肿瘤作用[17]。WU等[18]研究显示,通过siRNA技术沉默Fra-1后,卵巢癌细胞活性降低,化学治疗敏感性升高,其作用机制与靶向细胞外信号调节激酶/C-Jun N末端激酶信号通路有关。p53进化相对保守,能够修复损伤细胞,加快细胞灭活。在卵巢癌细胞p53呈低表达,且随着卵巢癌细胞活性增加,p53表达水平逐渐降低[19]。张瑞涛等[20]研究显示,当机体发生p53信号突变时,对癌细胞的抑制作用减弱。本研究结果显示,不同浓度虫草素干预SKOV3细胞后,随着虫草素浓度的增加,p53表达升高,Fra-1表达降低。卢群等[21]和刘建兵等[22]研究显示,虫草素诱导癌细胞凋亡与激活p53蛋白表达、降低Bcl-2/Bax水平、诱导caspase-3活化有关。武亭宇等[23]通过网络药理学研究发现,虫草素可作用于p53等多个癌症靶点基因,参与线粒体膜电位调节,通过调控多个信号通路促进癌细胞凋亡,降低铂类耐药性,可作为潜在的抗癌药物进一步研究。
综上所述,虫草素可抑制SKOV3细胞活性,降低其侵袭能力,促进其凋亡,且呈现浓度依赖性,其机制可能与升高p53表达、降低Fra-1表达相关。

