盐霉素对乳腺癌干细胞增殖和凋亡的影响及其作用机制
曹露,吴开祥,张亚,孙雯雯,杨会,张树鹏
山东第一医科大学第二附属医院病理科,山东泰安271000
近年来,我国乳腺癌的发病率逐年上升,已成为威胁女性健康的“头号杀手”。目前,乳腺癌的治疗方法主要有外科手术、化疗、内分泌治疗等[1-2]。以往认为,肿瘤细胞具有同一性,传统肿瘤治疗方法针对的是具有同一性的肿瘤细胞,放过了肿瘤干细胞,所以治疗后常常会复发和转移,这也是导致患者死亡的重要原因[1]。消灭肿瘤干细胞有可能为肿瘤治疗开辟新的途径。2003年AL-HAJJ等[3]从乳腺癌组织中分离出具有CD44+/CD24-/low特殊表型的乳腺癌细胞,并将100个具有这种表型的乳腺癌细胞注射于NOD/SCID小鼠体内,数月内即可在体内形成1 cm左右大小的肿瘤,而CD44+/CD24+表型的乳腺癌亚群细胞即使注射多于10 000个也未能形成肿瘤。结果表明,具有CD44+/CD24-/low表型的乳腺癌亚群细胞有可能是乳腺癌干细胞。盐霉素是一种新型的靶向杀伤肿瘤干细胞药物[4]。GUPTA等[5]研究发现,盐霉素具有特异性杀伤乳腺癌干细胞的作用,并且其对乳腺癌干细胞的杀伤作用是紫杉醇的100多倍。本研究观察了盐霉素对乳腺癌干细胞增殖和凋亡的影响,并探讨其作用机制。现报告如下。
1 材料与方法
1.1 材料 人乳腺癌细胞株MCF-7(以下称MCF-7细胞),由山东第一医科大学生命科学研究中心实验室保存。盐霉素,纯度>99%,购自美国Sigma公司,试验前用DMSO配制成浓度1.33 mmol/L盐霉素溶液,4℃冰箱保存。显微镜,购自日本Olympus公司;酶标仪,购自美国BIO-RAD公司;FACS Calibur流式细胞仪,购自美国BD公司。MTT细胞增殖及细胞毒性检测试剂盒,购自美国Genview公司;Annexin V-FITC/PI细胞凋亡检测试剂盒,购自南京凯基生物科技发展有限公司。CD44-FITC、CD24-PE,购自美国Becton Dickinson公司;Caspase-3、Caspase-9、PARP、β-catenin、Survivin、Bcl-2、Bax、β-actin一抗,购自美国Cell Signaling Technology公司;通用型二抗,购自北京中杉金桥生物技术有限公司。
1.2 乳腺癌干细胞鉴定
1.2.1 细胞培养与传代 将MCF-7细胞接种于含20 ng/mL表皮生长因子、10 ng/mL碱性成纤维细胞生长因子、0.4%B27细胞培养添加剂的DMEM/F12培养液,置于37℃、5%CO2、饱和湿度的细胞培养箱培养。每2~3天更换1次新鲜培养液。培养1周左右,MCF-7细胞不断增殖形成微球体,用0.125%胰蛋白酶消化成单细胞悬液,800 r/min离心3 min,弃上清;收集细胞,以1×105个/mL密度接种于上述新鲜培养液,培养下一代悬浮微球体细胞,依此类推。
1.2.2 乳腺癌干细胞检测 取对数生长期MCF-7细胞和第3代悬浮微球体细胞,分别用胰蛋白酶-EDTA消化成单细胞悬液,收集MCF-7细胞和第3代悬浮微球体细胞各约1×106个,置于流式管中,PBS重悬,然后分别加入CD44-FITC、CD24-PE各5μL,充分混匀,4℃孵育30 min,采用流式细胞术检测乳腺癌干细胞百分比。
1.3 乳腺癌干细胞盐霉素干预后细胞活性检测 取第3代悬浮微球体细胞,用新鲜培养液重悬,调整细胞密度为1×105个/mL,接种于96孔板,每孔200μL。随机将细胞分为0.5、2、5、7、9μmol/L盐霉素组,待微球体形成后,加入适量盐霉素溶液,使盐霉素终浓度分别为0.5、2、5、7、9μmol/L。另设阴性对照组,不予盐霉素干预。继续孵育12、24、48 h,每孔加入5 mg/mL MTT溶液20μL,继续孵育4 h,终止培养,小心吸弃孔内培养液,每孔加入DMSO 150μL,轻微振荡,使结晶充分溶解。酶标仪于490 nm波长处检测各孔的吸光度值,计算细胞存活率。
1.4 乳腺癌干细胞盐霉素干预后细胞形态学观察 取第3代悬浮微球体细胞,调整细胞密度为1×105个/mL,接种于6孔板,每孔2 mL。随机将细胞分为2.5、5、9μmol/L盐霉素组,待微球体形成后,加入适量盐霉素溶液,使盐霉素终浓度分别为2.5、5、9μmol/L。另设阴性对照组,不予盐霉素干预。继续孵育24 h,倒置相差显微镜下观察乳腺癌干细胞形态学变化。
1.5 乳腺癌干细胞盐霉素干预后细胞凋亡率检测 取第3代悬浮微球体细胞,调整细胞密度为1×105个/mL,接种于6孔板,每孔2 mL。随机将细胞分为2、5、9μmol/L盐霉素组,待微球体形成后,加入适量盐霉素溶液,使盐霉素终浓度分别为2、5、9μmol/L。另设阴性对照组,不予盐霉素干预。继续孵育24 h,收集5×105个细胞,结合缓冲液500μL重悬,然后分别加入Annexin V-FITC和PI各5μL,充分混匀,室温避光反应15 min,1 h内上流式细胞仪检测细胞凋亡率。
1.6 乳腺癌干细胞盐霉素干预后细胞周期检测 取第3代悬浮微球体细胞,调整细胞密度为1×105个/mL,接种于6孔板,每孔2 mL。随机将细胞分为2、5、9μmol/L盐霉素组,待微球体形成后,加入适量盐霉素溶液,使盐霉素终浓度分别为2、5、9μmol/L。另设阴性对照组,不予盐霉素干预。继续孵育24 h,收集1×106个细胞,加入75%乙醇固定,4℃过夜。次日,800 r/min离心6 min,弃上清,PBS 450μL重悬,然后加入核糖核酸酶A 5μL,37℃水浴30 min,再加入PI 1μL,避光反应10 min。上流式细胞仪检测细胞周期。
1.7 乳腺癌干细胞盐霉素干预后凋亡相关蛋白检测 取第3代悬浮微球体细胞,调整细胞密度为1×105个/mL,接种于6孔板,每孔2 mL。随机将细胞分为0.5、2、5、9μmol/L盐霉素组,待微球体形成后,加入适量盐霉素溶液,使盐霉素终浓度分别为0.5、2、5、9μmol/L。另设阴性对照组,不予盐霉素干预。继续孵育24 h,收集细胞,提取细胞总蛋白,BCA法蛋白定量合格。加入4×上样缓冲液,煮沸变性。取变性蛋白30μg,SDS-PAGE分离蛋白。电泳结束,将蛋白电泳产物转印至PVDF膜上,用8%脱脂奶粉室温封 闭4 h,分 别 加 入Caspase-3、Caspase-9、PARP、β-catenin、Survivin、Bcl-2、Bax、β-actin一抗,4℃孵育过夜。次日,加入通用型二抗,室温孵育1 h,ECL化学发光,暗室中曝光、显影。采用Image-Pro Plus软件分析各蛋白电泳条带灰度值。以β-actin为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。
1.8 统计学方法 采用SPSS13.0统计软件。符合正态分布的计量资料以xˉ±s表示,多样本均数比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两样本均数比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌干细胞鉴定 倒置相差显微镜下观察,MCF-7细胞以大小不等的微球方式生长,随着培养时间延长,微球体积逐渐增大,以第3代悬浮微球细胞生长最为迅速,成球能力最强。经流式细胞仪鉴定,在悬浮微球细胞中CD44+/CD24-/low表型的乳腺癌干细胞比例为(87.0±0.4)%,而在MCF-7细胞中为(40.1±1.0)%,二者比较P<0.05。
2.2 各组乳腺癌干细胞盐霉素干预后细胞存活率比较 不同浓度盐霉素均能抑制乳腺癌干细胞存活,并且其抑制作用呈时间和浓度依赖性(P均<0.05)。各组乳腺癌干细胞盐霉素干预后细胞存活率比较见表1。

表1 各组乳腺癌干细胞盐霉素干预后细胞存活率比较(xˉ±s)
2.3 各组乳腺癌干细胞盐霉素干预后细胞形态学变化 倒置相差显微镜下观察,阴性对照组悬浮培养的肿瘤细胞折光性好,边界清晰,大小均一,以微球方式进行生长,随着培养时间延长,微球体积逐渐增大;2.5、5、9μmol/L盐霉素组干预24 h后,乳腺癌微球体逐渐解聚,密度降低,细胞大小不一、极度不规则,肿瘤细胞内部出现颗粒,细胞出现水肿、固缩,细胞碎片产生,并且随着盐霉素浓度增加,凋亡现象越来越明显。
2.4 各组乳腺癌干细胞盐霉素干预后细胞凋亡率比较 见表2。

表2 各组乳腺癌干细胞盐霉素干预后细胞凋亡率比较(%,xˉ±s)
2.5 各组乳腺癌干细胞盐霉素干预后细胞周期变化 见表3。
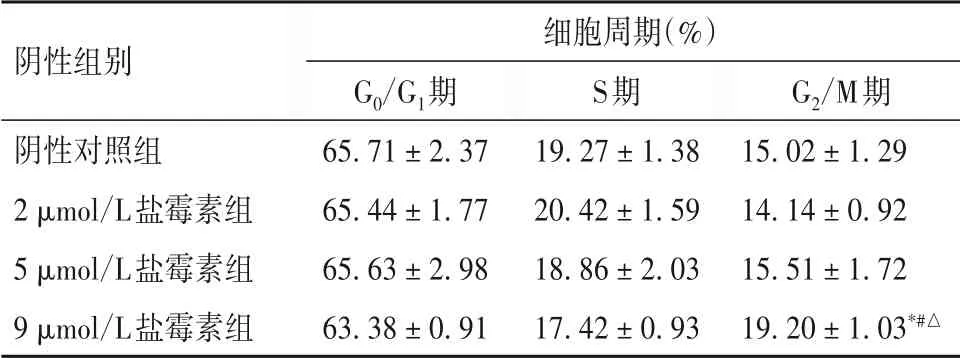
表3 各组乳腺癌干细胞盐霉素干预后细胞周期变化(xˉ±s)
2.6 各组乳腺癌干细胞盐霉素干预后细胞凋亡相关蛋白表达比较 见表4。
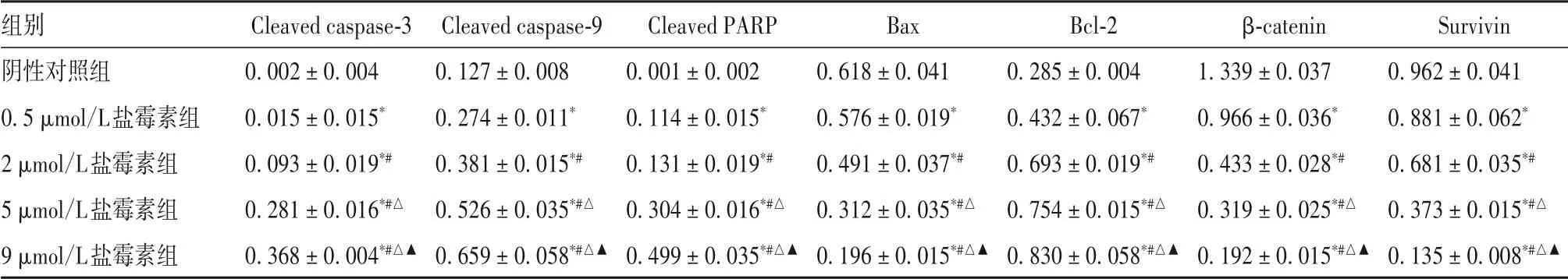
表4 各组乳腺癌干细胞盐霉素干预后细胞凋亡相关蛋白表达比较(xˉ±s)
3 讨论
肿瘤干细胞理论认为,肿瘤组织如同一个器官,其内部所有肿瘤细胞并不具有同一性,它们在细胞增殖和肿瘤形成能力方面存在较大差异。肿瘤组织重建仅是由部分具有特殊表型的亚群细胞增殖、分化形成,这种具有特殊表型的亚群细胞叫做肿瘤起始细胞,它可以实现自我更新和分化,能够促进肿瘤生长和转移。由于这部分肿瘤细胞具有人正常干细胞寿命长、分裂缓慢等生物学特征,又被称为肿瘤干细胞[1,6]。乳腺癌干细胞鉴定一直是近年来的研究热点。VERSINI等[7]研究发现,乳腺浸润性微乳头状癌和浸润性导管癌组织CD44分子表达明显高于正常乳腺组织。ZHANG等[8]在基底型乳腺癌组织中发现,近90%的乳腺癌组织含有CD44+/CD24-/low表型的肿瘤细胞。O′CONOR等[9]在三阴性乳腺癌中亦发现,CD44+/CD24-/low表型的乳腺癌细胞比例与肿瘤复发和远处转移呈正相关关系。这些研究结果表明,CD44+/CD24-/low表型的乳腺癌细胞是乳腺癌干细胞的亚群。
盐霉素是从白色链霉菌的培养液中分离出来的一种生物活性物质,相对分子质量为751 kD,属于一元聚醚类抗生素。盐霉素是一种高效、广谱、低耐药性和低残留的抗生素,过去一直被作为广谱抗球虫药应用[10-11]。2009年GUPTA等[5]首次发现,盐霉素具有特异性杀伤乳腺癌干细胞的作用。最近研究证实,盐霉素对人类各种恶性肿瘤干细胞具有不同程度杀伤作用,如乳腺癌[7]、胃癌[8]、肺腺癌和鳞癌[12]、结直肠癌[13]和前列腺癌[14]。但其具体作用机制尚不完全清楚。
本研究采用无血清添加生长因子方法培养的MCF-7细胞主要呈CD44+/CD24-/low表型,并将富集CD44+/CD24-/low表型的乳腺癌微球体细胞作为乳腺癌干细胞进行后续实验。结果发现,不同浓度盐霉素均能抑制乳腺癌干细胞存活,并且其抑制作用呈时间和浓度依赖性;细胞形态学观察和细胞凋亡检测证实,盐霉素能够促进乳腺癌干细胞凋亡。本研究结果发现,高浓度盐霉素能够使乳腺癌干细胞G2/M期阻滞,表明盐霉素在诱导乳腺癌干细胞凋亡过程中可能伴有细胞周期改变。进一步研究发现,盐霉素能够将Caspase-9、Caspase-3剪接成有活性的Cleaved caspase-9、Cleaved caspase-3,并且PARP的切割产物也随着盐霉素浓度升高而增多;盐霉素还能抑制抗凋亡蛋白Bcl-2表达,增强促凋亡蛋白Bax表达,表明盐霉素能够通过调控Bcl家族中Bcl-2、Bax表达,调控乳腺癌干细胞凋亡。此外,盐霉素还能下调β-catenin、Survivin蛋白表达,并且其作用呈浓度依赖性,与张春影等[15]报道一致。由此,我们推测盐霉素可能通过抑制β-catenin-Survivin-Caspase-3通路和干扰Wnt信号通路活性,诱导乳腺癌干细胞凋亡,从而抑制乳腺癌的发生、发展。
综上所述,盐霉素能够抑制乳腺癌干细胞增殖并诱导其凋亡,其机制可能与抑制β-catenin-Sur⁃vivin-Caspase-3通路和干扰Wnt信号通路活性有关。但盐霉素对乳腺癌干细胞的具体作用机制仍不完全清楚,尚需进一步研究。

