食管癌组织lncRNA PCAT-1、ANXA10表达变化及其临床意义
蒲高祥,姚阳
遂宁市中心医院肿瘤科,四川遂宁629000
食管癌是一种原发于食管上皮细胞的恶性肿瘤,在我国具有较高的发病率和病死率[1]。食管癌的发生与癌基因激活和抑癌基因失活密切相关,但其确切的发病机制尚不完全清楚。因此,探索食管癌发病的分子机制,对其早期诊断和靶向治疗具有重要意义。长链非编码RNA(lncRNA)是一类转录本长度超过200 nt的RNA分子,能够参与细胞增殖、凋亡等生物学过程。前列腺癌相关转录因子1(PCAT-1)是lncRNA家族成员之一,定位于人染色体8q24上,能够参与染色体重构、脂质代谢及细胞有丝分裂等过程,还能促进肿瘤细胞增殖和侵袭[2]。有研究发现,PCAT-1通过结合其靶基因PRC2阻碍抑癌基因BRCA2表达,从而使DNA修复和基因重组能力减弱,最终导致前列腺癌的发生风险增加[3]。由此推测,PCAT-1在前列腺癌的发病过程中可能起原癌基因作用。膜联蛋白A10(ANXA10)属于Ca2+依赖磷脂结合蛋白,定位于人染色体4q33上,在免疫抑制、细胞增殖、抑制蛋白激酶活性等方面具有重要作用[4]。有研究报道,肝癌细胞ANXA10表达降低,且其表达与甲胎蛋白水平上调、p53基因突变以及肝癌复发有关[5],提示ANXA10在抑制肝癌的发生、发展过程中具有抑癌基因作用。但目前lncRNA PCAT-1、ANXA10表达与食管癌的关系报道较少。2016年5月—2017年10月,本研究观察了食管癌组织lncRNA PCAT-1、ANXA10表达变化,并探讨其表达与患者临床病理特征和预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择同期遂宁市中心医院收治的食管癌患者87例。纳入标准:①符合食管癌诊断标准[6],并经术后组织病理检查明确诊断;②初诊;③年龄≥18岁;④具备食管癌根治手术指征;⑤既往无放化疗史或食管手术史。排除标准:①合并Barrett食管炎或反流性食管炎者;②伴有其他部位原发性恶性肿瘤者;③肝肾功能失代偿者;④先天性免疫功能异常者。其中,男60例、女27例,年龄42~70(58.21±7.33)岁,酗酒52例;肿 瘤直径:>3 cm 33例,≤3 cm 54例;TNM分期:Ⅰ、Ⅱ期76例,Ⅲ期11例;组织分化程度:低分化8例,中分化38例,高分化41例;有淋巴结转移7例,无淋巴结转移80例。本研究经遂宁市中心医院医学伦理委员会批准(审批文号:2016-0124),患者或其家属知情同意并签属知情同意书。
1.2 lncRNA PCAT-1、ANXA10表达检测 采用实时荧光定量PCR技术。收集术中新鲜获取的食管癌组织及癌旁组织(距肿瘤组织边缘≥5 cm,经组织病理检查证实为正常食管组织),液氮速冻后转运至-80℃冰箱保存,待组织成批。取部分食管癌组织与癌旁正常组织,液氮下充分研磨,采用TRIzol法提取组织总RNA,经紫外可见分光光度计鉴定,OD260/OD280为1.8~2.0。按PrimeScript RT Reagent Kit说明将总RNA反转录为cDNA。反转录条件:42℃60 min,70℃5 min。以cDNA为模板,按SYBR Green PCR Master Mix Kit说明进行PCR扩增。所有引物序列由北京天根生化科技有限公司设计合成。引物序列:lncRNA PCAT-1上游引物5′-TTGTGGAAGCCCCGCAAGGCCTGAA-3′、下游引物5′-TGTGGGGCCTGCACTGGCACTT-3′,内参GAPDH上 游 引 物5′-GTCAACGGATTTGGTCTGTATT-3′、下 游 引 物5′-AGTCTTCTGGGTGGCAGTGAT-3′;ANXA10上游引物5′-GAGCAGCTTTCGGATCACTT-3′、下游引物5′-TCATCAGTGCCTACTCCCTTC-3′,内参GAPDH上游引物5′-CCTCTGACTTCAACAGC⁃GACAC-3′、下游引物5′-TCCACCACCCTGTTGCTG⁃TA-3′。PCR扩增体系共20μL:2×SYBR Master Mix 10μL,cDNA模板2μL,上下游引物各0.4μL,dH2O 7.2μL;反应条件:95℃5 min,95℃5 s、60℃20 s、72℃15 s共40个循环。扩增反应结束后进行熔解曲线分析。以GAPDH为内参,采用2-ΔΔCT法计算目的基因相对表达量。实验重复3次,取平均值。
1.3 随访 所有患者出院后以电话或门诊复查形式定期随访,随访截至2020年10月30日,统计患者3年总体生存率。
1.4 统计学方法 采用SPSS22.0统计软件。计量资料经Shapiro-Wilk检验符合正态分布,以±s表示,结果比较采用单因素方差分析或独立样本t检验。相关性分析采用Pearson相关分析法。生存分析采用Kaplan-Meier法,生存率比较采用Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 食管癌组织与癌旁正常组织lncRNA PCAT-1、ANXA10表达比较 食管癌组织lncRNA PCAT-1相对表达量为3.64±1.31,癌旁正常组织为1.22±0.56,食管癌组织lncRNA PCAT-1相对表达量高于癌旁正常组织(t=15.844,P<0.05);食管癌组织ANXA10相对表达量为0.61±0.23,癌旁正常组织为1.95±0.74,食管癌组织ANXA10相对表达量低于癌旁正常组织(t=16.129,P<0.05)。
2.2 食管癌组织lncRNA PCAT-1、ANXA10表达与患者临床病理特征的关系 见表1。
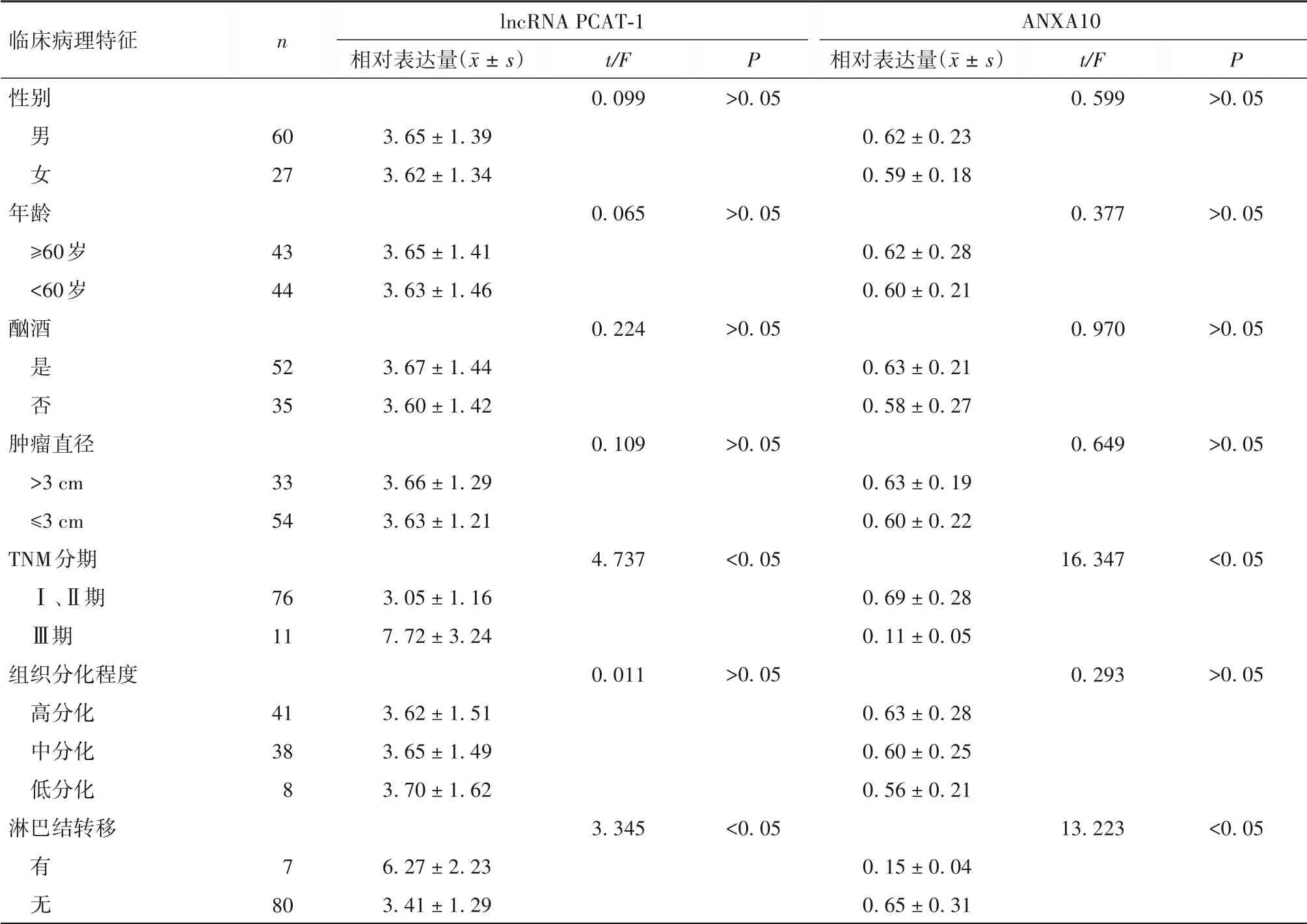
表1 食管癌组织lncRNA PCAT-1、ANXA10相对表达量与患者临床病理特征的关系
2.3 食管癌组织lncRNA PCAT-1表达与ANXA10表达的关系 Pearson相关分析显示,食管癌组织lncRNA PCAT-1表达与ANXA10表达呈负相关关系(r=-0.757,P<0.05)。
2.4 食管癌组织lncRNA PCAT-1、ANXA10表达与患者预后的关系 至随访截至日期,共随访1~36个月,随访期间死亡37例,无失访病例。以食管癌组织lncRNA PCAT-1相对表达量的中位数(3.63)为临界值,将患者分为lncRNA PCAT-1高表达者(≥3.63,43例)、lncRNA PCAT-1低表达者(<3.63,44例),lncRNA PCAT-1高表达者3年总体生存率为37.21%(16/43),lncRNA PCAT-1低 表 达 者 为59.09%(26/44),lncRNA PCAT-1高表达者3年总体生存率低于lncRNA PCAT-1低表达者(χ2=4.167,P<0.05)。以食管癌组织ANXA10相对表达量的中位数(0.62)为临界值,将患者分为ANXA10高表达者(≥0.62,41例)、ANXA10低表达者(<0.62,46例),ANXA10高表达者3年总体生存率为60.98%(25/41),ANXA10低表达者为36.96%(17/46),ANXA10高表达者3年总体生存率高于ANXA10低表达者(χ2=5.696,P<0.05)。见图1、2。
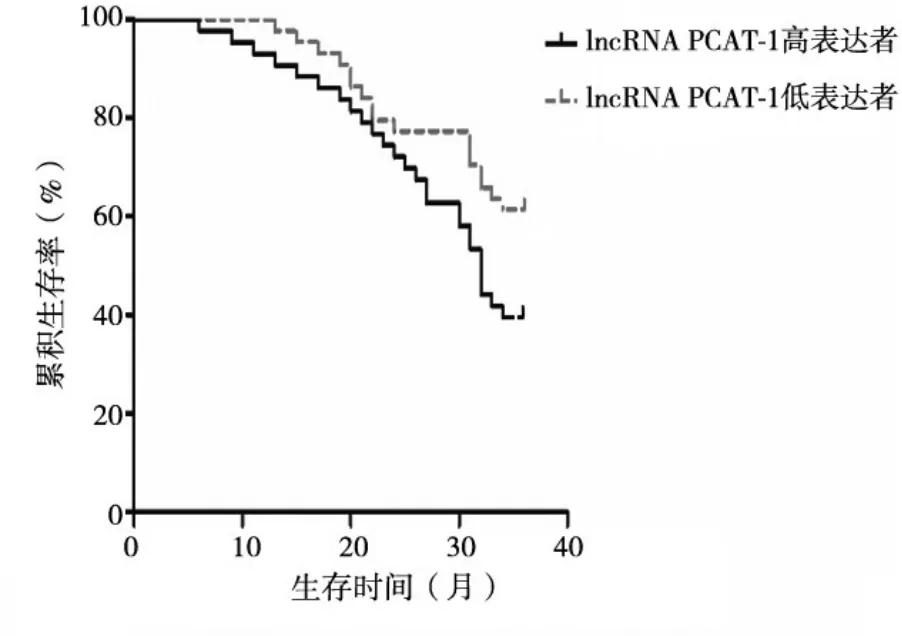
图1 食管癌组织不同lncRNA PCAT-1表达者生存曲线
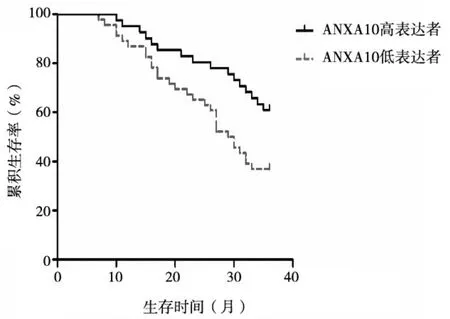
图2 食管癌组织不同ANXA10表达者生存曲线
3 讨论
我国是世界上食管癌的高发国家之一,每年因食管癌死亡约15万例,并且男性死亡例数约为女性的2倍[1]。有研究报道,食管癌发生的本质是细胞基因组改变,特别是一些癌基因和抑癌基因改变[7-8]。近年来,随着基因测序技术不断成熟,人们逐渐发现组蛋白修饰、lncRNA、DNA拷贝数改变以及DNA甲基化等能够参与肿瘤细胞的分化和凋亡,影响肿瘤微环境,在肿瘤发生、发展中扮演重要角色[9]。但食管癌发病的确切分子机制仍不完全清楚。
lncRNA是一类转录本长度超过200 nt的RNA分子,由于缺乏有效的开放阅读框,不具备编码蛋白质的功能,过去被认为是转录的副产物。近年随着人们对lncRNA认识的逐步深入,发现lncRNA能够通过调控染色质重构、磷酸化以及miRNA降解等生物学过程,参与细胞增殖、分化、凋亡等生命活动[8]。lncRNA PCAT-1属于Mariner转座子家族,与前列腺癌风险相关的单核苷酸多态性位点毗邻,能够以竞争性结合miRNA的方式调节靶基因表达[10]。有研究表明,miR-218能够通过与lncRNA PCAT-1结合,抑制lncRNA PCAT-1表达,从而使结合物蛋白基因沉默,继而使肝癌细胞增殖速度降低[11],结果提示lncRNA PCAT-1在肝癌的发生、发展中可能具有促癌基因作用。药物试验表明,食管癌组织lncRNA PCAT-1基因沉默后肿瘤细胞增殖能力明显减弱,同时其对顺铂的耐药性明显降低[12]。本研究结果发现,食管癌组织lncRNA PCAT-1高表达,并且其表达与肿瘤TNM分期和淋巴结转移有关。提示lncRNA PCAT-1可能参与食管癌的发生、发展,其机制可能为食管癌组织原癌基因c-Myc表达上调,而c-Myc是lncRNA PCAT-1的上游基因,能够结合lncRNA PCAT-1的Alu序列,使其启动子激活,从而使lncRNA PCAT-1表 达 上 调[10]。有 研 究 亦 发 现,lncRNA PCAT-1表达上调能够激活Cyclin B、Cyclin E、Cyclin D1等细胞周期蛋白,使G0/G1期肿瘤细胞数量降低,而S期肿瘤细胞数量增加,加速细胞周期循环,从而导致肿瘤细胞分裂和分化能力增强[13-14]。此外,lncRNA PCAT-1高表达还能促进基质金属蛋白酶2、基质金属蛋白酶9表达,使Snial基因活化,从而促进上皮间质转化,使肿瘤细胞易于侵袭和迁移[12]。
ANXA10属于Annexins家族成员,其C末端能够结合Ca2+和磷脂形成空间三级结构,而N末端在与其他蛋白结合后能够决定其相应的生物学功能[4]。Annexins家族是重要的膜功能蛋白,在胞吞、胞吐、Ca2+信号传导、抗凝、细胞分裂和分化、血管生成以及免疫抑制等方面具有重要的调控作用[15-16]。有研究发现,上调ANXA10表达能够抑制肝癌细胞增殖和分化,并且其表达变化与肝癌临床分期、组织分化程度和患者预后呈负相关[17]。既往研究发现,ANXA10能够抑制钙结合蛋白S100A4表达,而S100A4是肿瘤侵袭和转移的重要诱导剂之一,其表达下调能够阻碍肿瘤进展[15],表明ANXA10在细胞癌变过程中具有抑制作用。本研究结果发现,食管癌组织ANXA10相对表达量降低,并且其表达与肿瘤TNM分期和淋巴结转移有关,结果提示ANXA10可能在食管癌的发生、发展中具有抑制作用,其机制可能为ANXA10转录基因甲基化,使其染色质结构和DNA构象发生改变,从而导致ANXA10转录基因沉默,继而引起ANXA10表达下调[18]。有研究表明,ANXA10表达下调可导致结合衔接蛋白Grb2能力减弱,从而使ERK/MAPK信号通路活化,肿瘤细胞释放大量生长因子,并促进肿瘤细胞分裂,加速肿瘤细胞增殖和迁移[15-16]。此外,ANXA10表达下调对钙结合蛋白S100A4的抑制能力减弱,而活化的S100A4能够结合晚期糖基化终末产物受体,从而激活NF-κB信号通路,促进肿瘤细胞侵袭和迁移[19]。
本研究结果发现,食管癌组织lncRNA PCAT-1表达与ANXA10表达呈负相关关系,提示lncRNA PCAT-1可能通过结合ANXA10转录基因靶点,使ANXA10蛋白转录受阻,进而导致食管癌侵袭能力增强。有研究表明,lncRNA PCAT-1通过海绵miR-508-3p基因抑制ANXA10表达,从而促进食管癌进展[20]。ZANG等[21]研究认为,ANXA2能够与c-Myc结合,而c-Myc又是lncRNA PCAT-1的靶点基因,表明lncRNA PCAT-1与Annexins家族确实存在一定联系,但其具体机制仍不清楚,尚需进一步研究证实。本研究结果还发现,lncRNA PCAT-1高表达者3年总体生存率低于lncRNA PCAT-1低表达者,ANXA10高表达者3年总体生存率高于ANXA10低表达者,即lncRNA PCAT-1表达上调和ANXA10表达下调时,食管癌患者生存时间明显缩短。结果表明,lncRNA PCAT-1、ANXA10表达变化可能与食管癌患者预后密切相关。
综上所述,食管癌组织lncRNA PCAT-1高表达、ANXA10低表达,二者表达与肿瘤TNM分期、淋巴结转移和患者预后有关。lncRNA PCAT-1、ANXA10有可能成为食管癌早期诊断、靶向治疗和预后评估的生物标志物。

