m6A RNA甲基化调节因子与肝细胞癌预后的关系
裴晓健,贾宝学,田晓彤
山东第一医科大学第三附属医院内一科,济南250031
肝细胞癌(HCC)是原发性肝癌中最常见的病理类型,因其早期诊断困难、病情进展迅速,预后较差[1]。迄今为止,HCC的发病机制仍未完全阐明,其演变可能是由遗传学和表观遗传学共同改变所致。N6-甲基腺嘌呤(m6A)是真核生物mRNA中含量最丰富的甲基化修饰形式[2-3]。m6A RNA甲基化类似于DNA甲基化和组蛋白修饰,由“编写器”、“阅读器”和“擦除器”等甲基化调节因子动态调节共同完成[3]。这些m6A RNA甲基化调节因子与肿瘤干细胞自我更新和肿瘤细胞增殖、分化以及放化疗敏感性密切相关[4]。但目前m6A RNA甲基化调节因子在HCC中的作用及其对预后的影响尚未得到证实。为此,本研究观察了m6A RNA甲基化调节因子在HCC中的表达,并探讨其与预后的关系。现报告如下。
1 资料与方法
1.1 数据下载与资料提取 从美国国家癌症研究所基因组数据共享中心(https://portal.gdc.cancer.gov/)下载HCC样本和正常对照样本的RNA-seq转录组数据,筛选其FPKM格式数据。同时,收集HCC样本的临床病理资料。排除性别、年龄、WHO病理分期、病理分级等临床病理资料不完整样本。
1.2 筛选m6A RNA甲基化调节因子 十三种m6A相关基因被认为是m6A RNA甲基化调节因子[5],并且在胶质瘤中被证实[6],但在HCC中尚未被证实。从RNA-seq转录组数据中获取十三种m6A RNA甲基化调节因子表达数据,比较HCC样本和正常对照样本m6A RNA甲基化调节因子表达。
1.3 十三种m6A RNA甲基化调节因子的相互作用 应用STRING数据库构建十三种m6A RNA甲基化调节因子的蛋白质—蛋白质相互作用(PPI)网络,并用R软件中的“corrplot”包分析其相关性。
1.4 预后相关基因筛选 应用R软件中的“survival”包对TCGA数据进行单因素Cox回归分析,筛选与预后相关的基因。应用R软件中的“survival”和“glmnet”包,对筛选的预后相关基因进行Lasso Cox回归分析,进一步明确与预后相关的基因。同时,根据这些预后相关的基因构建HCC预后风险模型。
1.5 基于m6A RNA甲基化调节因子的风险评估 根据m6A RNA甲基化调节因子表达情况,以Lasso Cox回归风险评分为分界值,将HCC患者分为高危者与低危者,比较二者总生存期(OS)。采用受试者工作特征(ROC)曲线[7]检验风险模型的预测效能。采用单因素和多因素Cox回归模型分析风险模型与HCC预后的关系。
2 结果
2.1 HCC样本与正常对照样本十三种m6A RNA甲基化调节因子表达比较 本研究共收集HCC样本374例份、正常对照样本50例份。结果发现,HCC样本FTO、YTHDC2、YTHDC1、ALKBH5、KIAA1429、METTL3、HNRNPC、YTHDF2、RBM15、YTHDF1、WTAP表达均高于正常对照样本(P均<0.01),而两样本METTL14、ZC3H13表达比较差异均无统计学意义(P均>0.05)。见图1。
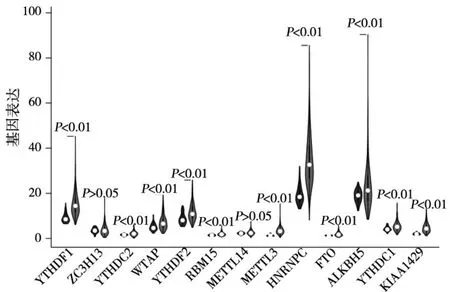
图1 HCC样本与正常对照样本十三种m6A RNA甲基化调节因子表达的小提琴图
2.2 m6A RNA甲基化调节因子的PPI网络及其相关性分析 十三种m6A RNA甲基化调节因子在HCC的PPI网络中,除RBM15与ZC3H13、ZC3H13与KIAA1429外,6个“编写器”之间存在密切而复杂的相互关系;5个“阅读器”之间的交互较少,但仍能观察到它们之间存在一定相互关系;2个“擦除器”亦存在相互关系。在十三种m6A RNA甲基化调节因子的相互作用中,以METTL13与HNRNPC的相关性最强。见图2、3。
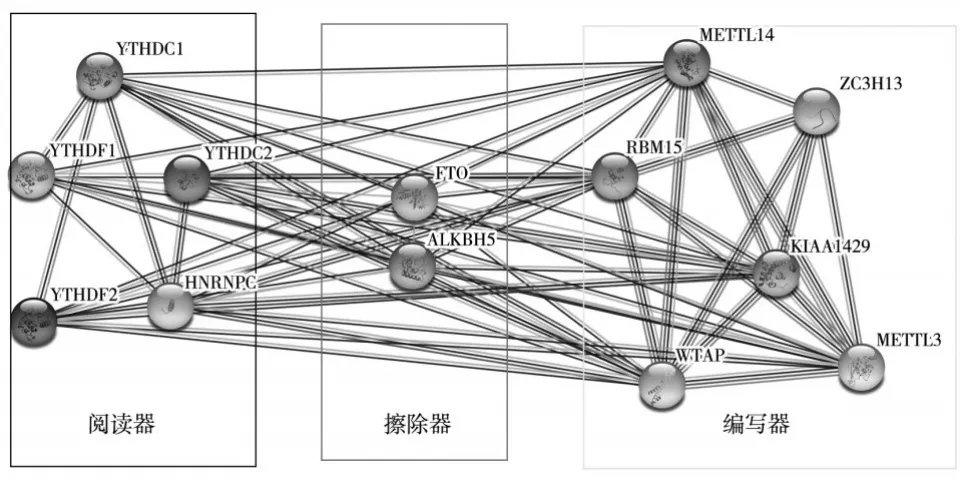
图2 十三种m6A RNA甲基化调节因子的PPI网络
2.3 HCC预后相关基因筛选 单因素Cox回归分析 显 示,YTHDF1、ZC3H13、WTAP、YTHDF2、RBM15、METTL3、HNRNPC、YTHDC1、KIAA1429等九种m6A RNA甲基化调节因子可能与HCC患者OS有 关(P均<0.05),而YTHDC2、METTL14、FTO、ALKBH5等四种m6A RNA甲基化调节因子可能与HCC患者OS无关(P均>0.05)。Lasso Cox回归分析显 示,YTHDF1、ZC3H13、YTHDF2、METTL3、KIAA1429等五种m6A RNA甲基化调节因子是影响HCC预后的危险因素(P均<0.05)。Kaplan-Meier生存分析显示,ZC3H13高表达者预后良好,而YTHDF1、YTHDF2、METTL3、KIAA1429高表达者预后较差,见图4。
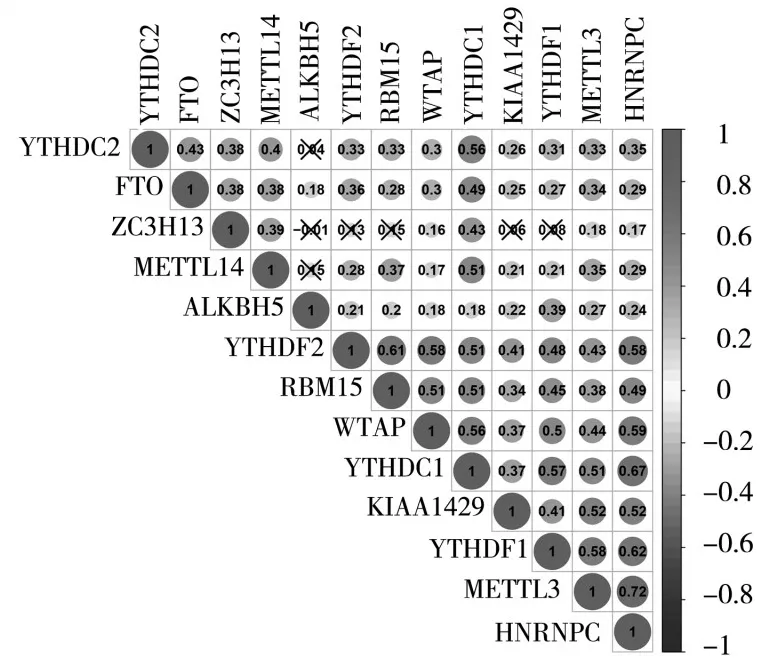
图3 十三种m6A RNA甲基化调节因子的相互关系

图4 五种m6A RNA甲基化调节因子的Kaplan-Meier生存曲线
2.4 m6A RNA甲基化调节因子对HCC预后评估的价值 根据YTHDF1、ZC3H13、YTHDF2、METTL3、KIAA1429等五种m6A RNA甲基化调节因子构建HCC预后风险模型,以Lasso Cox回归风险评分作为分界值,将HCC患者分为高风险者与低风险者。结果发现,高风险者5年生存率为40%,低风险者为56%,高风险者5年生存率明显低于低风险者(P<0.05),见图5。绘制风险模型预测HCC预后的ROC曲线,结果发现,该风险模型的ROC曲线下面积为0.619,提示该风险模型预测HCC预后具有一定准确性,见图6。
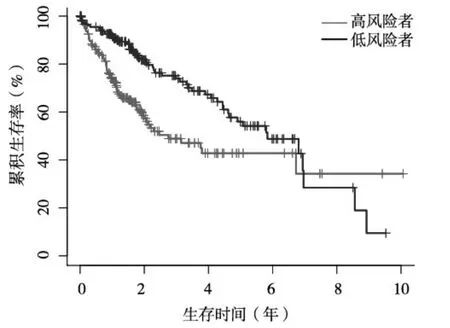
图5 高风险者与低风险者Kaplan-Meier生存曲线
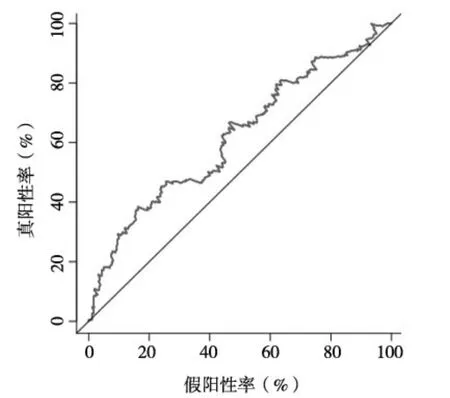
图6 风险模型预测HCC预后的ROC曲线
2.5 影响HCC预后的危险因素分析 单因素Cox回归分析显示,WHO病理分期、T分期和风险模型评分可能与HCC预后有关(P均<0.05)。多因素Cox回归分析显示,风险模型评分是影响HCC预后的独立危险因素(P<0.01)。见表1、2。
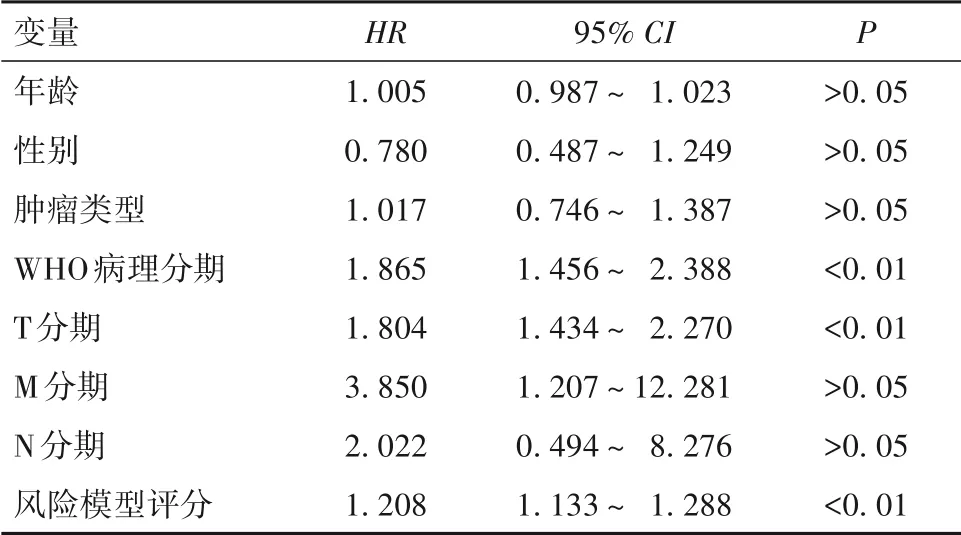
表1 HCC预后相关因素的单因素Cox回归分析结果
3 讨论
肝癌是全球第六大常见恶性肿瘤,具有高发病率、高转移率、高复发率和高病死率的特征。目前,肝癌的确切发病机制尚不完全清楚,除受环境和饮食影响外,还与遗传、基因表达、宿主免疫状态等因素有关[8],其发病是一个多步骤、多因素参与的复杂生物学过程。迄今为止,临床仍缺乏对肝癌的有效治疗手段。因此,深入探索肝癌的发病机制,对其早期诊断、靶向治疗和预后评估具有重要意义。
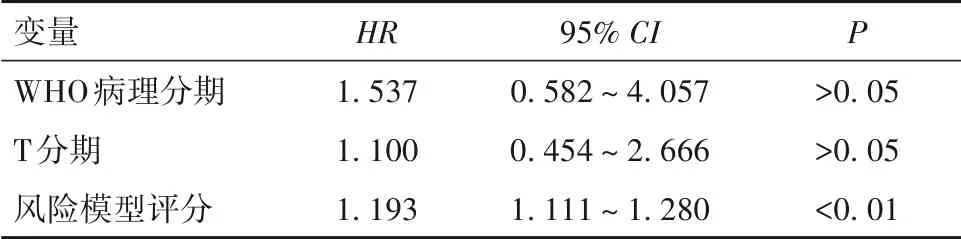
表2 HCC预后相关因素的多因素Cox回归分析结果
m6A是真核生物mRNA中含量最丰富的甲基化修饰形式[2-3]。有研究报道,m6A RNA甲基化调节因子在恶性肿瘤的发生、发展过程中具有重要作用[9]。CHEN等[10]研究发现,m6A RNA甲基化调节因子异常表达与肝癌的发生、发展有关。m6A甲基化水平与细胞内“编写器”、“擦除器”和“阅读器”表达密切相关。本研究选择了十三种m6A相关基因[5],进一步分析了这些m6A RNA甲基化调节因子在HCC中的表达,结果发现除METTL14、ZC3H13外,HCC样本FTO、YTHDC2、YTHDC1、ALKBH5、KIAA1429、METTL3、HNRNPC、YTHDF2、RBM15、YTHDF1、WTAP表达均高于正常对照样本。在PPI网络中发现,除RBM15与ZC3H13、ZC3H13与KIAA1429外,6个“编写器”之间存在密切而复杂的相互关系;5个“阅读器”(HNRNPC、YTHDC2、YTHDC1、YTHDF1和YTHDF2)之间的交互较少,但仍能观察到它们之间存在一定相互关系;2个“擦除器”(FTO和ALKBH5)亦存在相互关系。在这十三种m6A RNA甲基化调节因子的相互作用中,以METTL13与HNRNPC的相关性最强。对这十三种m6A RNA甲基化调节因子进行单因素Cox回归分析发现,YTHDF1、ZC3H13、WTAP、YTHDF2、RBM15、METTL3、HNRNPC、YTHDC1、KIAA1429等九种m6A RNA甲基化调节因子可能与HCC患者OS有关,而YTHDC2、METTL14、FTO、ALKBH5等四种m6A RNA甲基化调节因子可能与HCC患者OS无关。Lasso Cox回归分析发现,YTHDF1、ZC3H13、YTHDF2、METTL3、KIAA1429等五种m6A RNA甲基化调节因子是影响HCC预后的危险因素。Kaplan-Meier生存分析发现,ZC3H13高表达者预后良好,而YTHDF1、YTHDF2、METTL3、KIAA1429高表达者预后较差。本研究进一步选择与预后有关的这五种m6A RNA甲基化调节因子构建了HCC预后评估风险模型,以Lasso Cox回归风险评分作为分界值,将HCC患者分为高风险者与低风险者,高风险者5年生存率明显低于低风险者;绘制该风险模型预测HCC预后的ROC曲线,结果发现,该风险模型预测HCC预后的ROC曲线下面积为0.619,提示该风险模型对HCC预后具有较为可靠的预测价值。ZC3H13是一种经典的CCCH锌指蛋白,定位于人染色体13q14.1。ZHU等[11]研究发现,ZC3H13可通过调控K-Ras、ERK信号表达,抑制大肠癌细胞增殖和侵袭。本研究结果显示,ZC3H13在低风险者中高表达,提示ZC3H13在HCC中可能发挥抑癌基因作用。ZHAO等[12]研究发现,YTHDF1在肝癌组织中高表达,且与患者预后不良显著相关。YTHDF2的主要作用是调节m6A修饰的mRNA降解。最近研究发现,YTHDF2与HCC恶性程度密切相关[13]。本研究结果发现,YTHDF1、YTHDF2在HCC样本和高风险者中高表达,并且与患者预后不良显著相关,提示YTHDF1、YTHDF2在HCC中可能发挥癌基因作用。有研究证实,METTL3介导的m6A修饰能够参与多种恶性肿瘤的发生、发展[14]。KIAA1429可通过调节ID2 mRNA甲基化水平,促进肝癌细胞增殖、侵袭和迁移[15]。有研究报道,KIAA1429在精原细胞瘤[16]和乳腺癌[17]中高表达。本研究结果发现,METTL3、KIAA1429在HCC样本和高风险者中高表达,并且与患者预后不良有关,提示METTL3、KIAA1429在HCC中可能发挥癌基因作用。但由于肿瘤存在异质性,m6A RNA甲基化调节因子在不同肿瘤中的表达及其作用不同。因此,m6A RNA甲基化调节因子的致癌机制还存在争议。综上所述,m6A RNA甲基化调节因子表达与HCC预后密切相关,有可能作为肿瘤诊断的分子标志物和潜在的治疗靶点。但由于本研究对照样本相对较少,HCC样本的某些重要临床病理特征无法直接从TCGA数据库中获得,未来尚需大量临床研究进一步验证。

