miR-363-3p对非小细胞肺癌细胞迁移与侵袭能力的影响
殷玉,王亚红,许志亮,刘刚
1 广东医科大学附属医院呼吸内科,524000;2 广东医科大学附属医院临床研究中心
大多数支气管肺癌患者是非小细胞肺癌(NSCLC),患者被诊断为NSCLC 时通常为疾病晚期,肿瘤细胞已经发生淋巴结及其他器官的转移,患者5 年生存率仅为14%[1-2]。研究显示,未发生转移的NSCLC 患者5 年生存率可达83%[3]。因此,肿瘤细胞是否发生转移对于NSCLC 患者的预后至关重要。肺癌生物标志物的鉴定有助于NSCLC 的早期诊断、治疗以及预后判断。越来越多的研究证明,微小RNA(miRNA)参与调控细胞分化、增殖和存活的各种信号通路,在多种类型的肿瘤细胞中表达异常。研究发现,miR-363-3p 参与调控胆囊癌[4]、胃癌[5-6]和胶质瘤[7]等多种肿瘤细胞的迁移与侵袭。但目前关于miR-363-3p 在发生淋巴结转移的NSCLC组织及细胞中的表达变化,以及是否对高转移性的NSCLC 细胞迁移与侵袭有直接调控作用尚不明了[8-9]。为此,我们于2020 年1 月—2021 年6 月进行了如下研究。
1 材料与方法
1.1 材料 细胞:人NSCLC 细胞株A549 及高转移性NSCLC 细胞株H441 均购自美国ATCC。主要试剂:TRIzol 试剂、细胞培养基、胎牛血清、Lipofectamine 2000 转染试剂盒均购自美国Invitrogen 公司,miRcute miRNA First-Strand cDNA Syntnesis Kit反转录试剂盒、Real-time PCR 试剂均购自北京天根生物科技有限公司,蛋白提取试剂盒购自上海碧云天生物科技有限公司,GAPDH 抗体购自上海生工生物工程科技有限公司,E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶9(MMP-9)、基质金属蛋白酶3(MMP-3)抗体均购自美国Cell Signaling Technology 公司,细胞迁移测试盒购自美国BD 公 司。miR-363-3p mimics 和miR-363-3p inhibitor由上海吉玛制药技术有限公司设计合成。
1.2 发生和未发生淋巴结转移的NSCLC 组织miR-363-3p 表达检测 采用实时荧光定量PCR 法。选取2013年1月—2014年3月广东医科大学附属医院保存的、发生和未发生淋巴结转移的NSCLC 组织样本各26、21 例份。加入组织裂解液,使用TRIzol 试剂提取总RNA,并使用miRcute miRNA First-Strand cDNA Syntnesis Kit 反转录试剂盒合成cDNA。以GAPDH为内参,进行PCR反应。miR-363-3p引物序列:上 游 引 物5′-TGGGGTGAGAGGTGATAGAGG-3′,下 游 引 物5′-CGGCGTCTGCTGAACAAATAC-3′;U6 引物序列:上游引物5′-CTCGGTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。 PCR 反应体系10 μL:1×SYBR Premix Ex Taq™Ⅱ5.0 μL,上、下游引物各0.4 μL,DNA 模板1.0 μL,灭菌蒸馏水(dH2O)3.2 μL。PCR 反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40 个循环。采用2-ΔΔCt法计算miR-363-3p 相对表达量。
1.3 A549、H441 细胞miR-363-3p 表达检测 将A549、H441 置于含10% 胎牛血清的低糖DMEM 中,37 °C、5% CO2培养箱中培养。使用TRIzol试剂提取细胞总RNA,并使用miRcute miRNA First-Strand cDNA Syntnesis Kit反转录试剂盒合成cDNA。以U6为内参,参照1.2 采用实时荧光定量PCR 法检测miR-363-3p相对表达量。
1.4 H441 细胞分组处理 将对数生长期的H441细胞接种于培养皿中,待细胞生长密度达70% 时分为三组,即对照组、miR-363-3p mimics 组、miR-363-3p inhibitor 组,分别使用Lipofectamine 2000 转染试剂盒转染对照miRNA、miR-363-3p mimics、miR-363-3p inhibitor。转染6 h,细胞换液继续培养24 h。
1.5 H441 细胞迁移或侵袭能力观察 采用Transwell 法。取三组细胞,以2×104接种于聚碳酸酯Transwell 小室中(侵袭实验需使用基质胶预处理Transwell 小室),在下室添加含10% 胎牛血清的培养基作为化学引诱剂,37 ℃、5% CO2细胞培养箱中孵育24 h。用棉签从上孔中擦除非侵入细胞,70%乙醇固定侵入细胞30 min,0.2% 结晶紫染色10~30 min。随机选择5个视野,在倒置光学显微镜下对穿过小室的细胞进行计数,取平均值,计算迁移或侵袭细胞数。
1.6 H441 细胞E-cadherin、Vimentin、MMP-9、MMP-3 蛋白表达检测 采用Western blotting 法。收集各组细胞,PBS 冲洗后,加入裂解液冰上裂解30 min,超声破碎细胞,低温离心后收集上清蛋白。采用BCA 法测定蛋白浓度,制备蛋白样品上样,进行十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制及电泳;PVDF 转膜,室温条件下脱脂牛奶封 闭1 h,洗 涤2 次。 加 入E-cadherin、Vimentin、MMP-9、MMP-3 及内参GAPDH 一抗(稀释比例为1∶1 000),4 ℃摇床过夜孵育;洗膜后加入二抗(稀释比例为1∶5 000),室温孵育1 h。洗涤3 次,拍照显影,Image J软件分析条带灰度值,以目的蛋白与内参蛋白条带灰度值的比值计算目的蛋白相对表达量。
1.7 统计学方法 采用GraphPad Prism 5统计软件。计量资料以±s表示,多组间比较采用方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 发生和未发生淋巴结转移的NSCLC 组织miR-363-3p 表达比较 发生和未发生淋巴结转移的NSCLC 组织miR-363-3p 相对表达量分别为1.091 ±0.153、0.128 ± 0.336,二者比较P<0.01。
2.2 A549、H441 细 胞miR-363-3p 表 达 比 较A549、H441 细 胞miR-363-3p 相 对 表 达 量 分 别 为1.02 ± 0.039、31.45 ± 1.158,二者比较P<0.01。
2.3 三组细胞迁移和侵袭能力比较 miR-363-3p inhibitor 组、对照组、miR-363-3p mimics 组迁移细胞数、侵袭细胞数均依次升高,两组间比较P均<0.05。见表1。
表1 三组迁移细胞数、侵袭细胞数比较(个,± s s)
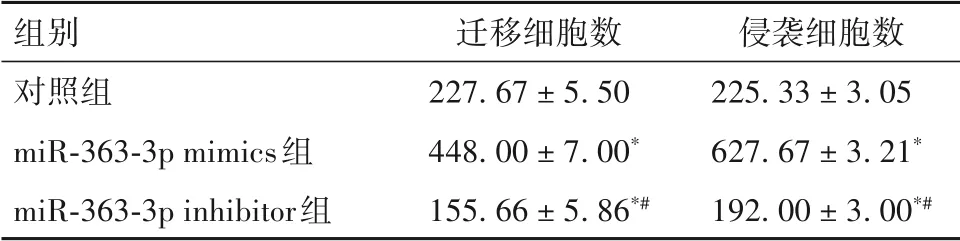
表1 三组迁移细胞数、侵袭细胞数比较(个,± s s)
注:与对照组比较,*P<0.05;与miR-363-3p mimics 组比较,#P<0.05。
组别对照组miR-363-3p mimics组miR-363-3p inhibitor组迁移细胞数227.67 ± 5.50 448.00 ± 7.00*155.66 ± 5.86*#侵袭细胞数225.33 ± 3.05 627.67 ± 3.21*192.00 ± 3.00*#
2.4 三组细胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白表达比较 miR-363-3p inhibitor 组、对照组、miR-363-3p mimics组Vimentin、MMP-9、MMP-3蛋白相对表达量均依次升高、E-cadherin蛋白相对表达量依次降低,两组间比较P均<0.05。见表2、图1。
表2 三组细胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白相对表达量比较(± s s)

表2 三组细胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白相对表达量比较(± s s)
注:与对照组比较,*P<0.05;与miR-363-3p mimics组比较,#P<0.05。
组别对照组miR-363-3p mimics组miR-363-3p inhibitor组E-cadherin 1.00 ± 0.06 0.33 ± 0.08*1.34 ± 0.05*#Vimentin 1.00 ± 0.07 4.01 ± 0.04*0.93 ± 0.03*#MMP-9 1.00 ± 0.03 3.45 ± 0.04*0.84 ± 0.07*#MMP-3 1.00 ± 0.05 1.51 ± 0.06*0.85 ± 0.03*#

图1 三组细胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白表达条带图(Western blotting法)
3 讨论
肿瘤细胞迁移和侵袭能力升高是肿瘤转移及病情恶化的重要机制之一。研究表明,miR-363-3p 在胃癌中与LINC00858 存在相互作用,并靶向叉头盒P4 蛋白(FOXP4),进而调控细胞增殖、迁移和侵袭[5]。同样的,miR-363-3p 可靶向FEZF1-AS1 基因,通过FEZF1-AS1/miR-363-3p/HMGA2 轴在胃癌进展中发挥关键调控作用[6]。在肾细胞癌中,lncRNA SNHG5 与miR-363-3p-Twist1 的直接相互作用可调控细胞侵袭和凋亡过程[11]。在胶质瘤中,miR-363-3p通过靶向丙酮酸脱氢酶B(PDHB)的表达,参与调节细胞生长、凋亡和侵袭,最终介导肿瘤转移[7]。另外,miR-363-3p 可通过介导SNAI2/CDH1 轴在体外促进胃肠道间质瘤细胞的转移[12]。以上研究提示,miR-363-3p 在不同肿瘤的转移中均具有重要作用。然而,miR-363-3p 在NSCLC 细胞转移中的作用还尚未明确。
本课题组早期研究结果显示,miR-363-3p 表达水平与NSCLC 患者淋巴结转移情况呈正相关关系[9]。此外,本课题组还证实了miR-363-3p 通过靶向PCNA 调控NSCLC 增殖[8-10]。以上说明,miR-363-3p 表达可能与肺癌细胞的转移和侵袭能力密切相关。 本研究发现,发生淋巴结转移的NSCLC 组织miR-363-3p 相对表达量明显高于未发生淋巴结转移的NSCLC 组织,高转移性H441 细胞中的miR-363-3p 相对表达量明显高于A549 细胞;提示miR-363-3p 可能参与了NSCLC 细胞的迁移与侵袭,但其是否直接参与调控NSCLC 的转移还有待进一步证实。
E-cadherin 主要介导细胞间的黏附,其表达下降会使细胞间黏附能力降低,更加有利于肿瘤细胞向细胞基质外扩散。Vimentin 与癌细胞的强侵袭性和易转移性密切相关,Vimentin 表达升高提示细胞迁移能力增强[13]。基质金属蛋白酶(MMPs)对细胞外基质重塑、伤口愈合和血管生成至关重要,MMPs是基质相关蛋白,可通过直接切割或从细胞外基质结合体中释放[14]。MMP-3 通过激活Ⅱ型肺泡上皮细胞中的Wnt/β-catenin 信号通路,增加裂解肺上皮细胞中的E-cadherin 活性,从而诱导上皮间质转化[14]。以MMPs 为代表的降解细胞外基质蛋白酶广泛参与到肿瘤细胞侵袭转移过程中,MMP-9 在ECM重塑和膜蛋白切割中起重要作用[15]。研究显示,MMP-9 在肿瘤侵袭、转移、血管生成以及介导肿瘤微环境中均发挥作用[16-17]。同时,MMP-9 是NSCLC诊断的潜在生物标志物[18]。目前大量研究表明,MMP-9、MMP-3 与肿瘤细胞的侵袭性有关[18-20]。本研究结果显示,过表达miR-363-3p 可促进H441 细胞的迁移和侵袭,同时能够显著抑制E-cadherin 表达和促进Vimentin、MMP-3、MMP-9表达。
综上所述,miR-363-3p 可能通过升高Vimentin、MMP-9、MMP-3 蛋白表达及降低E-cadherin 蛋白表达而促进NSCLC 细胞的迁移和侵袭。本研究为肺癌转移的发病机制和靶向治疗提供了科学依据,但是miR-363-3p 在调控NSCLC 细胞迁移与侵袭进程中的靶向基因及具体的分子机制还需进一步研究证实。

