γ-谷氨酰转移酶水平对代谢综合征早期预测意义
巫迪昀 陈艳红 唐剑辉
心脑血管疾病、恶性肿瘤、慢性呼吸道疾病和糖尿病为主的慢性病是人类健康的最大杀手,2012 年,中国居民慢性病死亡占总死亡人数的86.6%[1]。不健康的饮食、生活方式,导致与慢性病死亡率密切相关的肥胖、高血压、高血糖、血脂异常等代谢因素在人群中快速增长。MS 是这些代谢因素的集合,MS 患者同时也是慢性病的高危人群,因此,加强MS 的防治工作,能有效预防心脑血管疾病和糖尿病等慢性病的发生。单个MS 组分(包括肥胖、血压升高、血糖升高、TG 升高、HDL-C 降低)异常,往往预示着发生MS 的风险。许多研究发现,一些不包含在MS 组分内的危险因素也与MS 密切相关,例如血清GGT 水平,可能是MS 的独立预测因子[2]。本研究利用本院健康体检人群的体检数据,构建历史回顾队列,分析GGT 初始水平以及纵向变化水平与MS 的关联性,为MS 的早期诊断提供理论依据。
1 资料与方法
1.1 一般资料 选择2012 年1 月~2019 年12 月在本院1305 例至少进行过2 次健康体检者纳入历史回顾队列,其中男938 例,女367 例,年龄最小18 岁,最大82 岁,平均年龄(31.25±16.92)岁,平均随访时间3.89 年。排除标准:首次体检发现MS 者,为最大限度的减少未被识别的肝病和大量嗜酒病史样本;肝酶大于2 倍正常值(ALT>80 U/L,AST>80 U/L,GGT>100 U/L)者;肝硬化、慢性病毒性肝炎和临床资料不全者。以体检者首次体检资料为基线数据,后续的体检资料为随访数据,随访发生MS 为观察终点,随访观察终止时间为2019 年12 月31 日。本研究获清远市人民医院医学伦理委员会审核批准。
1.2 调查方法 研究对象由本院健康管理科专业医师按标准方法测量身高、腰围、体质量、血压等。抽取清晨空腹(禁食8 h)血用于检测FPG、TG、HDL-C、ALT、AST 和GGT。由专业超声医师进行腹部超声检查,采用统一的影像学诊断标准对脂肪肝进行诊断。
1.3 脂肪肝的诊断标准 经腹部超声检查具备以下异常表现2 项以上者可诊断为脂肪肝:①肝脏近场回声增强,远场回声减弱;②肝脏实质回声致密,强于肾脏实质;③肝内血管和胆道结构显示不清[3]。
1.4 MS 的诊断标准 参照2009 年美国心脏协会(AHA)/美国国立心肺血管病学研究所(NHLB)与IDF、世界心脏联盟、国际肥胖研究协会和国际动脉粥样硬化协会发表的联合声明,即国际多学会联合声明(JIS)标准[4],当以下的5 个标准中有3 个以上的标准符合,则判断为MS 患者:①腹型肥胖:腰围男性≥85 cm,女性≥80 cm;②高血糖:FPG≥5.6 mmol/L,或有糖尿病史而接受治疗;③高血压:SBP≥130 mm Hg(1 mm Hg=0.133 kPa)或DBP≥85 mm Hg,及(或)确认为高血压并治疗者;④空腹TG≥1.7 mmol/L;⑤空腹HDL-C 男性<1.0 mmol/L,女性<1.3 mmol/L。
1.5 观察指标 分析 GGT 四分位数队列人群基线特征、不同GGT 基线和变化水平的MS 累积发病率与发病密度、GGT 基线和变化水平与MS 的关联。
1.6 统计学方法 采用SPSS19.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示,采用F检验;计数资料以率(%)表示,采用χ2检验;用累积发病率和发病密度来描述MS 结局的发生情况,对不同组发病密度的比较使用非参数的log-rank 检验;使用拟合Cox 比例风险模型来估计GGT 水平与MS 发生关联的相对风险比(HR)和95%可信区间(95%CI)。P<0.05为差异有统计学意义。
2 结果
2.1 GGT 四分位数队列人群基线特征 根据基线GGT 水平将研究对象按四分位数分为四组,记为Q1、Q2、Q3、Q4,其中女性GGT 所对应的四分位数切割点为11、14、17 U/L,男性为18、24、33 U/L。四组脂肪肝患病率、年龄、BMI、腰围、收缩压、舒张压、FPG、TG、HDL-C、ALT、AST 比较,差异具有统计学意义(P<0.05)。见表1。
表1 GGT 四分位数队列人群基线特征[n(%),±s]
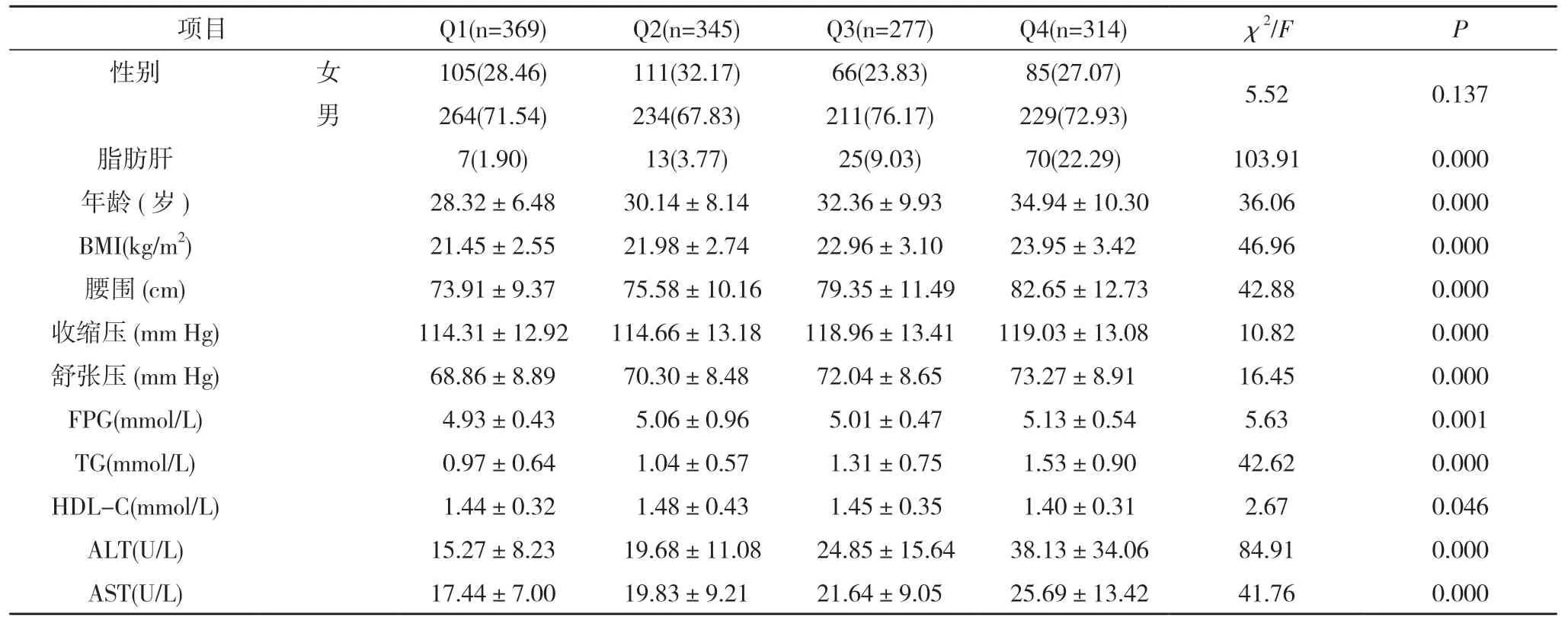
表1 GGT 四分位数队列人群基线特征[n(%),±s]
2.2 不同GGT 基线和变化水平的MS 累积发病率与发病密度 平均随访时间3.89 年,共计随访5052 人年,1305 例研究对象中有289 例(22.15%)发生MS,发病密度57.21/千人年。见表2。根据纵向GGT 变化水平将研究对象按四分位数分为四组,记为q1、q2、q3、q4,GGT 变化水平所对应的四分位数切割点为-2、1、6 U/L,通过log-rank 检验,GGT 基线队列、变化队列的四组发病密度组间比较,差异均具有统计学意义(χ2=91.65、43.38,P<0.05)。
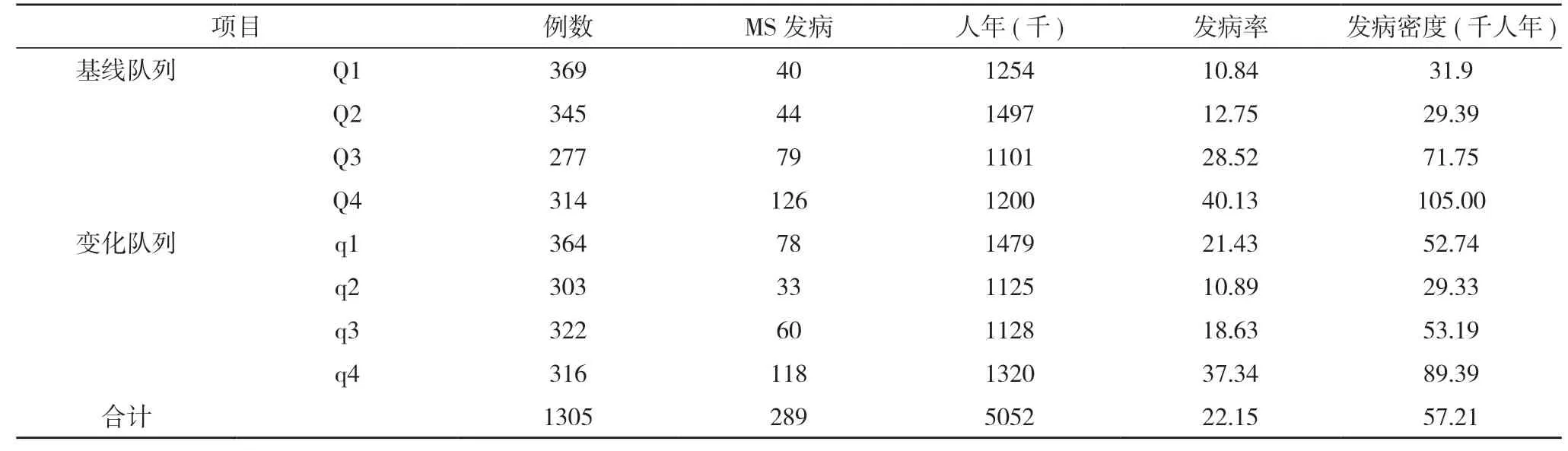
表2 不同GGT 基线和变化水平的MS 累积发病率与发病密度 (n,%)
2.3 GGT 基线和变化水平与MS 的关联 根据基线GGT 水平将研究人群按中位数分为GGT 低水平组和高水平组,女性对应的中位数切割点为14 U/L,男性为24 U/L。低水平组中GGT 纵向相对基线不变或减少者记为V1 组(280 例),增加者记为V2 组(434 例),高水平组中GGT 纵向相对基线不变或减少者记为V3 组(296 例),增加者记为V4 组(295 例)。三种不同条件下分组的队列(包括Q1-Q4,q1-q4,V1-V4),分别拟合Cox 比例风险模型,使用的模型有:模型1:未调整混杂因素的粗模型;模型2:包括年龄(分组变量)和性别;模型3:在模型2 基础上加入了是否患有脂肪肝。无论在何种模型下,GGT 基线队列、变化队列最高四分位数组与最低四分位数组相比,MS 发病风险显著提高,差异均具有统计学意义(P<0.05)。在分层队列分析中,GGT 高初始水平下随时间增加者,MS 发病风险显著高于GGT 低初始水平下随时间不变或减少者,差异具有统计学意义(P<0.05)。见表3。
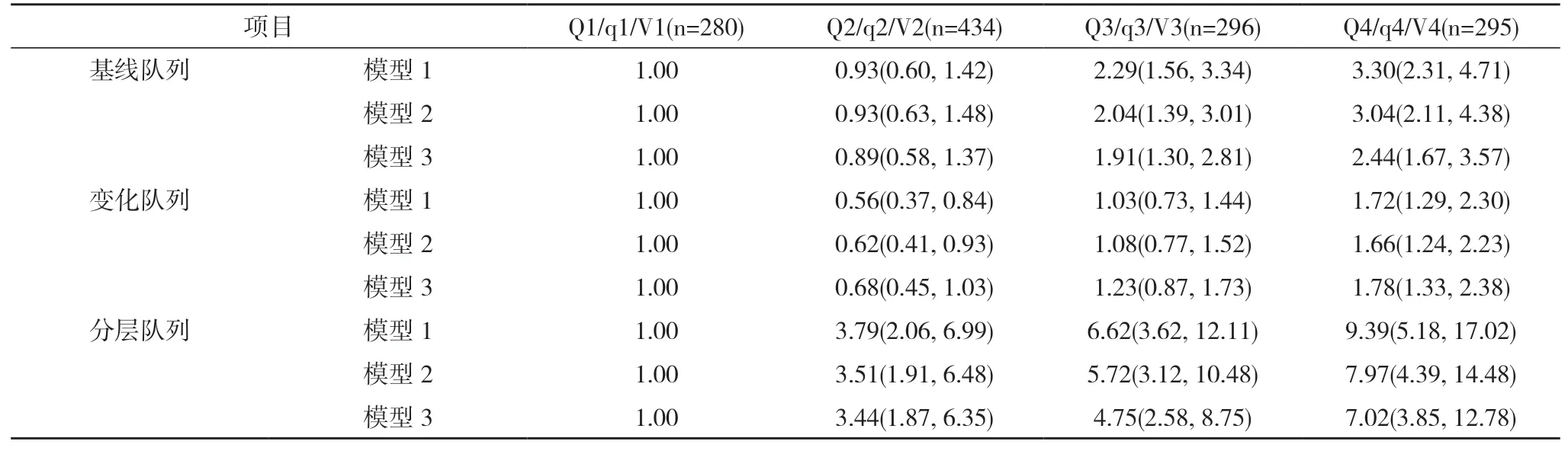
表3 GGT 基线和变化水平与MS 的关联[HR(95%CI)]
3 讨论
GGT 位于大多数细胞的表面,介导谷胱甘肽的摄取,是细胞内氧化防御的重要组成部分,在维持细胞内谷胱甘肽转运方面起着关键的作用,通常也被用作过量饮酒或肝脏疾病的标志。近年来,越来越多的研究表明,GGT 与肥胖、非酒精性脂肪性肝病、胰岛素抵抗、糖尿病、高血压、血脂异常等密切相关[5],因此,有学者认为,GGT 水平对MS 的评估与预测有着重要的意义[6,7]。
本研究对平均随访时间3.89 年,共计随访5052 人年,1305 例研究对象中有289 例(22.15%)发生MS,发病密度57.21/千人年。最高和次高四分位组的发病率与发病密度均高于最低四分位组,在调整了年龄、性别以及初始是否患有脂肪肝等混杂因素后,GGT 最高水平分组的MS 发病风险为2.44。因此,可以得出第一个结论,不同GGT 基线水平的人群MS 的患病率存在差异,基线水平高的人群患MS 的风险明显高于基线水平低的人群。
在进行GGT 水平纵向变化对MS 发生的影响研究时发现,即使GGT 水平增长最高组与最低水平组相比,增长最高组的MS 发病风险为1.78,但是增长最低水平组与次低、次高水平组相比,并无显著的差异,考虑原因为增长最低水平组为变化<-2 U/L,实际为负增长,为数不少的高基线水平出现了负增长,而GGT 基数水平高的人群MS 发病风险更高,因此这成为了研究的干扰因素。为了排除这一干扰,本研究根据基线GGT 水平中位数对参与者进行分层,再分为四组,包括,基线低水平GGT 纵向相对基线不变或减少组和增加组,基线高水平GGT 纵向相对基线不变或减少组和增加组。通过拟合Cox 比例风险模型发现,同基线水平组下,GGT 水平随时间的升高,MS 的发病风险也随之增加。因此,得出第二个结论,在GGT 初始水平相近的情况下,GGT 水平纵向升高的人群,MS 患病风险高于GGT水平减少或不变的人群。
虽然在队列研究中发现了GGT 水平与MS 发生的因果关系,但是并没有研究能够明确的阐明两者间的关联机制。有学者认为,GGT 水平的升高,造成过量的谷胱甘肽向细胞内转运以及谷胱甘肽代谢,是氧化应激的原因,而许多证据表明,氧化应激在MS 的发病机理中起着重要的作用[8]。也有通过与血清C 反应蛋白的相关性研究发现,血清GGT 与全身炎症相关,而亚临床炎症也被认为是MS 的一种发生机制[9]。还有研究表明,GGT 是胰岛素抵抗的直接标志物,反映内脏脂肪沉积的程度,影响着MS 的发生发展[10]。因此推测,氧化应激、炎症和胰岛素抵抗在GGT 水平升高与MS 发生间有着重要的作用。
综上所述,血清GGT 初始水平的升高,以及随时间增长的升高,都可以导致MS 发生风险的增加,对MS 的早期预测有着重要的意义。

