miR-27a-3p 在氧糖缺失-复氧复糖损伤PC12 细胞中的表达及其对PC12细胞增殖、凋亡的影响
李俊杰,彭丽佳,罗靖,熊莉,邵建林
昆明医科大学第一附属医院麻醉科,昆明650000
缺血性脑卒中是目前常见和多发的神经系统疾病之一,有较高的致残、致死率[1]。脑缺血发生后最有效的治疗是通过溶栓或取栓,尽快恢复阻塞部位血管的再通,然而,脑血管再通、血流再灌注会引起某些部位缺血性脑组织的损伤或神经功能的进一步恶化,即发生脑缺血-再灌注损伤(CI-RI)[2]。CI-RI的机制较复杂,主要包括氧化应激、兴奋性毒性、细胞内钙离子超载等,而细胞凋亡被认为是再灌注损伤早期引起缺血区域神经细胞死亡的主要原因之一[3]。miRNAs是一种短链非编码的小RNA,在各器官、组织和细胞中均有表达,存在于中枢神经系统中。在CI-RI 过程中,miRNAs是神经元存活的重要调节因子[4-5]。近年研究表明,miR-27a-3p在黑色素瘤[6]、卵巢癌[7]、骨关节炎[8]等疾病中有调节细胞增殖和凋亡作用。然而,有关miR-27a-3p在CI-RI中的相关研究鲜见报道。本研究拟应用氧糖缺失-复氧复糖(OGD/R)损伤的PC12细胞模型,体外模拟CI-RI病理状态,观察miR-27a-3p在OGD/R损伤的PC12细胞中表达,探讨miR-27a-3p对OGD/R损伤PC12细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料 PC12 细胞细胞株购自中国科学院昆明动物研究所;DMEM高糖培养基购自美国HyClone公司;miR-27a-3p模拟物序列、miR-27a-3p模拟物阴性对照序列、miR-27a-3p 抑制剂序列和miR-27a-3p 抑制剂阴性对照序列由广州复能基因有限公司合成;Ploybrene 慢病毒购自上海吉凯基因科技有限公司;CCK-8试剂盒购自日本同仁化学研究所;MicroRNAs逆转录试剂盒和mRNA 逆转录试剂盒购自美国Genecopoeia公司;miR-27a-3p、Caspase-3、Bax、Bcl-2、U6 和β-actin 引物均由北京擎科生物科技有限公司合成;兔抗鼠Cleaved-Caspase-3抗体购自美国CST公司;兔抗鼠Bax、β-actin抗体购自美国Abcam公司;兔抗鼠Bcl-2 抗体购自美国GeneTex 公司;HRP 标记的山羊抗兔第二抗体购自美国Sigma公司;ECL化学发光显影液购自美国Thermo Fisher Scientific 公司;酶标仪购自美国BioTek 公司;CFX96 实时荧光定量PCR仪和凝胶成像仪购自美国Bio-Rad公司。
1.2 细胞培养和转染 PC12 细胞用含10%FBS 的DMEM 高糖培养基,以104/孔的密度接种于96 孔细胞培养板后培养3 d,每2 d 换液1 次,培养箱环境为95%空气+ 5% CO2,温度37 ℃。待细胞融合度为80%时利用Ploybrene 慢病毒,参照说明书对细胞进行慢病毒转染,将miR-27a-3p 模拟物(Mimic)、模拟物阴性对照、抑制剂(Inhibitor)和抑制剂阴性对照转染入细胞,转染24 h 后于荧光显微镜下观察细胞荧光,检测转染效率。
1.3 PC12 细胞 OGD/R 模型的制备 将 PC12 细胞用无糖培养基于37 ℃培养箱(95%N2+5%CO2)中培养(即氧糖缺失)2 h,之后将培养基更换为正常培养基,于37 ℃培养箱(95%空气+5%CO2)中继续培养(即复糖复氧),制备OGD/R模型。
1.4 细胞增殖检测 采用CCK-8 实验法。采用随机数字表法将PC12细胞分为6组,每组取6孔:正常对照组(Ctrl 组)、氧糖缺失-复氧复糖组(OGD/R组)、miR-27a-3p 模拟物组(Mimics 组)、miR-27a-3p模拟物阴性对照组(Ctrl-M 组)、miR-27a-3p 抑制剂组(Inhibitor 组)和miR-27a-3p 抑制剂阴性对照组(Ctrl-I 组)。Ctrl 组细胞进行正常培养;OGD/R 组分别于复氧复糖后 24 、48 、72 和 96 h 制备 OGD/R 模型;Mimics 组、Ctrl-M 组、Inhibitor 组和 Ctrl-I 组分别用加有Ploybrea 慢病毒感染细胞24 h 后进行miR-27a-3p的过表达、过表达阴性对照、抑制表达和抑制表达阴性对照后,再分别于复氧复糖后24、48、72 和96 h 制备OGD/R 模型。然后将各组细胞以2×103个/孔的密度接种到96孔板中,37 ℃培养过夜。次日,每孔加入预制的CCK-8溶液,37 ℃孵育1 h后,用酶标仪测量不同时间点各组细胞450 nm处的光密度值。
1.5 OGD/R 后不同时点miR-27a-3p 表达和各组细胞凋亡相关基因表达检测 采用RT-qPCR 法。采用随机数字表法将细胞分为Normal组、3 h组、6 h组和9 h 组,每组取6 孔。Normal 组细胞进行正常培养,3 h组、6 h组和9 h组进行2 h的氧糖缺失后分别复氧复糖3、6 和9 h 制备OGD/R 模型。分别测定各组相应时点miR-27a-3p 表达,并选择表达差异最大的时点作为后续研究的时点,并按照1.4 的分组和处理分别测定各组miR-27a-3p 和促凋亡基因Caspase-3、Bax 及抗凋亡基因 Bcl-2 的 mRNA 相对表达量。TRIzol 法提取细胞总RNA,-80 ℃冰箱保存备用 。 取 1 µg RNA 按 照 MicroRNAs 逆 转 录 试 剂盒、mRNA 逆转录试剂盒的说明书进行逆转录反应合成互补脱氧核糖核酸(cDNA),采用Sybrgreen 法,在CFX96 实时荧光定量PCR 仪进行扩增和检测。mRNA 逆转录体系:20 µL(Mix 1 µL,Buffer 4 µL,样品10 µL,ddH2O 5 µL);条件:25 ℃ 5 min,42 ℃ 45 min,85 ℃ 5 min。miRNA逆转录体系:20 µL(Mix 1 µL,polyA 1 µL,Buffer 5 µL,样品 10 µL,ddH2O 8 µL)。条件:37 ℃ 60 min,85 ℃ 5 min。引物序列:miR-27a-3p:正向引物:5'-TTCACAGTGGCTAAGTTCCGC-3',反向引物:5'-GCAGGGTCCGAGGTATTC-3';Caspase-3 正 向 引 物 :5'-TGAAAGACAAGCCCAAGGTTA-3',反向引物:5'-TGGTGTTGAAGAGCAGAAAGC-3';Bax 正 向 引 物 :5'-CCCGAGAGGTCTTTTTCCG-3',反向引物:5'-GCCTTGAGCACCAGTTTGC-3';Bcl-2 正向引物:5'-GAGGGGCTACGAGTGGGAT-3',反向引物:5'-GGGCTGGGAGGAGAAGATG-3';U6 正向引物:5'-GCTCGCTTCGGCAGCACA-3',反向引物:5'-GAGGTATTCGCACCAGAGGA-3';β-actin 正向引物:5'-TGGCATCCACGAAACTACCTT-3',反向引物:5'-AGACAGCACTGTGTTGGCGTA-3'。PCR 反应条件:95 ℃ 10 min,95 ℃10 s、60 ℃ 20 s、72 ℃ 15 s 共循环 40 次,采集记录荧光。最后得到 S 形动力曲线,读取 Ct 值,用 2-ΔΔCt方法,与U6、β-actin 进行校正后计算出基因的相对表达量。
1.6 各组细胞凋亡相关蛋白表达检测 采用Western blotting 法。按照1.4 的分组,各组细胞中加入适量RIPA 裂解液,于冰上充分裂解后取上清,用BCA 法测定蛋白浓度。在SDS-PAGE 凝胶系统中电泳,进行转膜后,用5% 的脱脂奶粉封闭2 h后加入一抗 Cleaved-Caspase-3(浓度 1∶1 000)、Bax(浓度1∶1 000)、Bcl-2(浓度 1∶1 000),4 ℃过夜。TBST 洗膜后,加入二抗(浓度1∶5 000),室温孵育2 h,ECL 显影。于凝胶成像仪采集图像信息,用Image J 软件测得各蛋白的灰度值,与相应的β-actin 灰度值相比后分析得出各蛋白的相对表达量。
1.7 统计学方法 采用SPSS22.0 统计软件。计量资料符合正态分布以表示,不同组间比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-27a-3p在PC12细胞中OGD/R后不同时间点的表达 Normal 组、3 h 组、6 h 组和 9 h 组 miR-27a-3p 的相对表达量分别为 1.006 ± 0.140、0.449 ±0.025、0.306 ± 0.028、0.492 ± 0.027,与 Normal 组相比,miR-27a-3p的相对表达量在3 h组、6 h组和9 h组均降低(P均<0.05),组间比较,6 h 组相对表达量最低(P<0.05)。后续凋亡实验中选择OGD/R后6 h时点进行研究。
2.2 miR-27a-3p 对 OGD/R 损 伤 PC12 细 胞 增 殖 活性的影响 与Ctrl 组相比,复氧复糖后48、72 和96 h,OGD/R 组细胞的增殖活性均降低(P均<0.05);与 Mimics-Ctrl 组相比,24、48、72 和 96 h,Mimics 组细胞增殖活性均升高(P均<0.05);与 Inhibitor-Ctrl组相比,72和96 h时Inhibitor组细胞增殖活性均降低(P均<0.05)。见表1。
表1 各组PC12细胞增殖活性比较()
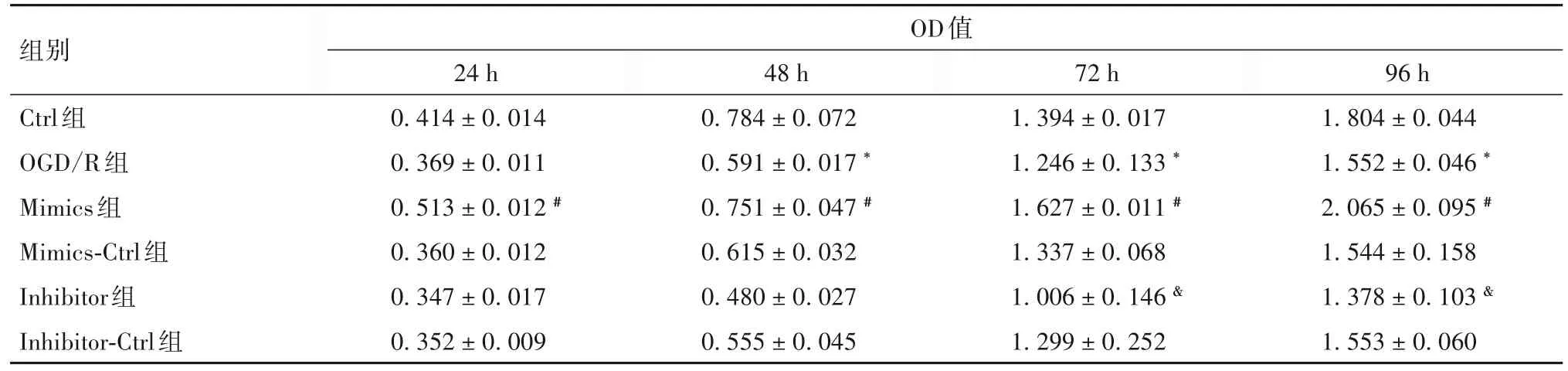
表1 各组PC12细胞增殖活性比较()
注:与Ctrl组相比,*P<0.05;与Mimics-Ctrl组相比,#P<0.05;与Inhibitor-Ctrl组相比,&P<0.05。
组别Ctrl组OGD/R组Mimics组Mimics-Ctrl组Inhibitor组Inhibitor-Ctrl组OD值96 h 1.804±0.044 1.552±0.046 *2.065±0.095 #1.544±0.158 1.378±0.103 &1.553±0.060 24 h 0.414±0.014 0.369±0.011 0.513±0.012 #0.360±0.012 0.347±0.017 0.352±0.009 48 h 0.784±0.072 0.591±0.017 *0.751±0.047 #0.615±0.032 0.480±0.027 0.555±0.045 72 h 1.394±0.017 1.246±0.133 *1.627±0.011 #1.337±0.068 1.006±0.146 &1.299±0.252
2.3 miR-27a-3p对OGD/R损伤PC12细胞凋亡相关因子表达的影响 与Ctrl组相比,OGD/R组miR-27a-3p 表达降低(P<0.05),促凋亡因子 Caspase-3、Bax的mRNA 和蛋白相对表达量均升高(P均<0.05)、抗凋亡因子Bcl-2表达量降低(P<0.05);与Mimics-Ctrl组相比,Mimics 组 miR-27a-3p 表达升高(P<0.05),Caspase-3、Bax 的mRNA 和蛋白相对表达量均降低(P均<0.05),Bcl-2 表达升高(P<0.05);与Inhibitor-Ctrl 组相比,Inhibitor 组 miR-27a-3p 表达降低(P<0.05),Caspase-3、Bax的mRNA和蛋白相对表达量均升高(P均<0.05),Bcl-2表达降低(P<0.05)。见表2、表3。
表2 各组细胞miR-27a-3p和凋亡相关因子mRNA相对表达量比较()
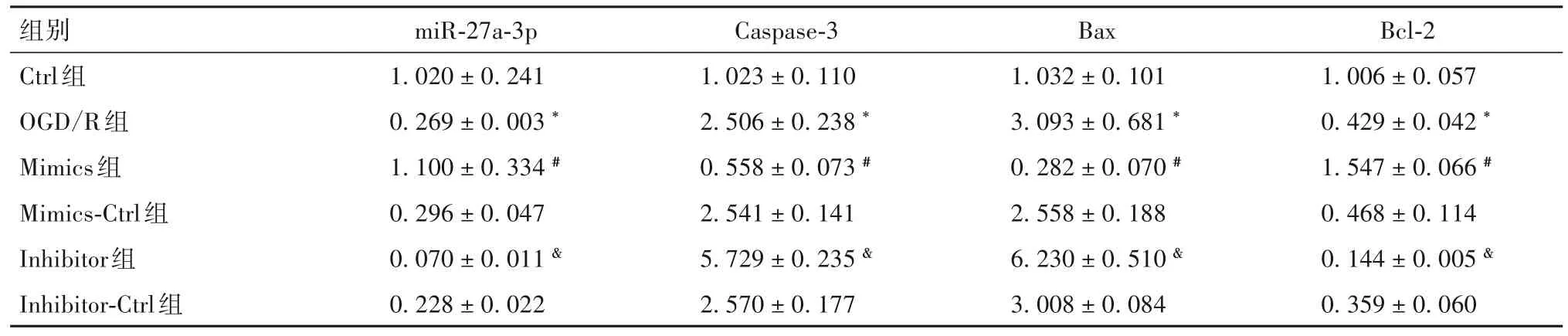
表2 各组细胞miR-27a-3p和凋亡相关因子mRNA相对表达量比较()
注:与Ctrl组相比,*P<0.05;与Mimics-Ctrl组相比,#P<0.05;与Inhibitor-Ctrl组相比,&P<0.05。
组别Ctrl组OGD/R组Mimics组Mimics-Ctrl组Inhibitor组Inhibitor-Ctrl组Bcl-2 1.006±0.057 0.429±0.042 *1.547±0.066 #0.468±0.114 0.144±0.005 &0.359±0.060 miR-27a-3p 1.020±0.241 0.269±0.003 *1.100±0.334 #0.296±0.047 0.070±0.011 &0.228±0.022 Caspase-3 1.023±0.110 2.506±0.238 *0.558±0.073 #2.541±0.141 5.729±0.235 &2.570±0.177 Bax 1.032±0.101 3.093±0.681 *0.282±0.070 #2.558±0.188 6.230±0.510 &3.008±0.084
表3 各组细胞miR-27a-3p和凋亡相关因子蛋白相对表达量比较()

表3 各组细胞miR-27a-3p和凋亡相关因子蛋白相对表达量比较()
注:与Ctrl组相比,*P<0.05;与Mimics-Ctrl组相比,#P<0.05;与Inhibitor-Ctrl组相比,&P<0.05。
组别Ctrl组OGD/R组Mimics组Mimics-Ctrl组Inhibitor组Inhibitor-Ctrl组Bcl-2 0.879 0±0.011 6 0.689 9±0.009 7 *1.229 0±0.007 4 #0.663 8±0.009 5 0.087 7±0.010 5 &0.289 7±0.010 0 Cleaved-Caspase-3 0.456 8±0.003 1 0.878 6±0.001 1 *0.010 0±0.000 0 #0.735 2±0.000 8 0.987 6±0.002 4 &0.558 3±0.000 3 Bax 0.489 2±0.002 3 1.327 3±0.000 3 *0.082 1±0.000 0 #1.295 5±0.000 5 2.287 4±0.008 6 &0.931 9±0.000 1
3 讨论
CI-RI是缺血性脑卒中较严重的一种病理损伤过程,其发生率和病死率较高,临床防治较难。miRNAs 是一类非编码的小分子RNA,其通过绑定3′非翻译区的靶标,导致mRNA 降解或翻译受阻来调节编码蛋白质的基因表达,近年研究发现,miRNAs 广泛参与神经系统疾病的各种病理过程,被认为是各种神经系统疾病潜在的治疗靶点之一[9]。miR-27a-3p 位于19 号染色体,被认为是一种致癌基因,可促进包括结直肠癌、胃癌和食管癌在内的癌细胞恶性行为[10]。近年研究主要关注miR-27a-3p 在非肿瘤性疾病中的抗炎、抗细胞凋亡和促进增殖等方面的作用。在兔骨关节炎体内外模型研究中,ZHANG等[11]研究发现,转染 miR-27a-3p 模拟物可促进软骨细胞增殖,同时降低炎性因子表达。JU 等[12]研究表明,miR-27a-3p 能抑制脂多糖诱导的急性肺损伤所致的细胞凋亡。
研究表明,大量miRNA 在脑缺血或再灌注损伤后表达发生改变,参与了缺血性脑卒中损伤与恢复过程的调控[13]。本研究发现,OGD/R 损伤后 miR-27a-3p表达降低,表明miR-27a-3p参与了OGD/R 损伤的病理过程。进一步研究miR-27a-3p 对OGD/R损伤后细胞增殖的作用结果发现,过表达miR-27a-3p 后在复氧复糖 24、48、72 和 96 h 时细胞增殖活性均升高,而抑制 miR-27a-3p 表达后,在 72 和 96 h 细胞的增殖活性降低,证实miR-27a-3p 能促进OGD/R损伤后 PC12 细胞的增殖。XU 等[14]研究发现,下调miR-27a-3p 在胃壁癌细胞中表达后,细胞增殖速度减慢,扩散和迁移能力下降。BAI 等[15]研究证实,miR-27a-3p 过表达促进了大鼠股骨头坏死模型成骨细胞的分化和增殖。此外,miR-27a-3p 下调增加了大鼠脑微血管内皮细胞(BMEC)的单层通透性,抑制了 BMEC 增殖[16]。上述研究均表明 miR-27a-3p 具有促进细胞增殖的作用,我们的研究则在体外模型中证实了这一结论。
B 细胞淋巴瘤-2(Bcl-2)家族蛋白在调节细胞凋亡过程中发挥关键作用,包括抗凋亡蛋白Bcl-2、Bcl-XL 和促凋亡蛋白 Bax、Bak 等[17]。Caspase 家族亦是促进凋亡的重要蛋白家族,是各种凋亡途径的共同通路,而Caspase-3 是其主要成员之一,通过多种凋亡途径促进细胞凋亡[18]。本研究结果显示,OGD/R损伤后促凋亡蛋白的表达均升高,抗凋亡蛋白表达降低;过表达miR-27a-3p 后促凋亡蛋白表达降低,而抗凋亡蛋白表达升高,抑制miR-27a-3p 表达则逆转了以上结果。表明在OGD/R 损伤的PC12细胞模型中,miR-27a-3p 具有抑制细胞凋亡的作用。SUN等[19]研究发现,在内皮细胞中上调miR-27a-3p 表达能抑制Fas 相关蛋白与死亡域(FADD)的表达上调及细胞凋亡途径的激活,从而抑制内皮细胞的凋亡,促进血管重塑,对主动脉夹层具有保护作用。TANG 等[20]研究表明,过表达 miR-27a-3p 降低了高糖诱导损伤的视网膜色素细胞的Caspase-3/9的活性和Bax 蛋白表达,抑制了细胞凋亡,从而保护了该类细胞免受高糖损伤。XI 等[16]研究表明,在脑出血的动物模型中,miR-27a-3p 模拟物的治疗抑制了血肿周围神经元的凋亡和水通道蛋白的上调,发挥了神经保护作用。我们的研究则进一步证实了miR-27a-3p 在CI-RI细胞模型中具有抑制凋亡的细胞保护作用。
综上所述,miR-27a-3p 在 OGD/R 损伤 PC12 细胞中呈低表达,miR-27a-3p 能促进OGD/R 损伤PC12细胞的增殖并抑制其凋亡。

