1株野生羊肚菌鉴定及菌丝培养特性研究
孙靖娥, 李树江, 张 璐, 黎 羲, 雷 艳, 张晓勇, 杨友联
(六盘水师范学院 生物科学与技术学院,贵州 六盘水 553004)
羊肚菌是羊肚菌属真菌的总称,属于子囊菌门(Ascomycota)、盘菌纲(Pezizomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae)、羊肚菌属(Morchella)的稀有可食用大型真菌[1]。羊肚菌又称“羊肚子”“羊肚菇”等,子实体由菌盖、菌柄两部分组成,菌盖多呈土黄色,近球形、卵形至圆锥形,其上分布有凹凸不平的“坑”,形状酷似翻开的羊肚而得名。羊肚菌味道鲜美,富含多种人体必需的氨基酸及矿质元素,深受大众欢迎[2-4]。羊肚菌还含有丰富的真菌多糖,具有缓解疲劳、抗辐射、抗肿瘤、抗氧化等多种保健功能[5-6]。最早林奈在《植物种志》中就记载和命名了羊肚菌及其变种,但早期学者主要基于羊肚菌子囊果的形态特征进行分类,如Sesver将羊肚菌属下划分为6个种,在此基础上,Boudier把法国羊肚菌属划分为23个种[7]。我国早期学者也基于形态特征将我国羊肚菌分为小顶羊肚菌、尖顶羊肚菌等8个品种[8]。但后来有研究者发现,羊肚菌的子囊果形态及颜色易受到生长环境的影响,仅仅依靠形态特征难以鉴别形态相近的类群[9]。近年来,分子生物学技术快速发展,羊肚菌分类更加便捷、准确。有研究者采用ITS+LSU+tef1-α+rpb1+rpb2多基因联合方法对亚洲和北美等地的61份羊肚菌材料进行系统学分类,将其分为黄色羊肚菌支系、黑色羊肚菌支系和变红羊肚菌支系[10],为羊肚菌系统分类奠定了坚实基础。羊肚菌田间驯化栽培受气候条件影响较大,探索人工可控条件的栽培技术是大势所趋[11]。目前,羊肚菌属下有效记录不多,用于田间驯化栽培的品种较少,尤其是六盘水地区。本研究对从六盘水地区采集的1株野生羊肚菌采用形态学结合多基因(ITS、rpb1、rpb2和tef1-α)序列分析进行鉴定,初步确定其分类地位,并通过设置不同碳源、氮源、碳氮比、温度和pH值对野生羊肚菌的菌丝体培养条件进行研究,以期为田间驯化栽培提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 野生羊肚菌Morel2018008采自六盘水市大河镇(海拔1 420 m,E104°52′28.56″ N26°40′33.24″)经火烧过的灌木丛中。
1.1.2 培养基 ①察氏培养基:蔗糖30 g,琼脂15~20 g,硝酸钠3 g,磷酸氢二钾1 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蒸馏水1 000 mL,pH 6.0~7.0;②PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL。
1.1.3 仪器与设备 高压灭菌仪(三洋MLS-3750,深圳市科力易翔仪器设备公司);洁净工作台(SW-CJ-2FD,苏州安泰空气技术有限公司);生化培养箱(SPX-250B,上海琅玕实验设备有限公司);电热鼓风干燥箱(101-2A,北京科伟永兴仪器有限公司);电子天平(JA4103,上海舜宇恒平科学仪器有限公司);正置显微镜(Olympus BX51,深圳市三昊仪器设备有限公司);梯度PCR仪(Mastcrcycler Nexus GSX1,昆明倍捷科技有限公司)。
1.2 方法
1.2.1 野生羊肚菌的分离纯化 采用组织分离法进行野生羊肚菌的分离纯化,获得纯菌株(编号:Morel2018008)。将纯菌株接种于PDA斜面中,25 ℃恒温培养7 d后,4 ℃保存备用。
1.2.2 野生羊肚菌的形态学鉴定 用直尺测量菌盖和菌柄大小,并描述颜色和形状以及菌盖边缘是否向外延伸,记录横、纵棱纹数量等。切取新鲜菌盖菌褶制作临时装片,以乳酸酚棉兰染液进行染色后在显微镜下对子囊盘、子囊及子囊孢子进行观察及拍照,并测量单个子囊及子囊孢子大小。
1.2.3 菌株DNA提取与扩增 菌株于PDA平板25 ℃活化培养7 d后,刮取表面菌丝,用十六烷基三甲基溴化铵(Cetyl Trimethyl Ammonium Bromide,CTAB)法,进行菌株DNA提取[12]。扩增的目的序列分别为ITS、rpb1、rpb2和tef1-α四个基因部分序列片段。ITS选用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和引物ITS5(5′-GGAAGTAAAAGTCGTACAAG-3′)[13];rpb1基因选用引物rpb1B-F (5′-AACCGGTATATCACGTYGGTAT-3′),引物rpb1B-R(5′-GCCTCRAATTGGTTGACRACGT-3′),rpb2基因选用引物rpb2B-F(5′-TAGGTAG GTCCCAAGAACACC-3′),引物rpb2B-R(5′-GATACCATGGCGAACATTCTG-3′)[14],tef1-α基因选用引物ef1-526F(5′-GTCGTYGTYATYGGHCAYGT-3′)和ef1-1567R(5′-ACGTRCCRATACCACCRATCTT-3′)[10,15-16]。PCR扩增反应体系(25 μL):正向引物 1 μL,反向引物 1 μL,2×TaqPCR Master Mix 12.5 μL,ddH2O 8.5 μL,模板 2 μL。扩增ITS序列程序:94 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,35 个循环;最后72 ℃延伸5 min。rpb1和rpb2序列PCR反应程序:94 ℃初始变性3 min;94 ℃变性1 min,50 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃最终延伸10 min[14]。tef1-α序列PCR反应程序:94 ℃预变性5 min;94 ℃变性18 s,54 ℃退火33 s,72 ℃延伸30 s,35 个循环,最后72 ℃延伸7 min[10,15-16]。扩增产物经1%琼脂糖凝胶电泳检测后送至北京擎科生物技术有限公司进行纯化和测序。
1.2.4 多基因序列分析 将分离的野生羊肚菌菌株所测得的ITS、rpb1、rpb2和tef1-α序列,采用BioEdit 5.0.6软件与GenBank中下载的同源性高的基因序列(表1)用MEGA X进行CLASTAI比对,删除头尾的空格后用Sequence Matrix 1.7.8进行自动拼接。以Morchellarufobrunnea(菌株号:M-14)为外类群,采用PAUP 4b10软件以Maximum parsimony法进行分析,以启发式搜索法获取羊肚菌系统发育树,分析该菌株分类地位。
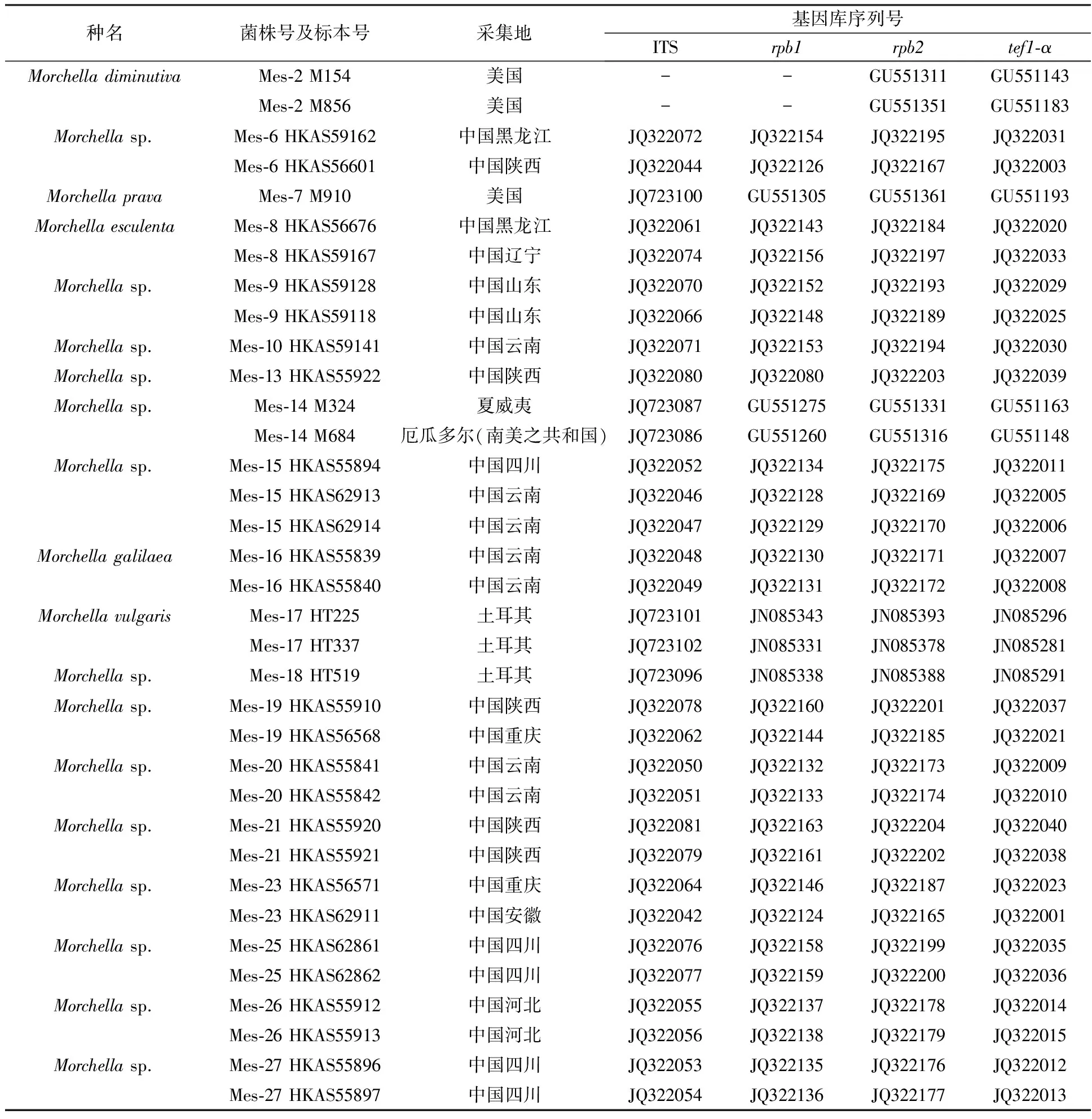
表1 参与系统学分析的序列[10,14,16,19]
1.2.5 菌株生物学特性研究 ①试验设计:最适碳源、氮源、碳氮比、pH筛选。以察氏培养基为基础培养基,分别将察氏培养基中的蔗糖以同质量的葡萄糖、麦芽糖、可溶性淀粉和甘油替换,制备不同碳源的培养基;分别将察氏培养基中的硝酸钠以同质量的硝酸钾、氯化铵、硫酸铵和蛋白胨替换,制备不同氮源的培养基。碳氮比培养基参照王寿南等[17],分别配制C/N值为5/1、10/1、20/1、30/1、40/1、50/1、60/1、70/1培养基。将配制的PDA培养基用HCl或NaOH 分别调节pH至4、5、6、7、8、9、10,制备不同pH值的培养基。将以上处理的培养基倒平板(平板直径为9 cm),每皿10 mL。待平板凝固后,用直径5 mm的打孔器打取已活化的菌株菌丝边缘,并分别接种于各个pH值的培养基中,每个处理4次重复。25 ℃培养4 d后,测量菌丝生长直径(mm);将菌株接种PDA平板,并分别于5、10、15、20、25、30和35 ℃培养,每个处理4次重复。4 d后测定各个温度处理下的菌丝生长直径(mm),计算菌丝生长速率参照董雪[18]方法,进行最适温度筛选。②数据处理与分析:生物学特性数据采用Microsoft Excel 2016和DPSv7.05软件进行数据统计、分析和多重比较。
2 结果与分析
2.1 野生羊肚菌的形态学鉴定

菌株菌落特征如图1(B~C)所示。PDA培养基上,25 ℃培养4 d长满平板,第5天均长出棕黄色的菌核和气生菌丝。菌落呈辐射状生长,随着培养时间延长气生菌丝密度增大,菌核数量增多,颜色逐渐加深至黄褐色。
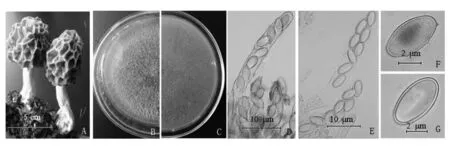
图1 野生羊肚菌形态学特征Fig.1 Morphological characteristics of wild morel A:野生羊肚菌子实体; B~C:菌株菌落特征,B(正面),C(反面); D~E:子囊形态; F~G:子囊孢子形态 A: Wild morel fruit body;B-C: Strain colony characteristics, B(Positive side), C (Reverse side); D-E: Ascus morphology;F-G:Ascospore morphology
2.2 野生羊肚菌多基因序列分析
基于野生羊肚菌的ITS+rpb1+rpb2+tef1-α多基因序列,以Morchellarufobrunnea为外类群构建系统发育树,如图2所示,该菌株与羊肚菌黄色支系的Morchellasp. (菌株号:Mes-15)菌株聚为一支,支持率为100%,支长差异极小,表明该菌株属于羊肚菌黄色支系,与已报道的Mes-15菌株亲缘关系最近,可能为同一个种。
2.3 野生羊肚菌生物学特性分析
2.3.1 碳源和氮源 菌株Morel2018008菌丝在不同碳源条件下生长速率差异显著(图3A),在可溶性淀粉为碳源的培养基上菌丝长速最快,达到9.25 mm/d,显著高于其他碳源处理,其次是蔗糖为碳源。说明该菌株最适碳源为可溶性淀粉。不同氮源对菌株Morel2018008菌丝生长速率的影响达到显著水平(图3B),在以硝酸钾为氮源的培养基上菌丝长速最快,达到9.13 mm/d,显著高于其他氮源处理,其次是硝酸钠和蛋白胨处理。表明硝酸钾为该菌株菌丝生长的最适氮源。
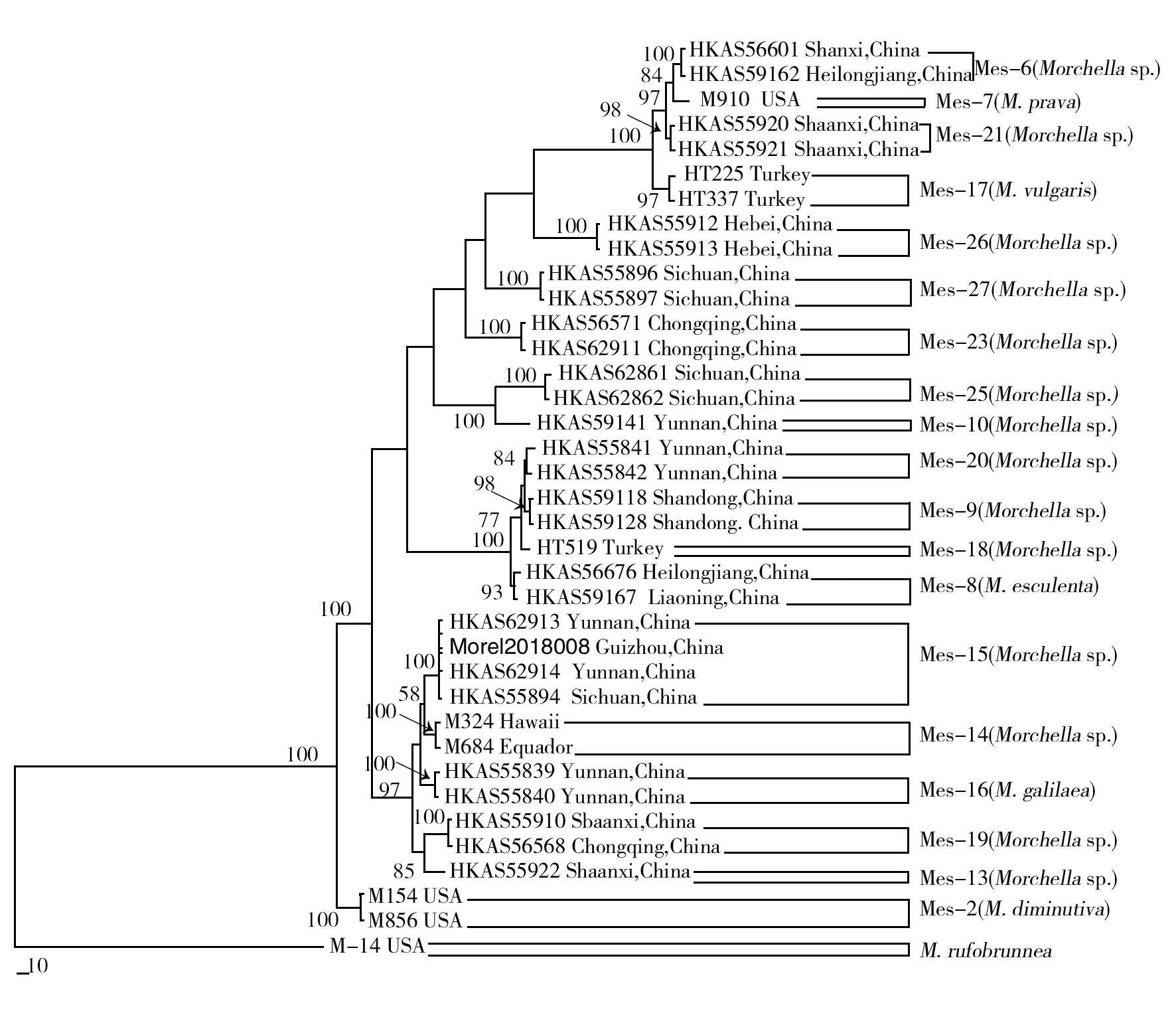
图2 基于ITS+rpb1+rpb2+tef1-α多基因序列以最大简约法分析得出的羊肚菌系统进化树Fig.2 Phylogenetic tree of wild morel based on ITS+ rpb1+rpb2+tef1-α multigene sequence analysis by maximum parsimony method
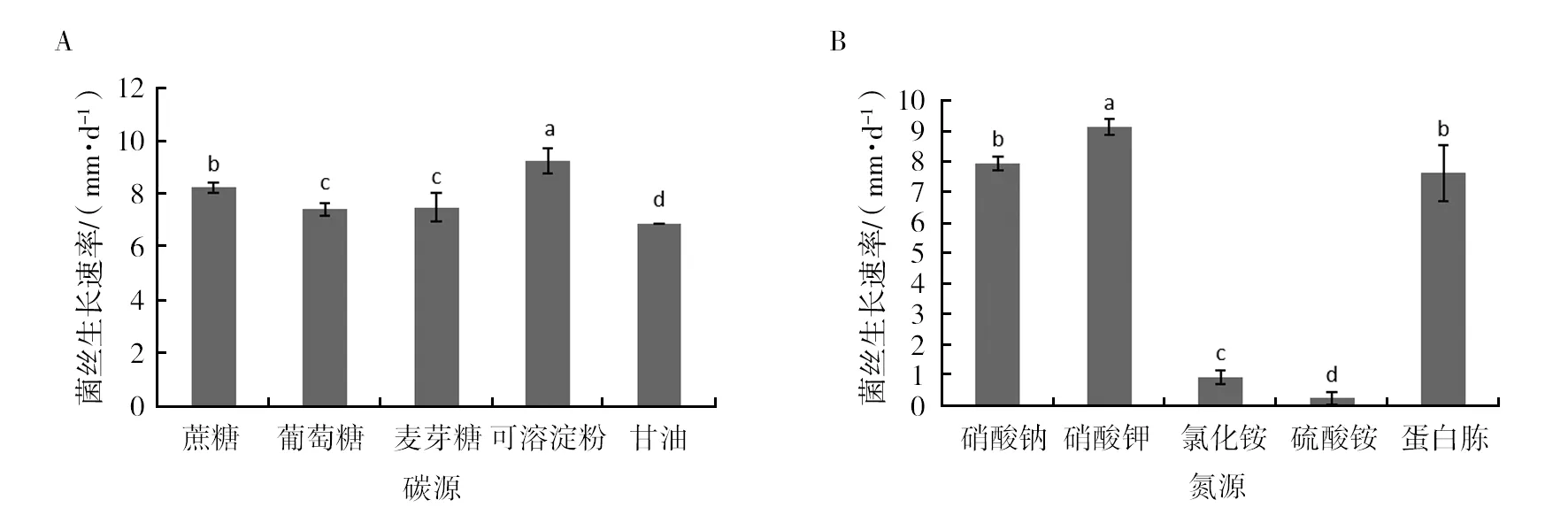
图3 野生羊肚菌在不同碳源(A)、氮源(B)培养基上的生长速率Fig.3 Growth rate of strain Morel2018008 on different carbon(A) and nitrogen(B) sources a、b、c、d:分别代表野生羊肚菌在不同碳源、氮源培养基上的生长速率差异性,不同字母表示差异显著 a,b,c,d:Respectively represent the difference in the growth rate of wild morels on different carbon sources and nitrogen sources, and different letters indicate significant differences
2.3.2 碳氮比(C/N) 不同碳氮比的培养基对菌株Morel2018008的菌丝长速影响显著(图4A)。在设置的范围内,菌丝整体生长速率随培养基碳氮比增大而显著降低。菌丝生长速率在C/N 5/1~20/1的处理下达到最大,且3个处理间差异不显著。说明该株野生羊肚菌生长最适C/N范围为5/1~20/1之间。在C/N为10/1时生长速率达到最大,但差异不显著。
2.3.3 菌丝生长温度和pH值 不同温度处理下菌株Morel2018008的菌丝长速差异显著(图4B),20~30 ℃菌丝长速较快,20 ℃和25 ℃达到9.25 mm/d,生长最快。不同pH值对野生羊肚菌菌丝生长速率的影响如图4C所示。pH值5~9时,菌丝生长速率较快,在该pH值范围内差异不显著,其中pH 7时菌丝生长最好。表明该菌株菌丝生长的最适温度为20~25 ℃,最适pH值为5~9。
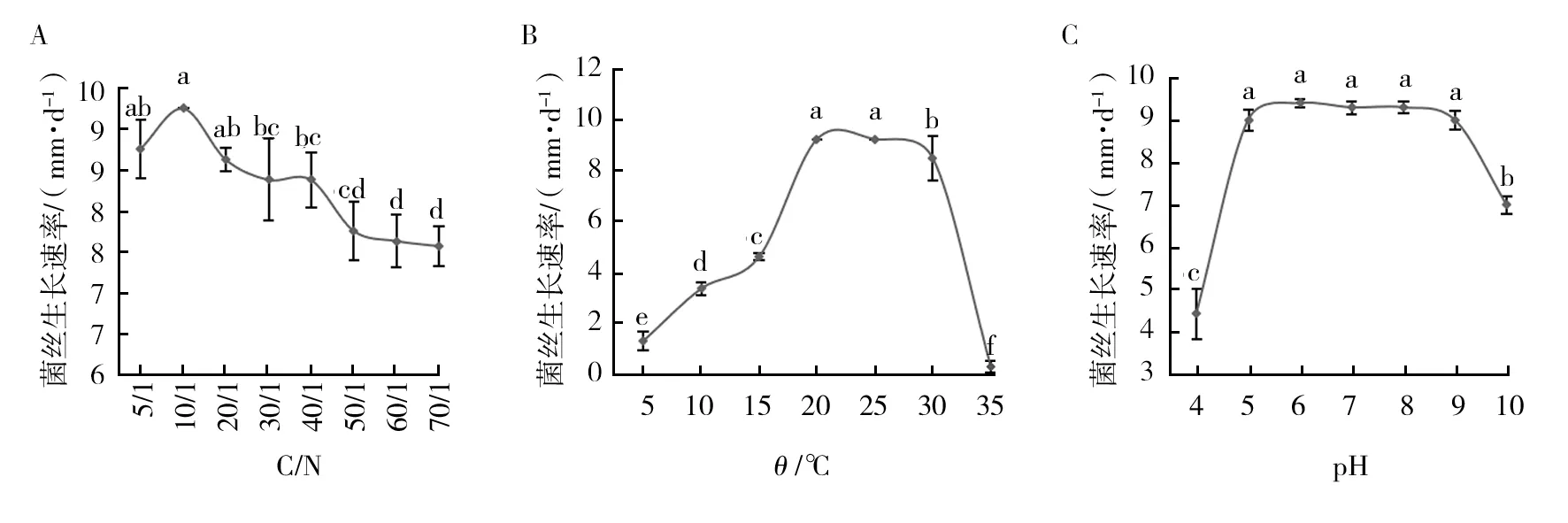
图4 野生羊肚菌在不同碳氮比(C/N)(A)、温度(B)、pH(C)培养基上的生长速率Fig.4 Growth rate of wild strain Morel2018008 on medium with C/N ratio(A), different temperature(B) and pH(C) a、b、c、d:分别代表野生羊肚菌在不同碳氮比、温度、pH培养基上的生长速率差异性,具有相同字母表示差异不显著,不同字母表示差异显著 a,b,c,d:Respectively represent the difference in the growth rate of wild Morchella on different carbon-nitrogen ratio, temperature and pH medium. The same letter indicates that the difference is not significant, and different letters indicate significant difference
3 讨 论
近年来,通过形态学结合多基因系统学鉴定羊肚菌可以得到较为准确的结果。O′Donnell等[10]采用ITS+LSU+tef1-α+rpb1+rpb2多基因联合分析61份羊肚菌材料,可将其分为3个支系(黄色羊肚菌支系、黑色羊肚菌支系和变红羊肚菌支系)。通过多基因序列联合分析,本研究中的菌株Morel2018008与黄色羊肚菌支系的Morchellasp.(菌株号:Mes-15)以100%的高支持率聚为1支。但其子囊果与已报道的菌株Mes-15代表的子囊果形态差异较大,后者子囊果的菌盖呈棕黄色,其上分布明显且规则的横纵棱纹,菌柄米白色,略光滑,无明显的皱褶[14],本研究中羊肚菌子囊果的菌盖颜色较浅,无明显横棱纹,但菌柄不光滑,有显著纵向皱褶。Yang等[9]认为羊肚菌的子囊果形态及颜色容易受到生境的影响,仅靠子囊果形态特征难以识别相近的类群。由此可见,羊肚菌属内各个种的基因型相同,但表型可能存在差异。据此,本研究的野生羊肚菌与菌株Mes-15代表的黄色羊肚菌支系可能为同一个种,菌株Mes-15基因序列偶联的文字也没有对其命名。
国内菌物学者对羊肚菌生物学特性研究较多。碳源、氮源是羊肚菌菌丝生长必不可少的营养元素,并能积累在羊肚菌子实体中[20]。朱永真[4]和韩鹏等[21]对羊肚菌菌丝碳源营养特性研究显示,最适碳源多集中在可溶性淀粉、蔗糖等,本研究最适碳源为可溶性淀粉,其次为蔗糖,研究结果与其相似。但是范冬茹等[22]近年报道粗柄羊肚菌最适碳源为葡萄糖,不同种类羊肚菌碳源利用存在较大差异。朱永真[4]、韩鹏等[21]和柴林山等[23]研究表明,不同种类羊肚菌最适氮源多集中在尿素、蛋白胨、硝酸钾等,本研究最适氮源为硝酸钾,与其他氮源处理达到显著性差异,与前人研究存在一定差异。最适碳源和氮源有利于菌丝生长,但两者的最适比例对菌丝生长影响较大。如刘士旺等[24]研究表明尖顶羊肚菌最适碳氮比为35/1。而和晓娜[25]研究四种不同羊肚菌的碳氮比揭示最适碳氮比为25/1。陶热等[26]报道,小羊肚菌最适碳氮比为20/1。本研究中最适碳氮比为5/1~20/1。由此可见,羊肚菌属各个种的最适碳氮比存在一定差异。
韩鹏等[21]研究两种野生羊肚菌发现,最适pH均为8。和晓娜[25]研究四种羊肚菌表明不同羊肚菌的适宜pH为6~7。本研究显示,菌株菌丝生长在pH 5~9之间差异极小,pH 7时菌丝生长最快最好。
羊肚菌是一种在我国广泛分布的低温性药食兼用真菌。李岩龙[27]研究表明梯棱羊肚菌M6613菌丝最适生长温度为20 ℃;谢放等[28]报道了7种羊肚菌的最适生长温度为25 ℃;韩鹏等[21]研究表明两株羊肚菌最适生长温度为24 ℃。本研究发现20~30 ℃有利于菌株菌丝生长,20~25 ℃生长最快,达到显著水平,为最适生长温度范围。

