蜡质芽胞杆菌XF的发酵条件优化及对番茄灰霉病的防治效果
潘晓梅, 李昭煜, 张晓梦, 张建强, 吴康莉, 李佳佳, 石晓玲, 田永强 *
(1.兰州交通大学 生物工程与技术学院,甘肃 兰州 730070;2.重庆市计量质量检测研究院,重庆 404100)
由灰葡萄孢菌(Botrytiscinerea) 引起的番茄灰霉病,对大棚番茄的产量造成了严重威胁,严重时减产达60%以上[1-3]。当前防治番茄灰霉病的主要方法之一是利用生防菌及其代谢产物进行生物防治[4-7]。生防菌主要通过促进植物生长,增强抗病虫害及对恶劣环境的适应能力等来抵御番茄灰霉病菌的侵害[8-9]。王勇等[10]从梓树上分离到 1 株对番茄灰霉病菌、番茄早疫病菌等多种病原菌有较好拮抗作用的解淀粉芽胞杆菌菌株GZ-5。张文芝[11]从番茄根际土壤中分离获得 1 株对根结线虫有很好防治效果的蜡质芽胞杆菌菌株AR156。为了提高菌株的生防效果,王伟等[1]对贝莱斯芽胞杆菌菌株TB-12进行发酵培养基和发酵条件的优化,使其对灰葡萄孢菌的抑制效果增加了69.4%。张学秋等[12]对蝉拟青霉进行液体发酵优化,使多糖产量和生物量较优化前提高了1倍。徐志周等[13]对伯克霍尔德菌菌株HQB-1的发酵培养基和发酵条件进行优化,使菌液OD600从1.251提高到1.881,对香蕉枯萎病菌的抑制率增加了73.5%。本研究选取对番茄灰霉病菌具有较高抑菌活性的蜡质芽胞杆菌菌株XF,以对灰葡萄孢菌的抑制率和菌株生物量为指标,采用单因素和正交试验相结合的方式对菌株XF进行发酵培养基和发酵条件优化,确定其最佳发酵培养基和发酵条件,并通过盆栽试验观察发酵前后发酵液对番茄灰霉病的防治效果,以期为该菌剂生产工艺条件的进一步确定及其防治应用的开展提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 蜡质芽胞杆菌(Bacilluscereus)XF株、番茄灰霉病菌,兰州交通大学生物源农药工程中心保存。
1.1.2 培养基 PDA、LB培养基[14]。
1.2 方法
1.2.1 生物量测定 取一定量的发酵液,采用稀释涂平板法测定发酵后的活菌数(cfu/mL)或测定OD600。
1.2.2 抑菌活性测定 将发酵液8 000 r/min离心5 min,取上清,以孔径为0.45 μm的菌膜过滤得到滤液,按1∶10(滤液∶培养基,体积比)将发酵滤液混入50 ℃左右的 PDA培养基中。待培养基凝固后,在培养皿中心接入直径8 mm的病原真菌菌饼,以不加发酵滤液为对照,25 ℃培养5 d后,测量其菌落直径,计算抑菌率[15]。每组3次重复。 抑菌率(%)=((对照组菌落直径-处理组菌落直径)/对照组菌落直径)×100%。
1.2.3 单因素试验优化发酵培养基 ①菌株XF生长曲线的测定及种子培养:将菌株XF接种于50 mL LB液体培养基中,30 ℃,160 r/min震荡培养过夜,以1%(体积分数)的接种量转接到100 mL新鲜的LB液体培养基中培养,每隔1 h取1次培养液,测定OD600,重复3次,绘制菌株XF的生长曲线。②培养基优化:以LB培养基为基础,以活菌数(cfu/mL)和对番茄灰霉病菌的抑菌率为指标,对菌株XF发酵培养基碳源、氮源、无机盐进行优化,每次将优化后结果应用于下一因素的优化中。碳源:可溶性淀粉、乳糖、蔗糖、葡萄糖;氮源:(NH4)2SO4、NH4Cl、NH4NO3、NaNO3、尿素;无机盐:CaCl2、FeSO4·7H2O、MgSO4·7H2O、MnCl2。每个处理3次重复。③培养基比正交优化:通过单因素试验将筛选出的最佳碳源、氮源、无机盐和NaCl 4个因素进行4因素3水平L9(34)正交表进一步优化。
1.2.4 发酵条件的优化 采用优化培养基,以OD600值和对番茄灰霉病菌的抑菌率为指标,对菌株XF发酵初始pH、温度、发酵时间、转速、接种量等发酵条件进行优化,每次将优化后结果应用于下一因素的优化中。初始pH:5.0、5.5、6.0、6.5、7.0、7.5、8.0;温度:26、28、30、32、34、36 ℃;发酵时间:24、36、48、60、72 h;转速:160、180、200、220 r/min;接种量:1%、2%、5%、10%。每个处理3次重复。
1.2.5 菌株XF发酵液的生防效果评价 ①菌株XF发酵液对番茄灰霉病菌的抑制效果评价:取发酵滤液原液、10倍稀释液、100倍稀释液,方法同1.2.2;②菌株XF发酵液在番茄离体叶片上的生防效果:方法同1.2.2得到菌株XF优化后的发酵滤液。用培养7 d的番茄灰霉病菌制备孢子悬浮液约为105个/mL分别与发酵液原液,稀释2、4、6、8、10、100倍的滤液以1∶1(体积比)均匀混合,无菌发酵培养基为对照。取生长周期为25 d左右的番茄植株叶片,置于含湿润滤纸的大培养皿中,取上述各混合液20 μL均匀滴于叶片主叶脉两侧, 25 ℃恒温培养箱中培养7 d,测量病斑直径,每组处理两片叶片[15]。防效(%)=((对照组平均病斑直径-处理组平均病斑直径)/对照组平均病斑直径)×100%。 ③菌株XF发酵液对盆栽番茄的生防效果:采用喷雾法将②中得到的不同浓度梯度的发酵液均匀喷于生长周期为25 d的番茄植株上,24 h后用毛笔蘸取50 μL的孢子悬浮液涂在番茄植株叶片上。以无菌发酵培养基为对照,每组选定10株,每株处理10片真叶,重复3次。每24 h统计1次植株发病率和严重度,并计算病情指数和防病效果[16]。病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×最高级数值)×100,防治效果(%)=((对照组病情指数-处理组病情指数)/对照组病情指数)×100%。
2 结果与分析
2.1 单因素试验优化发酵培养基
2.1.1 菌株XF生长曲线的测定 由图1可知,菌株XF的生长曲线分布为延迟期0~3 h,对数生长期3~16 h,稳定期16~21 h,22 h后进入衰亡期。因此确定菌株XF发酵用种子液培养时间为14 h。
2.1.2 碳源对菌株XF生长和发酵滤液活性的影响 不同碳源培养基对菌株XF生长和发酵滤液活性的影响结果(图2A)显示,加入葡萄糖后发酵液活菌数可达3.29×1012cfu/mL,与基础LB培养基及加入其他碳源培养基均有显著性差异(P<0.05);发酵滤液对番茄灰霉菌的抑制率达71.26%,与基础LB培养基有显著性差异(P<0.05)。因此,菌株XF的发酵培养基中应加入10 g/L葡萄糖作为碳源。
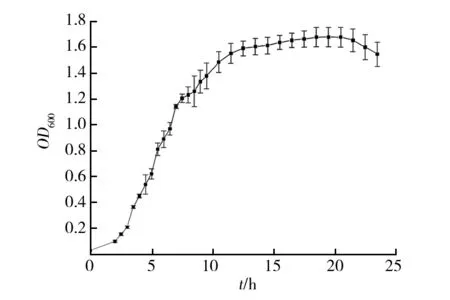
图1 蜡质芽胞杆菌XF株的生长曲线Fig.1 Growth curve of Bacillus cereus XF
2.1.3 氮源对菌株XF生长和发酵滤液活性的影响 不同氮源对菌株XF生长和发酵滤液活性的影响结果(图2B)显示,当氮源为酵母粉时,发酵液的活菌数达到4.57×1012cfu/mL,且与其他氮源相比存在差异显著性(P<0.05);发酵滤液对番茄灰霉菌的抑菌率达72.62%。因此,选择酵母粉为最佳氮源。
2.1.4 无机盐对菌株XF发酵的影响 不同无机盐培养基对菌株XF生长和发酵滤液活性的影响结果(图2C)显示,以MgSO4·7H2O为无机盐时,发酵液活菌数达到2.01×1013cfu/mL,发酵液无菌滤液对番茄灰霉病菌的抑制率可达73.67%,与其他无机盐相比差异达到显著水平(P<0.05)。因此选取MgSO4·7H2O作为最佳无机盐。
2.2 培养基成分比正交优化
通过正交设计对菌株XF发酵培养基各组分比进行优化(表1),最佳活菌数的培养基组合为A2B2C2D2,由极差R′值可知,4个组分对发酵液活菌数的影响强弱为葡萄糖>NaCl>酵母粉>MgSO4·7H2O;最佳抑菌率的培养基组合为A2B2C2D2;由极差R′值可知,4个组分对无菌发酵滤液抑菌活性的影响强弱为葡萄糖>NaCl>酵母粉>MgSO4·7H2O。综合以上两个因素,确定优化后的培养基组合为葡萄糖1.00%、酵母粉0.50%、NaCl 1.00%、MgSO4·7H2O 0.10%。
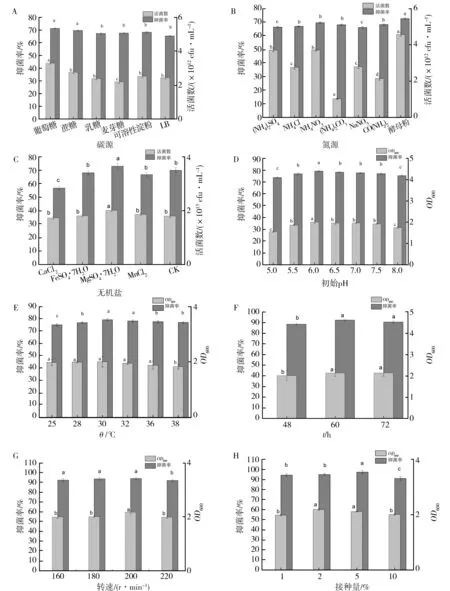
图2 不同发酵条件对蜡质芽胞杆菌XF株生长量及抑菌率的影响Fig.2 Effects of different fermentation conditions on growth and inhibition rate of Bacillus cereus XF A:不同碳源;B:不同氮源;C:不同无机盐;D:不同初始pH;E:不同温度;F:不同时间;G:不同转速;H:不同接种量。不同小写字母表示各处理间P<0.05水平差异显著 A: Different carbon source; B:Different nitrogen source; C:Different inorganic salt; D: Different pH; E: Different temperature; F:Different culture time;G:Different rotate speed; H:Different inoculation amount. Different letters indicate significant different at P<0.05 level
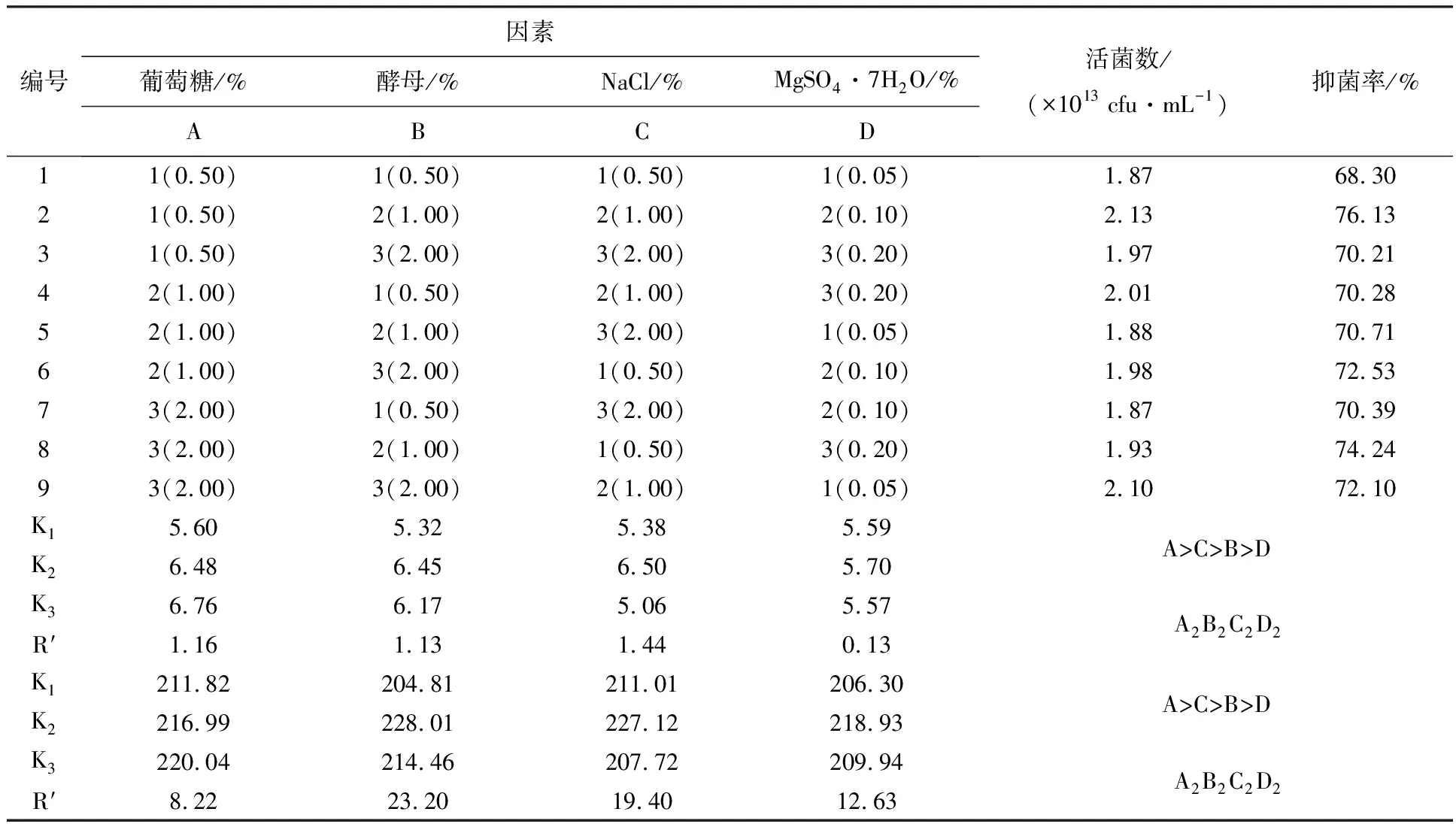
表1 蜡质芽胞杆菌XF株发酵培养基正交优化设计及试验结果
2.3 发酵条件优化
2.3.1 初始pH 当发酵培养基初始pH为5.0~6.0时,OD600和发酵滤液抑菌率呈上升趋势,在6.0时达到最大,OD600为2.003,抑菌率为79.65%;此后随着初始pH的增大,OD600和发酵滤液抑菌率均逐渐减小(图2D),故发酵培养基初始pH应控制在6.0左右。
2.3.2 温度 温度是菌株发酵培养时的一个关键因素,当培养温度在25~36 ℃时,发酵液的OD600值维持在1.878~2.008之间,发酵滤液对番茄灰霉病菌的抑制率在75.16%~80.54%;最适温度为30 ℃,发酵液的OD600值为2.008,发酵滤液对番茄灰霉病菌的抑制率为80.54%(图2E)。因此确定菌株XF发酵液的培养温度为30 ℃。
2.3.3 发酵时间 发酵时间代表着菌体生长凋亡的过程,发酵培养60 h时菌液浓度和发酵滤液抑菌率均达到最大值,OD600为2.137,抑菌率为92.11%,之后菌液浓度和发酵滤液抑菌率缓慢降低,直至菌体衰退(图2F)。因此菌株XF最佳发酵时间应为60 h。
2.3.4 摇床转速 当摇床转速分别为160、180、200、220 r/min时,菌株发酵液OD600分别为1.994、2.005、2.176、1.990 cfu/mL,发酵滤液抑菌率为92.59%、93.89%、94.26%、92.22%。故优选转速为200 r/min,此时发酵液OD600值和抑菌率均达最大值(图2G)。
2.3.5 接种量 当菌株XF的接种量为5%时,发酵液OD600最大,为2.184;发酵滤液抑菌率最大,为97.22%(图2H)。因此发酵液种子接种量选择5%。
2.4 菌株XF发酵液对番茄灰霉病菌的抑制效果评价
将菌株XF发酵60 h的无菌发酵滤液原液、稀释10倍、100倍以1∶10加入到PDA培养基中,对番茄灰霉病菌的抑制效果显示,抑菌率可达100%、98.19%、83.73%(表2)。
2.5 菌株XF发酵液在番茄植株上的生防效果评价
2.5.1 菌株XF发酵液在番茄离体叶片上的生防效果评价 番茄植株叶片接种番茄灰霉病菌36 h后,对照组的叶片开始显现病斑;60 h后,10、100倍稀释液处理的叶片开始显现病斑;72 h后,2、4、6、8倍稀释液处理的叶片随着稀释倍数的增加逐渐出现严重度递加的病斑。5 d后,对照组平均病斑直径达12.23 mm,而此时菌株XF两倍稀释液处理的番茄植株叶片的病斑直径平均为0.09 mm,防效达92.64%;菌株XF发酵液原液处理的番茄叶片一直未发病,防效达100%(表3)。
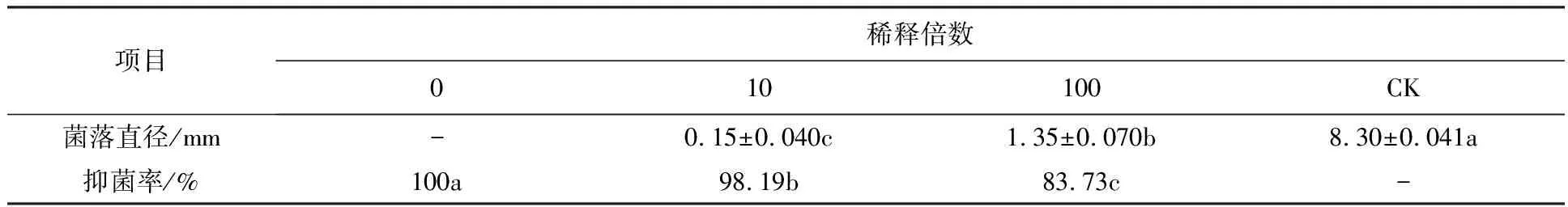
表2 蜡质芽胞杆菌XF株发酵液对番茄灰霉病菌的抑制效果
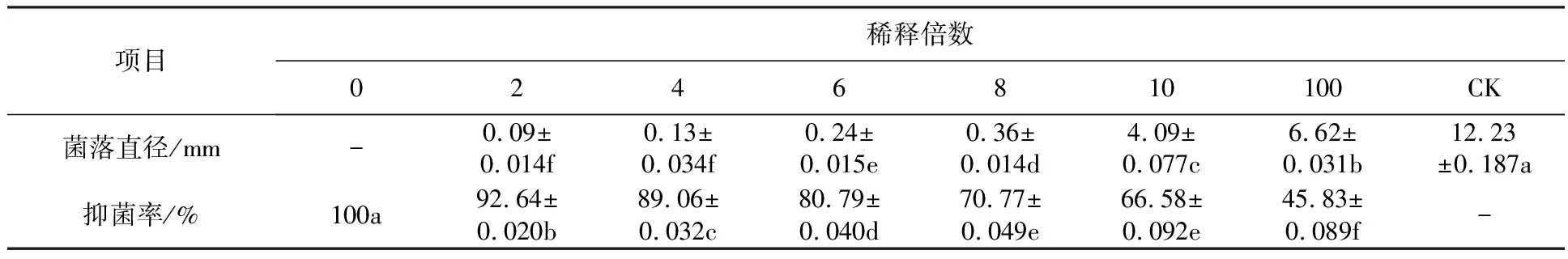
表3 蜡质芽胞杆菌XF株发酵液对离体叶片番茄灰霉病的防治效果(72 h)
2.5.2 菌株XF发酵液对盆栽番茄的生防效果评价 施用优化后的拮抗菌株XF发酵液对番茄灰霉病的防治效果显著(图3)。发酵液原液对番茄灰霉病的防治效果可达100%,稀释2倍时防治效果为97.74%,稀释8倍时防治效果降低至89.25%,且差异显著(P<0.05)(表4)。
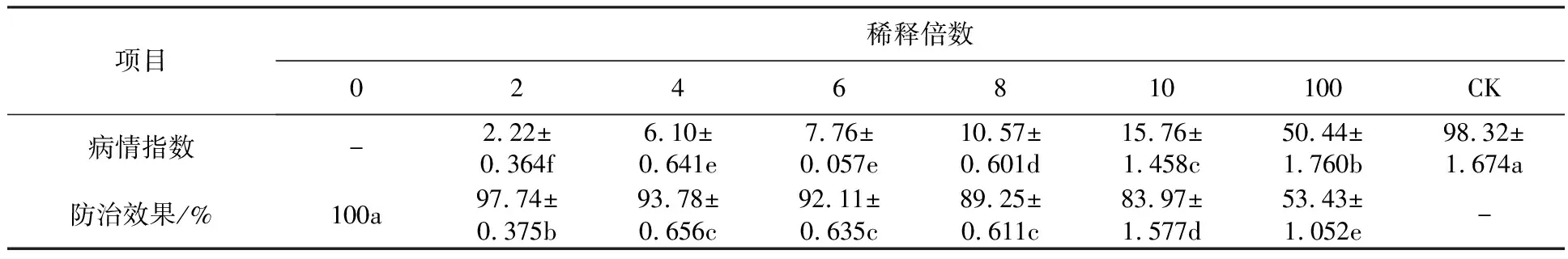
表4 蜡质芽胞杆菌XF株发酵液对盆栽番茄灰霉病的防治效果




图3 蜡质芽胞杆菌XF株发酵液对盆栽番茄灰霉病的防治效果Fig.3 Control effect of Bacillus cereus XF fermentation liquid on Botrytis cinerea in potted tomato a、a1:滤液原液;b、b1:稀释2倍滤液;c、c1:稀释4倍滤液;d、d1:稀释6倍滤液;e、e1:稀释8倍滤液;f、f1:稀释10倍滤液;g、g1:稀释100倍滤液; h、h1:CK a,a1:The filtrate concentrate; b,b1:Dilute the filtrate 2 times; c,c1:Dilute the filtrate 4 times; d,d1:Dilute the filtrate 6 times; e, e1:Dilute the filtrate 8 times; f,f1:Dilute the filtrate 10 times; g,g1:Dilute the filtrate 100 times; h,h1:CK
3 讨 论
研究表明,优化生防菌发酵培养基组分、含量及发酵条件,有利于菌体量的增加和抗菌活性物质的累积,从而提高生防效果[17-18]。本研究以蜡质芽胞杆菌菌株XF的生长量及发酵滤液的生防效果为指标,获得菌株XF最适培养基(质量分数):葡萄糖1.00%,蛋白胨1.00%,酵母粉0.50%,NaCl 1.00%,MgSO4·7H2O 0.10%,色氨酸100 mg/L。从发酵培养基组分来看,李丽等[19]报道解淀粉芽胞杆菌菌株M1摇瓶发酵的最优发酵培养基成分:碳源(可溶性淀粉)5%,氮源(酵母粉∶蛋白胨=2∶1)10%,NaCl 5%。王勇等[10]报道B.velezensisTB-2的最优发酵培养基成分为乳糖 2%,酪蛋白胨4%,MgSO4·7H2O 1%,KCl 0.05%,优化后对灰葡萄菌的抑制率增加了69.2%。本研究通过对蜡质芽胞杆菌菌株XF发酵培养基碳源、氮源、无机盐的优化发现,菌株XF与大多数芽胞杆菌属的菌株发酵培养基成分相近。
微生物发酵优化除了最优培养基成分外,发酵条件也是一个重要影响因素。本研究的蜡质芽胞杆菌菌株XF最佳发酵条件:初始pH 6.0,温度30 ℃,发酵周期60 h,摇床转速200 r/min,接种量5%。温度通过影响微生物生存的环境因子和体内的生化反应,进而影响抑菌物质的合成[20]。菌株XF的最适发酵温度为30 ℃,与黄秀敏等[21]报道的蜡样芽胞杆菌最适发酵温度35 ℃存在差异,可能是菌株来源不同导致同类菌株发酵温度的差异。pH不仅影响微生物的生长,而且微生物代谢产物的累积也受其反馈调节。菌株XF的最适初始pH为6.0,证明菌株XF适宜生长在酸性条件下。接种量通过影响菌体的生长周期而影响发酵液中菌体生物量。菌株XF的最适接种量为5%,接近于李晔等[22]报道产胶原酶的蜡样芽胞杆菌发酵最适接种量为6%。菌株XF的发酵周期为60 h,与大多数芽胞杆菌发酵的差异性较大,可能是试验方法之间存在差异,Rajesh等[23]报道当蜡样芽胞杆菌对油菜黑腿病有较好防治效果时的发酵周期为48 h。
通过对发酵培养基和发酵条件的优化,蜡质芽胞杆菌菌株XF的无菌发酵滤液原液、稀释10倍、100倍对番茄灰霉病菌的抑菌率为100%、98.19%、83.73%;无菌发酵滤液原液、稀释2倍、6倍、10倍对番茄离体叶片灰霉病的防效为100%、92.64%、80.79%、66.58%,对盆栽番茄灰霉病的防效为100%、97.74%、92.11%、83.97%。表明菌株XF对番茄灰霉病的防治效果显著,为研发绿色防治番茄灰霉病药剂奠定了一定的基础。

