1株解淀粉芽胞杆菌的常压室温等离子诱变及其发酵优化
束仕元, 黄艳娜, 段赛菲, 周茂超, 唐雪明*
(1.上海海洋大学 食品学院,上海 201306;2.上海市农业科学院 生物技术研究所,上海 201106)
镰刀菌是一类全球广泛分布的真菌,可导致作物的枯萎病、根腐病等多种病害[1]。致病性的镰刀菌菌株寄主达100多种,许多镰刀菌菌株能在种植或收获后感染多数农作物及观赏植物,如Fusariumoxysporumf.sp.lycopersici会导致番茄血管枯萎病[2],Fusariumoxysporumf.sp.cubense会导致香蕉枯萎病[3],极大地降低了作物的产量和品质,是生产上较难防治的重要病害之一,目前尚无有效的治疗和控制方法,因此,寻找绿色、健康、高效的生物防治手段成为当务之急。常压室温等离子体(ARTP)是近年来提出的一种新的大气压辉光放电冷等离子体源,能在大气压下产生温度在25~40 ℃之间具有高活性粒子浓度(包括处于激发态的氦、氮原子以及羟基自由基等)的等离子体射流,能量在以辐射的方式传递到生物体内后,生物体内各分子便产生电离与激发,产生多种化学性质活泼的自由原子或基团,通过彼此间的相互反应,并与大分子核酸和蛋白质反应,引起分子结构发生改变,影响如DNA合成的中止、酶活性改变等生化过程,使得染色体等各部分结构进一步变化[4]。区别于传统诱变方法,ARTP具有安全稳定、使用方便、突变速度快等多种优点[5]。通过ARTP诱变选育的白色金针菇突变菌株较原始菌株对黑腐病病原菌(P.tolaasii)的拮抗能力提高15.49%[6]。菌株ArthrobacterKQ11在经过ARTP诱变后,其葡聚糖酶活较野生菌株提高50%[7]。本研究利用ARTP技术对解淀粉芽胞杆菌(Bacillusamyloliquefaciens)TXM-A2进行诱变,以禾谷镰孢菌(Fusariumgraminearum)为指示菌,筛选拮抗效果提高的诱变株AR7,以菌株AR7发酵液的OD600值和对尖刀镰孢菌的抑菌直径为指标,采用单因素试验优化其发酵培养基,并最终通过诱变株的发酵过程优化发酵工艺,提高解淀粉芽胞杆菌的生物防治效果。
1 材料与方法
1.1 材料
1.1.1 菌种来源 解淀粉芽胞杆菌(B.amyloli-quefaciens)TXM-A2、禾谷镰孢菌(F.graminearum)、尖孢镰刀菌(F.oxysporum)均由本实验室(上海市农业科学研究院生物研究所)提供。
1.1.2 培养基 ①PDA培养基(用于活化禾谷镰孢菌及尖孢镰刀菌);②LB培养基;③NA培养基(g/L):蛋白胨 10,葡萄糖 2.5,牛肉浸膏 3;④NB培养基(g/L):牛肉膏 3,蛋白胨 10,NaCl 5;⑤NYBD培养基(g/L):牛肉浸膏 8,酵母浸粉 5,葡萄糖 10;⑥BPY培养基(g/L):葡萄糖 5,蛋白胨 10,牛肉膏 5,酵母浸粉 5,NaCl 5;⑦Landy培养基:葡萄糖 20.0 g/L,FeSO40.15 mg/L,L-谷氨酸钠 5.0 g/L,MnSO45.0 mg/L,MgSO40.5 g/L,CuSO40.16 mg/L,KCl 0.5 g/L,KH2PO41.0 g/L;⑧基础发酵培养基(g/L):葡萄糖 10,蛋白胨 10,KH2PO40.2,MgSO40.2;⑨巴氏梭状芽胞杆菌合成培养基(g/L):葡萄糖10,MnSO40.01,KH2PO40.5,FeSO40.01,K2HPO40.5,酵母浸粉1,MgSO4·7H2O 0.2,蛋白胨 0.1,NaCl 0.01,CaCO35。
1.1.3 试剂 蛋白胨、酵母浸粉(OXOID);牛肉浸膏、牛肉膏、葡萄糖、琼脂粉、L-谷氨酸钠(国药集团化学试剂有限公司);CaCl2、NaCl、FeSO4、MnSO4、MgSO4、CuSO4、KCl、KH2PO4、MgSO4·7H2O、CaCO3、K2HPO4(分析纯,国药集团化学试剂有限公司)。
1.1.4 主要仪器与设备 ARTP诱变仪(ⅡS型,无锡源清天木生物科技有限公司);电热恒温培养箱(DHP-9272,上海华利达);离位灭菌发酵系统(BIOTECH-5BG,上海保兴生物设备工程有限公司);细胞培养超净工作台(ACB-61A,新加坡艺思高生物科技有限公司);生物显微镜(XTL-208C,上海明兹精密仪器有限公司)。
1.2 方法
1.2.1 菌株TXM-A2的ARTP诱变 ①菌悬液制备:将菌株TXM-A2经试管活化后,按1%(体积分数)的接种量转接于装有100 mL LB培养基的250 mL锥形瓶中,37 ℃、180 r/min摇瓶培养4~5 h至对数生长期。经稀释使菌体活菌数约为107cfu/mL,取1 mL稀释后的菌液4 000 r/min、4 ℃离心处理10 min,将离心后的沉淀物用1 mL无菌生理盐水悬浮,然后进行ARTP诱变处理。②ARTP诱变处理:将上述菌悬液与10%(体积分数)甘油按1∶ 1的比例混合,混合后取10 μL均匀涂在无菌小铁片上,用无菌镊子将铁片置于凹槽内,并在凹槽下放入装有1 mL无菌生理盐水的2 mL规格离心管,设置诱变时间再进行ARTP诱变。处理结束后,将落有铁片的离心管取出置于震荡机低速洗脱1 min后待测。ARTP功率设定120 W,通气量设定10 L/min,利用冷却水循环机,控制温度20 ℃,通过改变诱变时间(2、4、6、8、10、12、14、16、18和20 s)计算诱变致死率,以未诱变处理的菌体作为对照,根据致死率(%)确定最终的诱变条件。致死率(%)=((对照菌落数-诱变后菌落数)/对照菌落数)×100%。③筛选方法:分别将活菌数约为108cfu/mL的诱变株种子液按1%(体积分数)的接种量转接于装有100 mL Landy培养基的250 mL锥形瓶中,37 ℃、180 r/min摇瓶培养48 h,取发酵液于4 ℃、12 000 r/min条件下离心20 min,经0.22 μm滤膜过滤,再将无菌发酵上清与冷却至55 ℃左右的PDA培养基充分混合,使发酵上清的含量为100.0 μL/mL,然后在平板中央接种培养5~6 d的禾谷镰孢菌菌落边缘菌饼(Φ=7 mm)。以同体积无菌水为对照,每处理重复3次,30 ℃恒温培养4~5 d,观察和测量病原菌禾谷镰孢菌的菌落直径[8],并计算抑菌率。纯生长量=菌落的平均直径-菌饼直径;抑菌率(%)=((对照菌落纯生长量-处理菌落纯生长量)/对照菌落纯生长量)×100%。④遗传稳定性分析:为了验证诱变株的遗传稳定性,将初筛后获得的菌株分别平板划线连续培养传至5代,并测量每一代的病原菌直径。
1.2.2 种子培养基的筛选 将活菌数约为108cfu/mL的诱变株种子液按1%(体积分数)的接种量分别接种于1.1.2的8种(②~⑨)培养基中,于37 ℃、180 r/min条件下培养48 h,取发酵液4 ℃、12 000 r/min离心20 min后,经0.22 μm滤膜过滤,采用牛津杯法[9]进行尖孢镰刀菌拮抗菌株种子培养基的筛选,测定发酵液的OD600和对尖胞镰刀菌的抑菌直径,每处理3次重复。
1.2.3 发酵培养基的单因素试验 分别以0.5%(质量分数)的磷酸氢二钾、氯化钙、0.012%(质量分数)的硫酸亚铁作为无机盐,分别以2%(质量分数)的硝酸钾、硫酸铵、尿素、黄豆饼粉、酵母浸粉、牛肉膏作为氮源(替换种子培养基的蛋白胨、牛肉膏及酵母浸粉),分别以0.5%(质量分数)的蔗糖、甘露醇、可溶性淀粉作为碳源,测定发酵液的OD600以及发酵液对尖胞镰刀菌的抑菌直径,每个处理3次重复,以确定发酵培养基的最佳无机盐、氮源及碳源。
1.2.4 发酵培养基的分配比优化 根据最佳无机盐、氮源及碳源的筛选结果,选用3因素3水平L9正交表进行正交试验,以确定最适宜诱变株生长和产抑菌物质最优的培养基组合。测定方法同1.2.2。
1.2.5 诱变株的发酵过程优化 将诱变株在LB培养基中活化,按1%(体积分数)接种量接种于最适种子培养基中,37 ℃、180 r/min摇瓶培养12 h得到种子液。摇瓶培养后的种子液按4%(体积分数)的接种量接种于装有2.5 L发酵培养基的5 L发酵罐中。发酵参数:通气量1.25 L/min,搅拌转速分别设置为100、200 r/min,培养温度37 ℃,10%(体积分数)的氨水调节pH 7.0。每隔2~4 h取样,血球计数法计算菌株活菌数,DNS法测定发酵液中葡萄糖含量。
2 结果与分析
2.1 致死率曲线的绘制
采用平板计数法绘制解淀粉芽胞杆菌TXM-A2的ARTP诱变致死率曲线,建立ARTP诱变时间与致死率的关系曲线,结果见图1。

图1 ARTP处理TXM-A2的致死率曲线Fig.1 Lethality rate of TXM-A2 induced by ARTP with different treating time
由图1可知,当处理时间在2~10 s之间时,随着处理时间的增加,致死率迅速增加。增加到12 s时致死率急剧下降,12 s后致死率逐渐回升,当诱变时间增加到18 s以上时,致死率接近100%。致死率曲线呈先升高后下降再上升的趋势,这可能与SOS反应(SOS response)有关,细胞DNA在受到损伤或复制系统受到抑制的紧急情况下,为求生存而产生的一种应急措施。因此选择8 s为最佳诱变时间。
2.2 诱变株的筛选
进行诱变筛选后,从诱变株中分离到1株禾谷镰孢菌拮抗菌株AR7。如表1所示,AR7发酵上清对病原菌的抑制率达72.10%,较出发菌株TXM-A2(图2B)提高约33.15%。
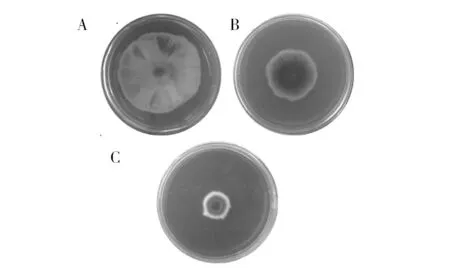
图2 解淀粉芽胞杆菌对禾谷镰孢菌的拮抗作用Fig.2 Antagonistic effect of B. amyloliquefaciens against F. graminearum A:对照; B:TXM-A2; C:诱变株AR7 A: Control; B: TXM-A2; C: Mutagenized strain AR7
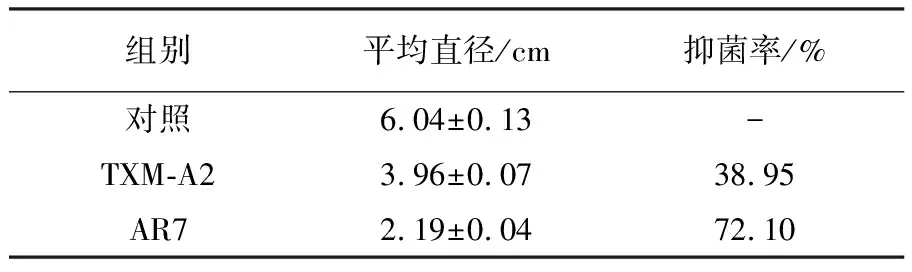
表1 菌株TXM-A2和诱变株AR7发酵上清 对禾谷镰孢菌的抑菌率
2.3 遗传稳定性分析
通过对筛选后得到的诱变株AR7进行传代培养并测量每一代禾谷镰刀菌的直径,以验证其遗传稳定性。结果如图3所示,随着诱变株传代次数的增加,病原菌禾谷镰刀菌的生长直径与出发菌株处理下的病原菌基本一致,这表明该诱变株具有良好的遗传稳定性。
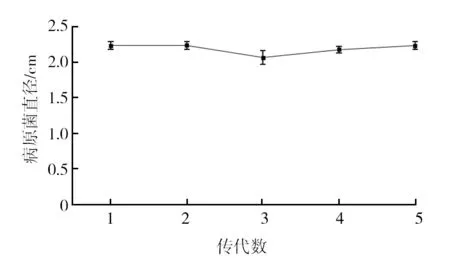
图3 诱变株连续培养5代病原菌的直径Fig.3 Diameter of mutagenic strains for 5 consecutive generations of pathogens
2.4 种子培养基的筛选及单因素试验
2.4.1 初始种子培养基的筛选 由图4可知,诱变株AR7在LB和Landy培养基培养时,其发酵菌体密度较高(P<0.05),OD600值分别为6.230和4.025,其次是BPY和巴氏梭状芽胞杆菌合成培养基(P<0.05),OD600值分别为3.250、3.040。诱变株AR7经BPY培养基培养后,发酵液对尖孢镰刀菌的抑制作用最强,且相较于NB、基础发酵培养基和巴氏梭状芽胞杆菌合成培养基差异显著(P<0.05),抑菌直径达到2.833 cm。因此,选择BPY培养基作为诱变株AR7发酵的种子培养基。
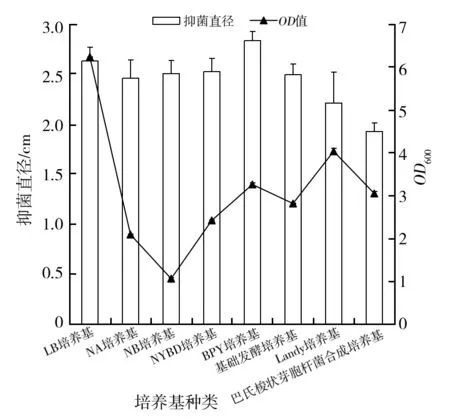
图4 不同培养基对诱变株AR7抑菌直径和OD600的影响Fig.4 Effects of different media on the antibacterial diameter and OD600of the mutant AR7
2.4.2 无机盐的筛选 由图5可知,以K2HPO4为无机盐成分,诱变株AR7的OD600最大可达4.630(P>0.05),抑菌直径为2.479 cm,而相较于磷酸氢二钾和氯化钙,对照组(NaCl)菌株AR7对病原菌的抑菌直径为2.821 cm,差异显著(P<0.05),因此选择NaCl作为菌株AR7抗菌物质产生的无机盐成分。

图5 不同无机盐对诱变株AR7 抑菌直径和OD600的影响Fig.5 Effects of different inorganic salts on the bacteriostatic diameter and OD600 of mutant AR7
2.4.3 氮源的筛选 由图6可知,诱变株AR7在以黄豆饼粉为氮源时,细胞OD600最大值为8.190(P>0.05),在以酵母浸粉为氮源时,细胞OD600值为4.553,抑菌直径2.875 cm(P>0.05),而在含硫酸铵和尿素的培养基中,诱变株AR7不生长(P<0.05)。因此,选择酵母浸粉作为诱变株AR7抗菌物质产生的最佳氮源。

图6 不同氮源对诱变株AR7 抑菌直径和OD600的影响Fig.6 Effects of different nitrogen sources on the bacteriostatic diameter and OD600 of the mutant AR7
2.4.4 碳源的筛选 由图7可知,相较于蔗糖、可溶性淀粉和甘露醇,诱变株AR7在以葡萄糖为碳源的培养基中,细胞OD600值最大可达4.296(P>0.05),其抑菌直径最大为2.867 cm(P<0.05)。其次为蔗糖,OD600值最大可达4.200,抑菌直径最大为2.717 cm。因此,选择葡萄糖作为诱变株AR7抗菌物质产生的最佳碳源。

图7 不同碳源对诱变株AR7 抑菌直径和OD600的影响Fig.7 Effects of different carbon sources on the bacteriostatic diameter and OD600 of the mutant AR7
2.4.5 培养基的分配比优化 正交试验优化了适宜解淀粉芽胞杆菌诱变株AR7生长的碳、氮源和无机盐离子的浓度配比(表2)。结果表明,6号处理的生物量和抑菌直径均显著高于其他处理及对照组(CK)(P<0.05),其OD600值为5.543,抑菌直径达3.027 cm。因此,最适宜诱变株AR7生长的碳源、氮源和无机盐浓度配比组合为葡萄糖10 g/L,酵母浸粉25 g/L,NaCl 5 g/L。
2.5 不同搅拌转速对诱变株AR7发酵的影响
按照1.2.4方法对诱变株AR7进行5 L罐发酵,测定不同搅拌转速下该菌的活菌数和糖耗。由图8可知,搅拌转速为100 r/min时,诱变株AR7生长缓慢,0~28 h葡萄糖的比消耗速率仅为0.307 g/(L·h),发酵50 h达到最大活菌数为0.697×109cfu/mL。将转速提高至200 r/min,诱变株AR7生长速率加快,0~28 h葡萄糖的比消耗速率为0.445 g/(L·h),发酵24 h最大活菌数为1.65×109cfu/mL,活菌数提高约2倍。
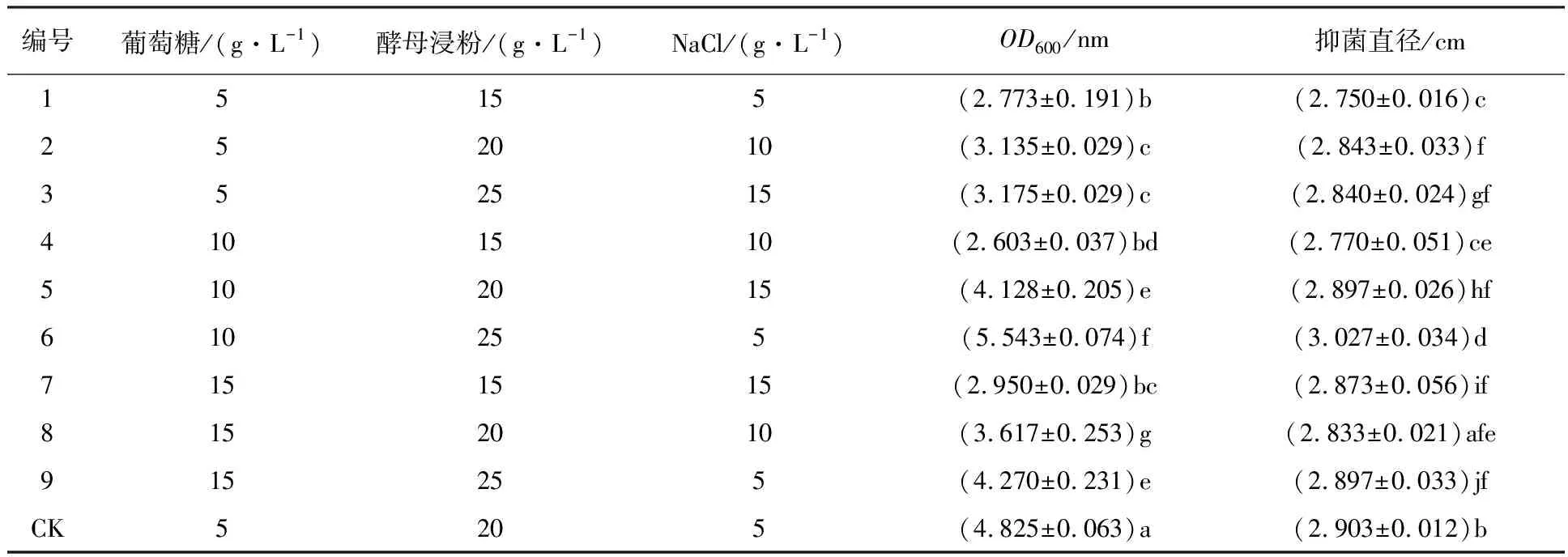
表2 诱变株AR7对尖胞镰刀菌抑制作用最优培养基正交试验结果
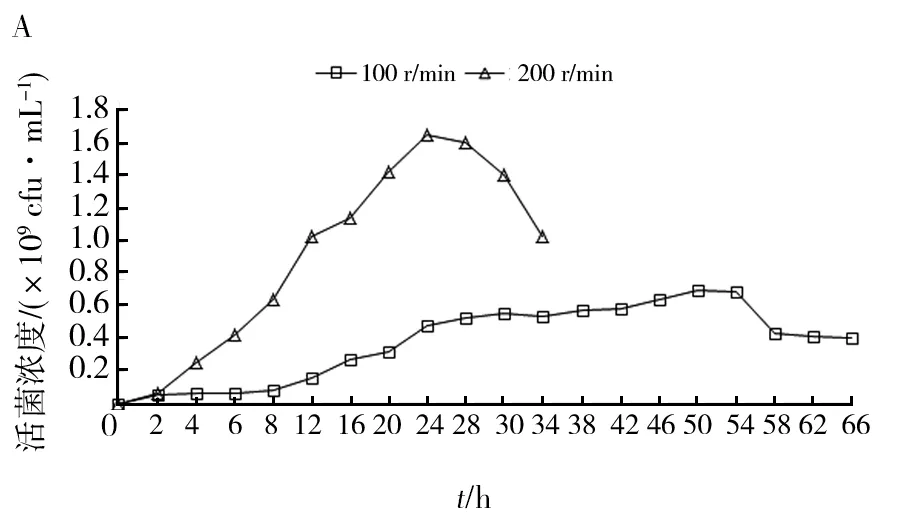
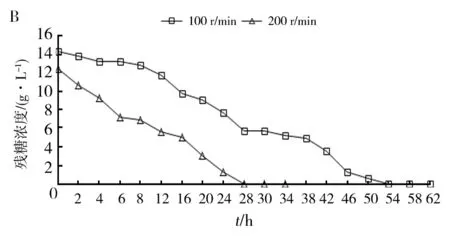

图8 不同搅拌转速下AR7的活菌数(A)、 残糖浓度(B)及溶氧值(C)变化曲线图Fig.8 Variation curve of the number of viable bacteria (A), residual sugar concentration (B) and dissolved oxygen value (C) of AR7 under different agitation speeds.
3 讨 论
ARTP介导的细胞诱变会产生更多的随机突变位点,且不易使突变位点产生耐受性,该特性已被应用于工业微生物,如提高纤维素酶[10]、阿维拉霉素[11]、木糖醇[12]等物质的产量。本研究通过ARTP筛选出1株拮抗功能优化菌株,其对禾谷镰孢菌的抑制效果较原菌株提升了33.15%。等离子体法相较于传统的诱变方法[13-14]具有更多的能量和质量的特性,这些特性会对核苷酸水平的细胞分子结构产生更大的破坏,并增加活性化学物质对DNA错配的影响,这些化学物质可能会破坏细胞壁和细胞膜,进而破坏DNA分子[15],使得诱变初期的致死率持续增加并趋向于100%,呈现先升后降再上升的趋势,这与罗玮等[16]的研究结果一致,推测可能与细胞的损伤修复机制(SOS)有关,SOS作为一个程序化的DNA修复调控网络,LexA(阻遏蛋白)和RecA蛋白在细胞修复过程中起着关键作用[17],SOS修复机制可以导致DNA恢复和遗传变异,从而促进胁迫条件下细菌的进化,但修复后保真度较低,随着诱变时间的延长,染色体损伤加剧,致死率会再次升高。
本研究筛选得到的初始种子培养基为BPY培养基,通过单因素试验优化种子培养基得到的诱变株AR7最适生长和产生抑菌物质的发酵培养基为葡萄糖10 g/L,酵母浸粉2.5 g/L,NaCl 5 g/L。在发酵培养基的优化过程中,不同于李丽等[18]的研究,诱变株AR7分别在以2%的硫酸铵和尿素为氮源的培养基中均无法生长,而在以2%酵母浸粉为氮源的培养基中抑菌效果最佳,表明诱变株AR7对氮源的种类具有选择性。通过对培养基各组分进行正交试验,发现培养基中各组分的分配比对芽胞杆菌的OD600值和抑菌效果有着显著的影响,这与对于解淀粉芽胞杆菌HAB-7的报道一致[19]。通过5 L发酵罐初步研究了诱变株AR7的发酵工艺,在200 r/min的转速下,诱变株AR7的活菌数可达1.65×109cfu/mL。
通过ARTP技术构建生防型菌株是一种较为新颖的方式,同时为生防型菌剂的开发提供了参考。后续可在5 L罐发酵过程中,进一步优化补料、pH控制剂及消泡等参数对发酵的影响。

