湖北省蔬菜根际土壤中的镰孢菌分布特征
房庆 唐柳 谢原利 张怡静 石雪 黄文坤 彭焕 彭德良兰阿峰 孔令安
(1. 陕西理工大学 生物科学与工程学院,汉中 723000;2. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京100193;3. 湖北省植物保护总站,武汉 430070)
镰孢菌(Fusariumspp.)是一类重要的真菌,具有种类多、易变异、种内生理分化明显等特点,一直以来都被认为是最难鉴定的真菌类群之一。镰孢菌具有重要的经济意义,广泛分布于自然界中,以兼性寄生或腐生方式生活。有些镰孢菌可侵染多种植物引起病害,对农业生产造成严重的危害。据美国植物病理学会对101种重要经济作物病害的报道,至少有一种镰孢菌病害的作物达到81种以上;对巴拿马香蕉生产造成了毁灭性灾害的香蕉萎蔫病由尖孢镰孢菌(F. oxysporum)引起[1];由尖孢镰孢菌与大豆孢囊线虫(Heterodera glycines)复合侵染引起的大豆枯萎病对大豆的危害也日渐严重[2],可见镰孢菌病害对植物危害的严重性。此外,有些镰孢菌属真菌可直接侵染人和动物,引起疾病的严重发生,尤其是在动物体免疫系统低下的情况下,如食道癌患者和艾滋病患者更易于遭受镰孢菌的侵染;更为重要的是,禾谷镰孢菌(F. graminearum)和黄色镰孢菌(F. culmorum)等多种镰孢菌属真菌在生长过程产生脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)和雪腐镰刀菌烯醇(Nivalenol,NIV)等毒素,引起人畜癌症和生长缺陷疾病,甚至危及人和动物的生命安全[3]。
但有些镰孢菌属真菌对人类是非常有益的,如有的镰孢菌菌株可作为生防菌,如非致病性尖孢镰孢菌npfo和CS-20[4-5]菌株在防治番茄、西瓜等作物枯萎病中已经得到广泛应用;有的镰孢菌可分解自然界中的纤维素,降解有机物;有的镰孢菌还能分泌可促进动植物生长的促进剂[6-7]。可见,镰孢菌属真菌在农业生产、生防、环保、工业生产等领域的重要作用。
在我国,人们非常重视镰孢菌种类鉴定及其引起的植物病害研究,同时也开展了筛选鉴定潜在的生防镰孢菌的相关工作。人们对山西镰孢菌进行了较为系统的研究,从罹病植株、不同类型土壤和自然保护区土壤中分离鉴定了镰孢菌300余株,并进行了系统分类[8]。本研究针对湖北省13个地级市蔬菜产区的蔬菜根际土壤样品,进行镰孢菌的分离与鉴定,以明确湖北省蔬菜产区的镰孢菌种类和分布规律,旨为蔬菜镰孢菌病害的科学防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 土样采集 于2017夏季-2018年夏季从湖北省13个地级市蔬菜产区随机采集根际土壤(涵盖不同种植方式、不同蔬菜种类、不同种植年限),采用5点取样法,采集时先用菜田土壤擦拭采样工具,然后拨去地表枯叶,用抖落法从种植期作物根部附近2 mm内取样,每个取样点的5份土样混在一起,充分混匀,取约2.5 kg装入采样布袋,记录采样地点、时间、前后茬蔬菜种类(大棚蔬菜记录棚龄)等信息[9]。
1.1.2 真菌分离 采用稀释涂布法和单菌落挑取法进行分离和纯化[10]。(1)马铃薯-蔗糖培养基(PSA)平板的制备,配制氯霉素(抑制革兰氏阳性菌)和链霉素(抑制革兰氏阴性菌)母液,浓度分别为40 mg/mL和300 mg/mL;将两种抗生素母液按1∶1的比例混匀备用;待PSA培养基温度降至50℃时,按1∶1 000比例将混合抗生素加入PSA培养基内,摇匀,制作PSA平板。(2)最佳稀释倍数的摸索:称取土壤样品10 g,置入400 mL烧杯中,加入90 mL无菌水,充分搅拌,制备土壤悬浮液母液,然后制备200倍、400倍、1 000倍稀释液,依次吸取200 μL梯度稀释液,分别涂布于PSA平板,置于26℃恒温培养箱,第4天开始调查记录菌落数,确定最佳稀释倍数;(3)土样中真菌的分离:如前所述,制备土壤悬浮液母液,稀释到最佳稀释倍数,吸取200 μL土壤稀释液涂布于PSA平板,置于26℃培养箱,待菌落长出,及时挑菌于PSA平板,进行真菌的分离、纯化培养。
1.2 方法
1.2.1 真菌基因组DNA的微量提取 参考CTAB法[11]。收集20 mg新鲜菌丝至2 mL离心管中,加入650 μL 2% CTAB,充分研磨样品,65℃水浴30 min;12 000-13 000 r/min离心10 min,吸取上清,加入等体积的氯仿-异戊醇(24∶1),混匀,12 000-13 000 r/min离心10 min;吸取350 μL上清,加入700 μL(两倍体积)无水乙醇,12 000-13 000 r/min离心5 min;弃上清,沉淀用75%酒精洗涤2次,充分晾干;加入100 μL灭菌水,待沉淀溶解,放在-20℃保存或者4℃备用。
1.2.2 镰孢菌的分子鉴定
1.2.2.1 分子鉴定引物 本研究所用的通用引物和特异性引物序列见表1[9-12]。

表1 引物序列及相关信息
1.2.2.2 PCR 扩 增 PCR 扩 增 体 系(50 μL):10×Buffer 5 μL、2.5 mol/L dNTP 4 μL、正向引物(10 μmol/L)和反向引物(10 μmol/L)各 1 μL,Taq 酶0.5 μL,DNA 模板 2 μL,用灭菌水补足至 50 μL。试剂均购自TaKaRa公司。PCR反应程序:94℃预变性4 min,94℃变性30 s,56-62℃(退火温度依据引物决定)退火30 s,72℃延伸1 min,35个循环,72℃延伸10 min,4℃保存。PCR产物检测方法:取8 μL产物,在1%琼脂糖凝胶内100 V电泳30 min,用紫外凝胶成像系统观察、拍照。
1.2.2.3 测序 使用TEF1αF/TEF1αR对目标镰孢菌进行PCR扩增;使用DNA回收试剂盒进行PCR产物回收纯化(天根,DP209);回收产物送中国农业科学院作物科学研究所进行测序,测序结果登录NCBI进行BLAST分析。
1.2.3 与尖孢镰孢菌的拮抗测试 将分离纯化的菌株,接种至PSA平板,与病原菌尖孢镰孢菌番茄专化型(F. oxysporumf. sp. lycopersici)菌株进行对峙培养。第3 天开始观察靶标菌株对尖孢镰孢菌番茄专化型菌株的拮抗效果。
2 结果
2.1 最佳稀释倍数确定
将200倍、400倍和1 000倍的土样悬浮液分别涂布PSA平板,第4天和第5天,涂布200倍稀释液的PSA平板上的菌落过密无法计数,不适宜挑取单菌落;涂布400倍稀释液的PSA平板上的单菌落约为30个,单菌落数量适中适宜挑取;而涂布1 000倍稀释液的PSA平板上的单菌落约为20个,单菌落数量略少。由此确定最佳稀释倍数为400倍(图1、表2)。

图1 第5 d时不同稀释倍数土样悬浮液涂布PSA平板的菌落
2.2 镰孢菌分离、鉴定
按照400倍稀释浓度,对55份土样进行分离真菌,共获得1 388株菌株(表3),使用镰孢菌通用引物F 1和F 2进行特异性PCR扩增,发现其中271株菌株能够检测到1 000 bp左右的特异性目标条带(图2),表明鉴定到镰孢菌271株,占分离菌株总数19.5%。
2.3 测序鉴定镰孢菌的种类
对271株候选镰孢菌,通过镰孢菌测序通用引物TEF1αF/TEF1αR进行PCR扩增,对PCR产物进行测序鉴定。分析测序结果发现其中118株为尖孢镰孢菌、46株为木贼镰孢菌(F. equiseti)、45株为共享镰孢菌(F. commune)、31株为茄病镰孢菌(F.solani)、11株为藤仓镰孢菌(F. fujikuroi)、6株为镰孢霉菌(F. delphinoides)、5株为轮纹镰孢菌(F.concentricum)、3株为三线镰孢菌(F.tricinctum)、6株为镰孢菌属(Fusariumspp.)(表4)。
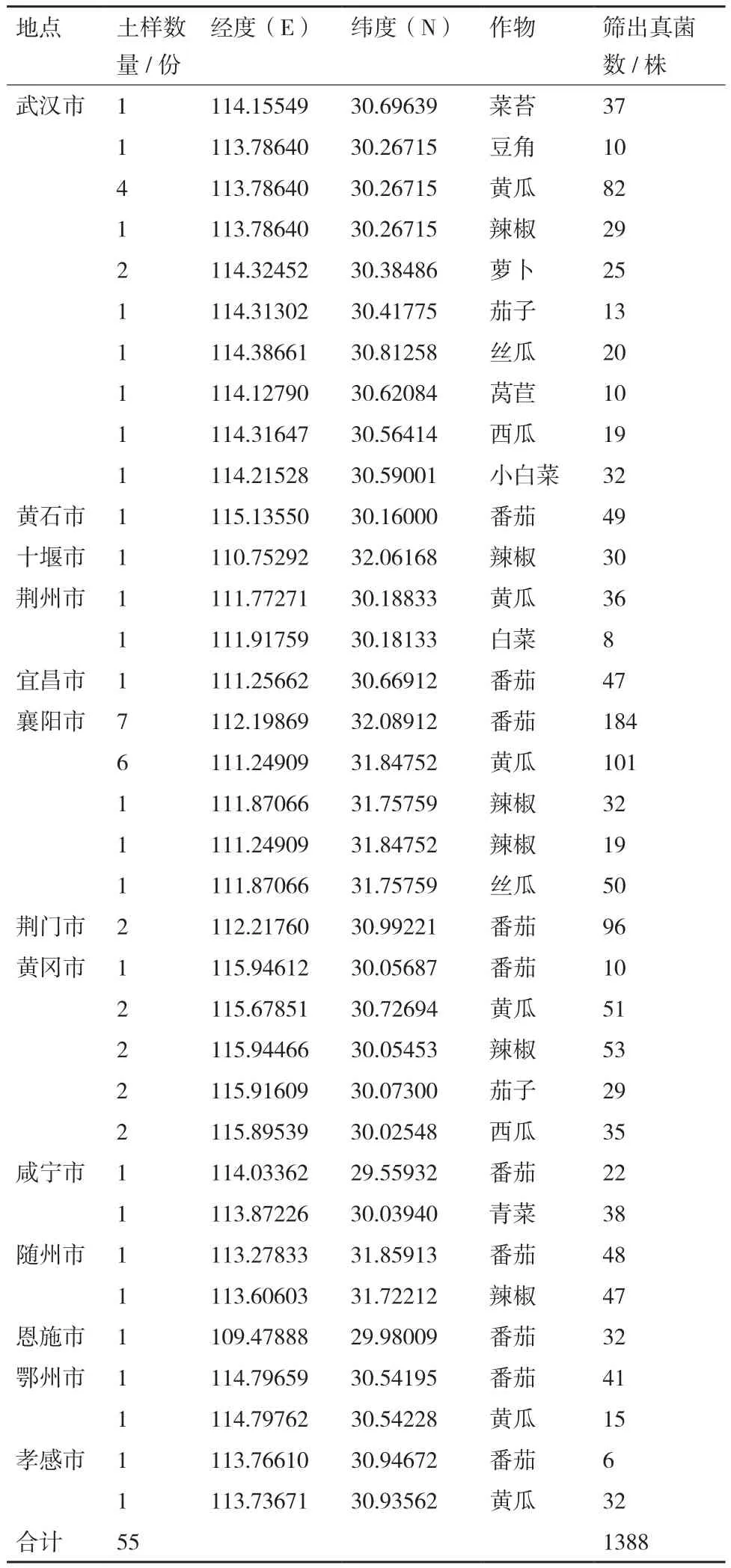
表3 湖北省13个地区土样采集的蔬菜种类及真菌分离数量
为进一步验证TEF1αF/TEF1αR测序结果的可靠性,用镰孢菌种特异性引物进行验证。随机挑选测序鉴定为尖孢镰孢菌25株、茄病镰孢菌14株进行验证,使用尖孢镰孢菌种特异性引物FO 1和FO 2,茄病镰孢菌种特异性引物FS 1和FS 2分别进行特异性PCR扩增,分别检测到约700 bp和300 bp的特异性目标条带(图3),与通用引物TEF1αF/TEF1αR测序鉴定结果一致,一致率100%。

图2 镰孢菌通用引物特异性筛选
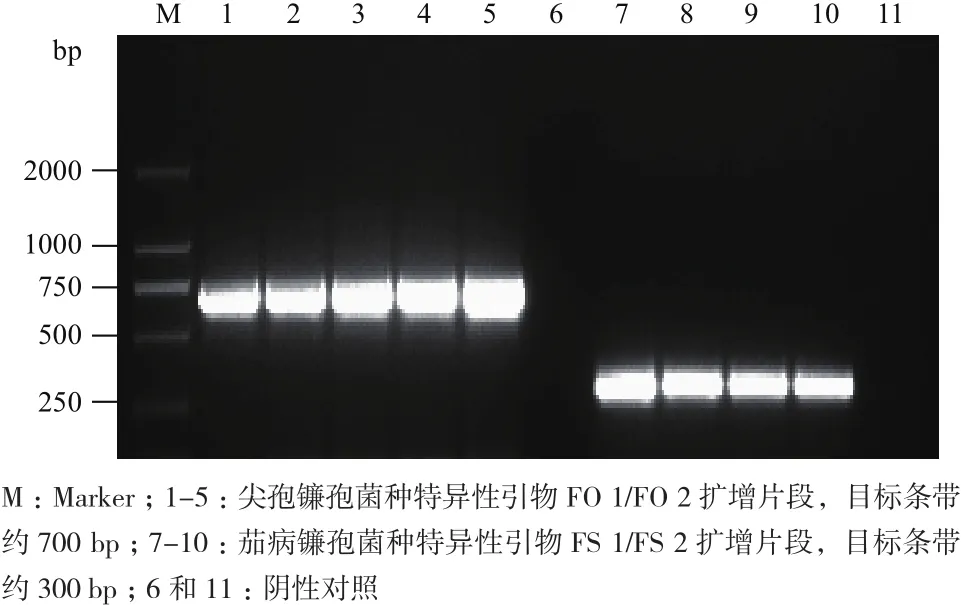
图3 尖孢镰孢菌和茄病镰孢菌特异性PCR扩增
2.4 镰孢菌的分离频率
通过对271株镰孢菌测序结果的统计分析,得出各类镰孢菌的分离频率,其中尖孢镰孢菌占分离菌株43.6%;木贼镰孢菌占17.0%;共享镰孢菌占16.6%;茄病镰孢菌占11.4%;藤仓镰孢菌占4.1%;镰孢霉菌占2.2%;轮纹镰孢菌占1.8%;三线镰孢菌占1.1%;镰孢菌属占2.2%;其中尖孢镰孢菌分离频率最高,为43.6%(表4),接近分离镰孢菌菌株总数的一半;结果表明尖孢镰孢菌是湖北省蔬菜产区的优势镰孢菌。
2.5 拮抗镰孢菌的筛选
将分离纯化的镰孢菌菌株与尖孢镰孢菌番茄专化型菌株进行对峙培养,结果发现与尖孢镰孢菌番茄专化型菌株拮抗的镰孢菌共有16株,其中尖孢镰孢菌和茄病镰孢菌均为4株;轮纹镰孢菌和三线镰孢菌均为3株;木贼孢菌和藤仓镰孢菌均为1株(图 4)。

表4 湖北省13个地级市土样中分离镰孢菌的种类和数量

图4 与尖孢镰孢菌番茄专化型菌株拮抗的镰孢菌
2.6 作物种类与镰孢菌种群
通过分析11种蔬菜的根际土壤与271株镰孢菌的鉴定结果,发现不同种类蔬菜的根际土壤中检测到镰孢菌种群数量差异明显(表5),其中番茄根际土壤中检测到9种镰孢菌;黄瓜根际土壤中检测到7种镰孢菌;辣椒根际土壤中检测到5种镰孢菌;菜台、萝卜、丝瓜根际土壤中均检测到4种镰孢菌;青菜根际土壤中检测到3种镰孢菌;豆角根际土壤中检测到2种镰孢菌;白菜、茄子和小白菜根际土壤中均只检测到1种镰孢菌。

表5 作物种类与分离菌株的种类和数量
3 讨论
首次比较系统研究了湖北省蔬菜产区镰孢菌的种类及分布特征,发现镰孢菌至少分为9个种,其中尖孢镰孢菌是湖北省蔬菜产区镰孢菌中的优势种,表明湖北省境内镰孢菌种群丰富。俞大绂[13]、李明远[14]、张汝洋[15]、蓝江林[16]和费诺亚等[17]分别从不同作物中鉴定出的病原菌多为镰孢菌,表明镰孢菌已经成为农业生产上的重要病原菌之一;吴安忠等[18]研究发现共享镰孢菌是引起福建省三明市主要烟区烟草根腐病的主要病原菌;曾莉莎等[19]研究发现我国香蕉上存在丰富的镰孢菌种类,已分离的枯萎病病原菌广泛分布在3个尖孢镰孢菌谱系中;荸荠枯萎病和荷花腐败病病原菌为共享镰孢菌[20];北京南口甘蓝枯萎病的病原菌为尖孢镰孢黏团专化型(F. oxysporumf. sp. conglutinans)[14];黑龙江和安徽大豆根腐病的优势种为茄病镰孢菌[14,21];我国遭受毁灭性病害的各个西瓜产区,其病原菌以尖孢镰孢西瓜专化型(F. oxysporumf. sp. niveum)为优势种[16]。众多研究结果表明镰孢菌的危害范围日趋增大,危害程度愈发严重。
从湖北省13个地级市蔬菜根际土壤中分离的镰孢菌中的优势种为尖孢镰孢菌,但不同市区的优势菌种存在差异。武汉市、襄阳市的优势菌种为尖孢镰孢菌;随州市优势菌种为共享镰孢菌;荆门市优势菌种为木贼镰孢菌。造成这些差异的原因可能是:不同地区的温度、湿度等气候差异影响镰孢菌种类的生长[22];不同分离培养基(通用培养基或选择性培养基)、分离方法等其他因素[23]。同时,各地区镰孢菌种群组成不同,说明镰孢菌的分布也具有一定的地域性。
本次研究发现不同种类蔬菜的根际土壤中分离出的镰孢菌种类及丰富度存在差异,同时,相同地区不同田块镰孢菌的种群也有差异。造成这些差异的原因可能是(1)土样品质不同[24],研究发现从相邻田块采集的沙土和水田里的土样中分离到的镰孢菌种类存在差异;(2)作物品种不同,各地区推广种植的作物品种不同,对镰孢菌的选择压力不同,导致镰孢菌的变异速度不同[25-26];(3)田间的耕作制度不同[25]等。
本研究明确了湖北省13个地级市蔬菜地区镰孢菌的种群类别和分别特征,筛选出部分与致病菌尖孢镰刀菌专化型的拮抗菌株,研究结果为蔬菜镰孢菌病害的防治提供科学依据。
4 结论
从湖北省13 个地级市蔬菜产区采集根际土壤样品55 份中分离获得271 株镰孢菌(Fusariumspp.)菌株;通过镰孢菌特异性引物扩增、测序等分子生物学技术,鉴定出118株尖孢镰孢菌(F.oxysporum),46 株木贼孢菌(F. equiseti),45 株共享镰孢菌(F. commune),31株茄病镰孢菌(F.solani),11 株 藤 仓 镰 孢 菌(F. fujikuroi) ,6 株 镰孢霉菌(F. delphinoides),5 株轮纹镰孢菌(F.concentricum),3 株三线镰孢菌(F. tricinctum)和6株镰孢菌属(Fusariumspp.)菌株,明确了湖北蔬菜产区镰孢菌(Fusariumspp.)的优势种为尖孢镰孢菌(F. oxysporum);通过与致病菌尖孢镰孢菌番茄专化型(F. oxysporumf. sp.lycopersici)菌株进行对峙培养,筛选出拮抗镰孢菌16 株。
致谢:本研究所用尖孢镰孢菌番茄专化型菌株由中国农科院蔬菜花卉研究所茆振川老师提供,特此表示感谢。

