约氏疟原虫与伯氏疟原虫诱导感染小鼠产生保护性抗体的特点研究
丁 祎, 张铭宇, 庞 维, 郑 丽, 曹雅明
(中国医科大学 基础医学院免疫教研室,辽宁 沈阳 110122)
疟疾是疟原虫通过媒介昆虫蚊传播的威胁人类最为严重的寄生原虫感染性疾病[1]。随着氯喹、青蒿素等一线抗疟药物的普遍应用,疟疾得到了很好地控制[2-5]。但是流行区人群普遍存在的混合感染,以及难以抵御疟原虫的再次感染,成为根除疟疾的一大难点。疟原虫保护性免疫的研究证实,感染早期宿主建立Th1型免疫应答,产生IFN-γ和NO,巨噬细胞活化等免疫效应,能够控制感染早期疟原血症的增长。感染后期向Th2型免疫应答的过度,是宿主根除疟原虫的关键[6]。抗体是获得性免疫的主要组成成分,在保护机体抵抗疟原虫感染中起重要的作用。疟原虫感染宿主后,机体会产生大量针对疟原虫的特异性抗体,抗体水平、时间的维持,以及是否产生以拮抗疟原虫侵入为主要功能的抗体,可能是决定宿主抵抗疟原虫感染的根本原因[7]。抗体也是再次免疫应答的重要免疫分子,在抵抗疟原虫再次感染以及交叉感染中发挥重要作用[8-9]。流行区患者对疟原虫再次感染以及交叉感染抵御能力不足,可能与宿主产生的抗疟原虫特异性抗体的类型与种类有关。对宿主特异性抗体特点的研究,确定感染过程中虫体作为重要微生物抗原刺激机体产生抗体的差异,无疑为疟疾感染保护性免疫应答的阐明提供重要的理论依据。本研究运用两种不同虫株的鼠疟原虫(约氏疟原虫与伯氏疟原虫)分别感染BALB/c小鼠,通过氯喹和青蒿素联合应用治愈小鼠后,再次感染小鼠,构建小鼠同种疟原虫感染的二次感染模型。获得小鼠初次与再次免疫血清,比较抗体产生水平及特点,对免疫血清中优势抗体进行抗原追踪,确定诱导机体产生优势抗体的抗原特点,探讨抗原对宿主建立保护性免疫的影响与意义。
1 材料与方法
1.1 材料
1.1.1 实验小鼠及虫株 6~8周龄、雌性BALB/c小鼠购自北京维通利华。约氏疟原虫 (Plasmodiumyoelii)(P.y17XL)、伯氏疟原虫 (Plasmodiumberghei)(P.bANKA) 由日本爱媛大学分子寄生虫学教研室惠赠。
1.1.2 培养基 LB液体培养基。
1.1.3 主要试剂及仪器 96孔酶标板、包被液、终止液、5×SDS凝胶加样缓冲液和Tween-20购自北京鼎国昌盛生物技术有限公司;HRP-Goat antimouse IgG购自AB clonal;甲醇和NaCl购自国药集团化学试剂有限公司;Tris、Glycine、SDS和BSA购自美国Genview公司;SDS-PAGE凝胶配制试剂盒和TMB显色液购自上海碧云天生物技术有限公司;Super Signal West Pico试验试剂盒和蛋白Marker购自Thermo;脱脂奶粉购自美国BD公司;酶标仪购自BIO-RAD;ECL发光仪购自上海天能科技有限公司。
1.2 方法
1.2.1 实验动物分组与感染 将BALB/c小鼠按照随机原则分为3组。第1组小鼠不做处理,为正常对照组(Control);第2组小鼠经腹腔感染1×106P.y17XL寄生的红细胞;第3组小鼠经腹腔感染1×106P.bANKA寄生的红细胞。小鼠感染后第5天,进行氯喹加青蒿素灌胃治疗,感染后不同时间采取小鼠尾静脉血,制备薄血膜,Giemsa染色,镜检计数红细胞感染率。待镜检不能查到感染红细胞,计时35 d后对治愈小鼠再次感染同种疟原虫,构建鼠疟二次感染模型。感染过程中定期尾静脉采血,获得免疫血清。
1.2.2 ELISA方法检测初次感染和再次感染血清中抗疟原虫特异性抗体水平 分别用P.y17XL、P.bANKA抗原5 μg/mL包被酶标板100 μL/孔,37 ℃过夜,洗板后5% BSA 300 μL/孔 37 ℃封闭1 h,洗板后加入相应的抗血清(1∶200稀释)100 μL/孔,37 ℃,2 h,PBST洗板后加入HRP羊抗鼠IgG (1∶5 000稀释)100 μL/孔,37 ℃,1 h,充分洗板加入TMB 200 μL/孔避光30 min后加终止液50 μL/孔,酶标仪450 nm检测吸光度。
1.2.3 Western Blot检测不同鼠疟模型免疫血清反应模式 10%SDS凝胶中分别加入P.y17XL、P.bANKA蛋白50 μg/孔,电泳50 V,30 min,70 V,2 h,将凝胶安装至“三明治”装置后,转膜60 V,2 h,封闭液室温摇床封闭2 h,TBST洗膜3次后加入相应的抗血清(1∶100稀释),4 ℃摇床过夜,TBST洗膜3次后加入HRP羊抗鼠IgG(1∶5 000稀释),室温摇床2 h,TBST充分洗膜后,利用HRP-ECL原理发光。
1.2.4 MSP-1重组蛋白制备 将测序正确的MSP1-pET28a重组质粒在Rosetta感受态细胞中进行转化。倒置平板,37 ℃培养16 h后,挑取含重组质粒的单菌落于3 mL的LB液体培养基(卡那抗性)中,37 ℃摇床培养后,取100 μL菌液接种于100 mL LB液体培养基中,37 ℃摇床培养后,将100 mL菌液加入到2 000 mL LB液体培养基中37 ℃培养至OD600约0.6,降低培养温度到30 ℃,加入适量的IPTG(0.5 mmol)继续震荡培养3~4 h。8 000 r/min离心3 min收集菌体,重悬于50 mL预冷NTA-0缓冲液中,冰浴30 min。超声破碎菌体,参数设置为功率200 W、工作3 s、暂停4 s、时间25~30 min。16 000 r/min,4 ℃离心50 min,收集上清及沉淀。上清蛋白溶液用0.22 μm过滤器过滤备用:准备Ni-NTA柱以1 mL/min的流速上样上清蛋白溶液,以NTA-0缓冲液(pH 8.0)洗柱至流出液不含蛋白(G250检测液不变色);分别以20、60、200和500 mmol咪唑洗脱,分段收集洗脱液至G250检测液不变色;以3倍柱体积去离子水洗涤柱料,以20%乙醇封柱;对收集的洗脱液进行SDS-PAGE电泳检测。
1.2.5 质谱鉴定(LC/MS/MS or Q-E) 将伯氏疟原虫全虫蛋白进行SDS-PAGE电泳后,将55 kD目的条带切下交由华大公司使用Easy-nLC 1 200液相系统、高pH分离液相色谱仪等进行了质谱验证。
1.2.6 统计学处理 应用GraphPad PRISM TM对数据进行统计学分析,数据以均数±标准误表示。2组比较用两独立样本的t检验,3组以上数据运用one-way ANOVA检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 P.y 17XL、P.b ANKA初次感染和再次感染小鼠原虫血症和生存率
P.y17XL初次感染后第3天小鼠原虫血症逐步升高,至第6天原虫血症达到50%。P.y17XL再次感染治愈小鼠,小鼠外周血中无疟原虫感染的红细胞(图1A)。P.bANKA初次感染后第3天小鼠原虫血症开始增高,至第12天原虫血症达到60%。P.bANKA再次感染小鼠后第4天外周血中可见疟原虫感染的红细胞,感染后第5至8天原虫血症低于P.bANKA初次感染组(P<0.05)。P.bANKA再次感染后第9至10天原虫血症下降,第10至15天原虫血症增高并维持在50%~60%(图1B)。P.y17XL初次感染后第5天小鼠开始出现死亡,至第7天时全部死亡。P.y17XL再次感染后小鼠全部存活(图1C)。P.bANKA初次感染后第8天小鼠开始出现死亡,至第12天小鼠全部死亡。P.bANKA再次感染后第11天小鼠开始出现死亡,至第15天小鼠全部死亡(图1D)。
2.2 加强免疫应答的存在
小鼠治愈后再次感染P.bANKA获得的二次免疫血清与P.bANKA全虫抗原具有较好的免疫反应性,与未感染小鼠血清、一次免疫血清都具有显著的统计学差异(P<0.01)。P.y17XL初次感染小鼠后获得的一次免疫血清与P.y17XL全虫抗原有较好的免疫反应,和未感染小鼠血清相比具有统计学差异(P<0.01),小鼠治愈后再次感染P.y17XL获得的二次免疫血清不仅同未感染小鼠血清相比具有统计学意义(P<0.01),同初次感染血清相比也有显著差异(P<0.01)。
2.3 免疫血清与全虫抗原反应的免疫条带特点
P.y17XL再次感染小鼠获得的二次免疫血清与P.y17XL全虫抗原反应后在分子量40 kD附近出现主要反应条带。P.bANKA再感染获得的二次免疫血清与P.bANKA全虫抗原反应后在35~55 kDa范围内出现了3条主要反应条带(图3A)。MSP-1与AMA-1是目前研究疟原虫红内期的领军虫体抗原,通过全虫抗原与抗MSP-1和抗AMA-1抗体反应发现,P.y17XL感染小鼠获得的免疫血清同抗MSP-1抗体具有相似的反应条带,提示P.y17XL感染小鼠刺激免疫系统后诱导了大量针对MSP-1的抗体,而P.bANKA感染小鼠诱导的免疫血清反应模式同P.y17XL截然不同,对这3条主要反应条带55、40以及35 kD进行灰度值测定,比较3条条带的反应强度,但未见有明显统计学意义(图3B),提示P.bANKA具有多种虫体抗原诱导机体产生相应特异性抗体的特点,40 kD附近条带可能为抗MSP-1反应条带,但抗MSP-1抗体不是P.bANKA免疫血清中的优势抗体。
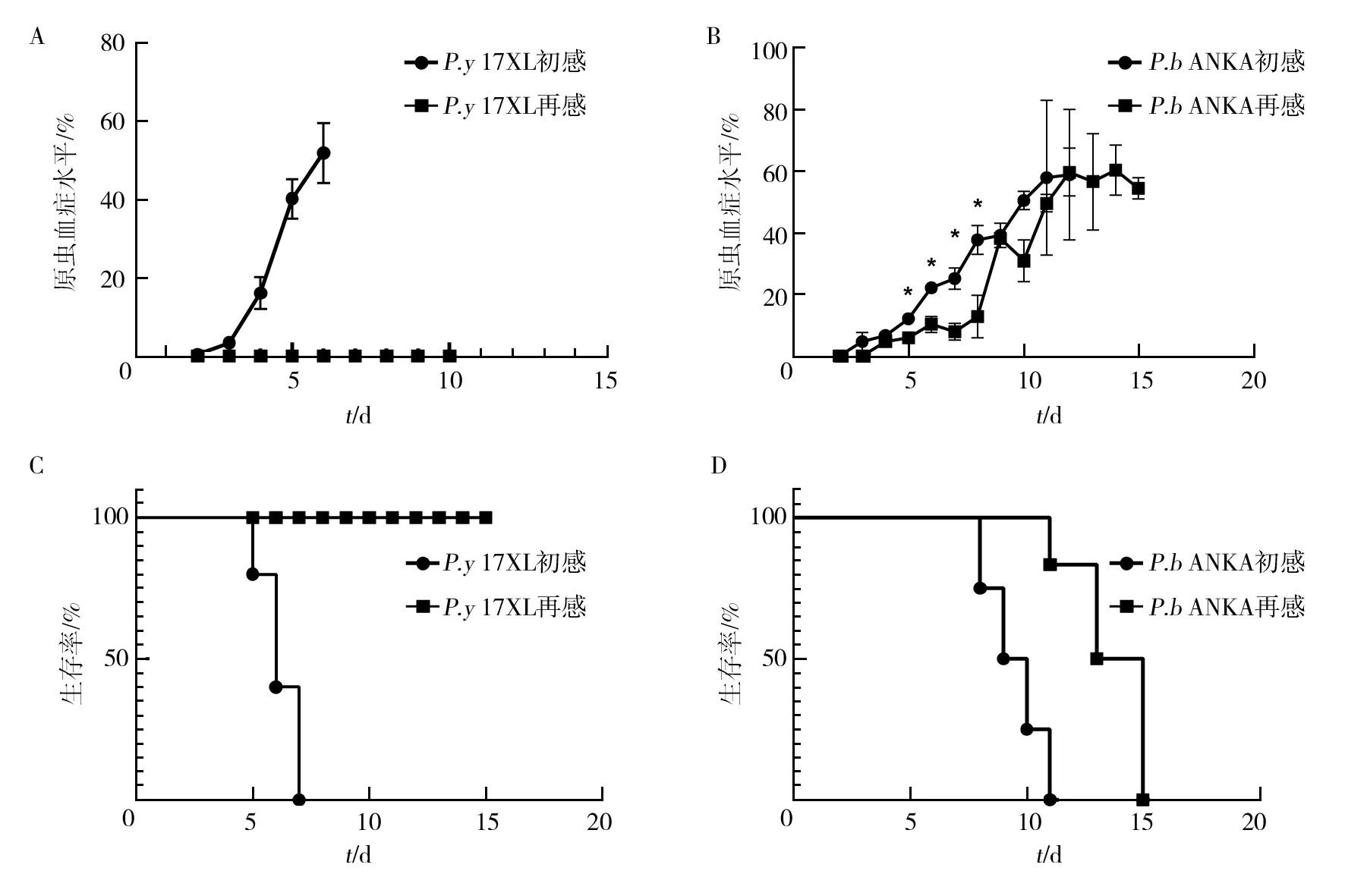
图1 P.y 17XL、P.b ANKA初次感染和再次感染小鼠疟原血症和生存率Fig.1 Parasitemia and survival rate of mice infected with P.y 17XL and P.b ANKA in primary and secondary infection A:P.y 17XL初次感染和再次感染的疟原虫血症;B:P.b ANKA初次感染和再次感染的原虫血症;C:P.y 17XL初次感染和再次感染的生存率;D:P.b ANKA初次感染和再次感染的生存率;*:P<0.05 A:The parasitemia of mice infected with P.y 17XL in primary and secondary infections;B:The parasitemia of mice infected with P.b ANKA in primary and secondary infections;C:The survival of mice infected with P.y 17XL in primary and secondary infections;D:The survival of mice infected with P.b ANKA in primary and secondary infections;*:P<0.05
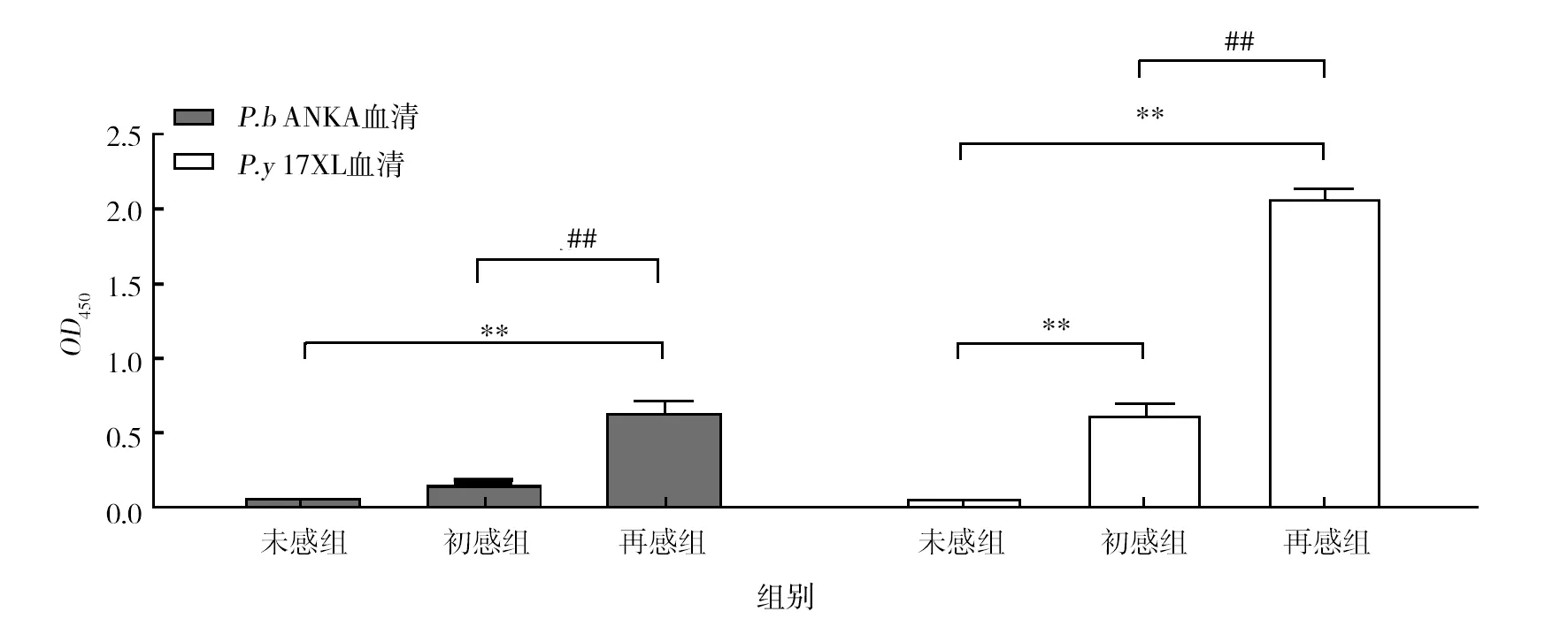
图2 ELISA检测特异性抗体水平Fig.2 ELISA detect specific antibody levels **:与未感组比P<0.01;##:与初感组比P<0.01 **: compared with the uninfluenced group P<0.01 ; ##: compared with the uninfected group P<0.01
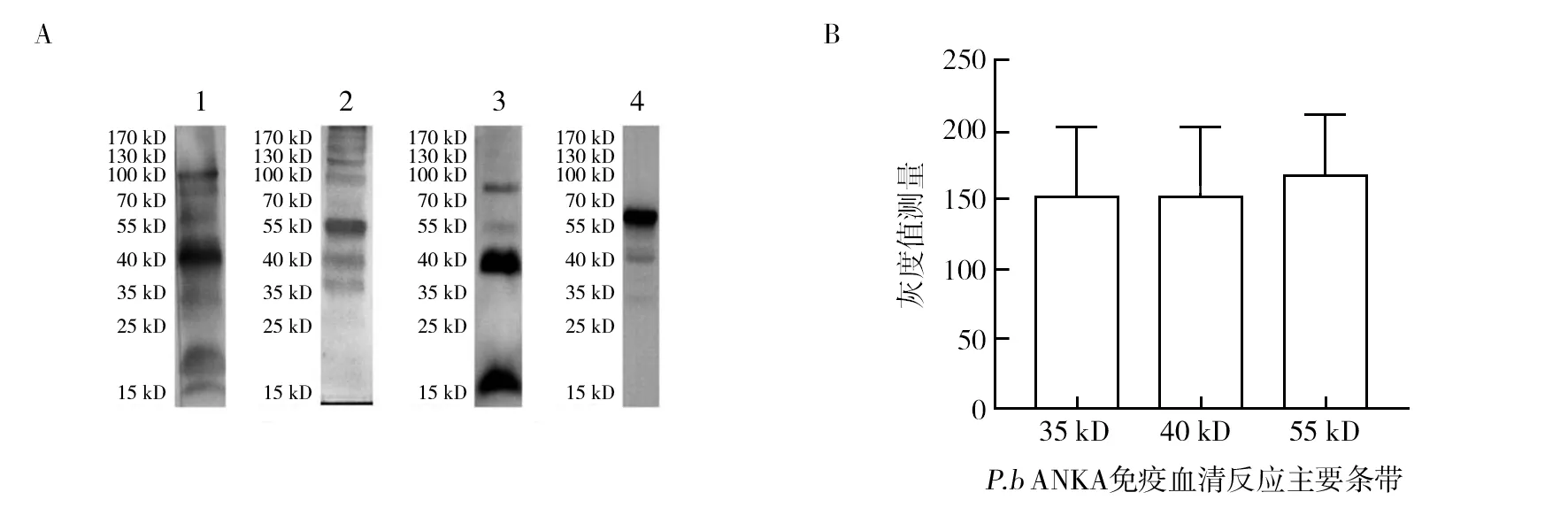
图3 Western Blot检测血清中优势抗体Fig.3 Western Blot detects dominant antibodies in serum A:Western Blot条带,1: P.y 17XL再感血清与P.y 17XL抗原反应, 2: P.b ANKA再感血清与P.b ANKA抗原反应, 3: 兔抗MSP-1抗体与P.y 17XL抗原反应, 4:兔抗AMA-I抗体与P.y 17XL抗原反应;B:灰度值测量 A:Western Blot bands, 1: P.y 17XL re-infection serum reacts with P.y 17XL antigen, 2: P.b ANKA re-infection serum reacts with P.b ANKA antigen, 3: Rabbit anti-MSP-1 antibody reacts with P.y 17XL antigen, 4: Rabbit anti-AMA-1 antibody reacts with P.y 17XL antigen;B: Dominant band gray value
2.4 P.y 17XL、P.b ANKA与同种MSP-1重组蛋白的反应
MSP-1抗原分布于疟原虫裂殖子表面,在疟原虫裂殖子黏附红细胞,侵入红细胞等生理功能中发挥重要的生物学作用。P.y17XL与P.bANKA感染血清与相应的MSP-1重组蛋白反应,同时用未感染血清做对照发现同种疟原虫感染血清与相应重组蛋白具有较强的免疫反应。3组血清与PyMSP-1重组蛋白反应,以P.y17XL感染血清反应最强(P<0.01)(图4A);而与PbMSP-1重组蛋白反应,以P.bANKA感染血清最强(P<0.01)(图4B),提示疟原虫感染过程中,虫体MSP-1抗原能够刺激宿主产生相应特异性抗体。
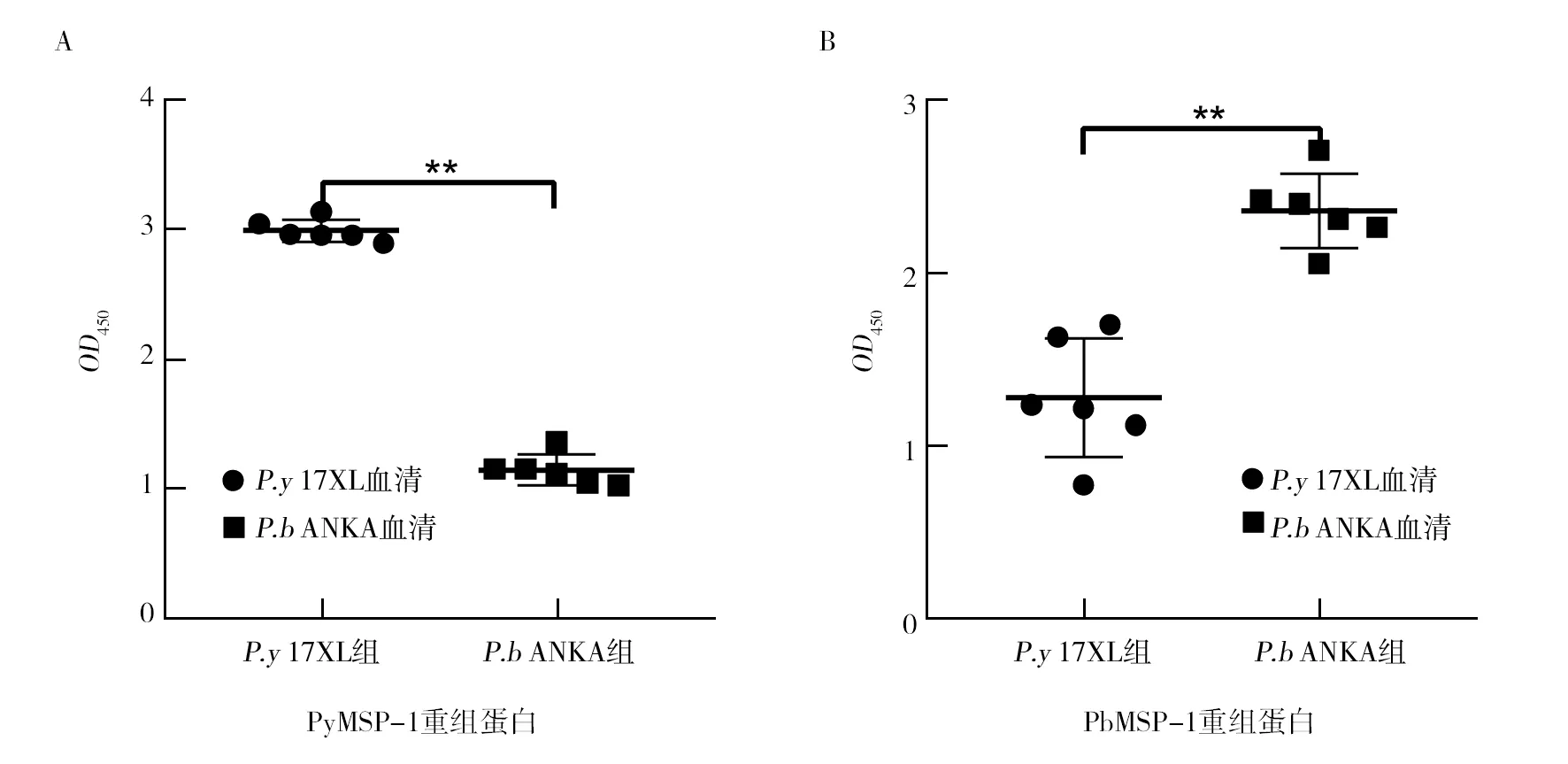
图4 P.y 17XL、P.b ANKA与同种MSP-1重组蛋白的反应Fig.4 Reaction of P.y 17XL and P.b ANKA with the same strain recombinant protein of MSP-1 A:PyMSP-1重组蛋白包板;B:PbMSP-1重组蛋白包板;**: P<0.01 A:PyMSP-1 coating;B:PbMSP-1 coating;**: P<0.01
2.5 P.b ANKA 55 kD蛋白鉴定
P.bANKA再次感染小鼠获得的二次免疫血清与虫体蛋白反应在55 kD出现主要反应条带,通过质谱分析进行蛋白鉴定,发现满足评分较高,在疟原虫红内期表达且具有分泌信号肽或跨膜肽段的抗原有PbANKA_0702800、PbANKA_020920、PbANKA_110220,具有较高可能性刺激小鼠产生特异性抗体(表1)。
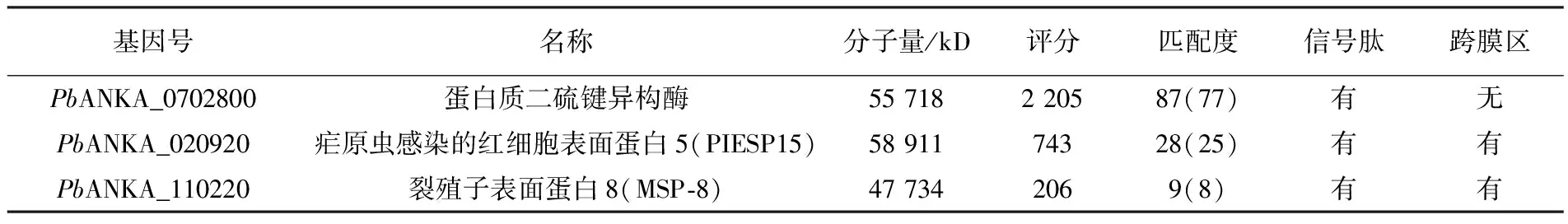
表1 伯氏疟原虫55 kD蛋白候选抗原预测表
3 讨 论
疟疾与结核病、艾滋病被世界卫生组织(WHO)列为优先防御的三大感染性疾病[10-12]。疟原虫发育过程经历肝内期、红内期与蚊内期三个阶段,宿主对红内期疟原虫产生的特异性抗体在降低疟原虫血症和抵御重症疟疾发挥重要作用[13-15]。疟疾流行区患者的反复感染以及交叉感染一直都是目前根治疟疾的重点与难点。在流行区,交叉反应可能在保护宿主和阻止疟疾传播中起重要作用。少数研究报道了产生交叉免疫反应的交叉反应性,但是人们对交叉反应的程度,特别是密切相关的物种知之甚少。有研究调查显示流行区间日疟原虫血液阶段抗原特异性抗体对诺氏疟原虫寄生虫的种间反应性和生长具有抑制活性。结果发现来自免疫动物和人类疟疾患者的针对间日疟原虫抗原的抗体IgG抑制了诺氏疟原虫侵袭红细胞。在血液阶段,抗间日疟原虫与诺氏疟原虫的抗体之间存在广泛的交叉反应性,并且这些抗体可以有效抑制体外侵袭,从而突出了流行地区的潜在交叉保护免疫力[16-18]。抗体是再次免疫应答的重要产物,在疟疾重复感染中有重要的作用[19];由于共同抗原的存在,抗体与不同疟原虫虫株存在一定的交叉反应,抗体对疟原虫混合感染以及不同虫株的感染具有一定的保护性作用[20]。
本研究对疟原虫同种虫株建立的再感染模型进行研究,结果显示疟原虫免疫血清与疟原虫抗原具有较好的免疫反应性,再次应答具有显著的加强效应。免疫血清与MSP-1具有较好的反应性。免疫血清与疟原虫抗原的反应模式显示,P.y17XL主要产生抗MSP-1为主的抗体,这种抗体在宿主抵抗疟原虫再感染中发挥保护性作用,宿主可完全抵抗同虫株疟原虫再感染。P.bANKA除了产生抗MSP-1抗体之外,免疫血清中还具有其他抗疟原虫抗体,因此有效抵抗疟原虫的保护性抗体水平降低,宿主不能抵抗P.bANKA的再次感染,这也可能是P.bANKA再感染模型疟原虫血症稍微降低以及生存期得到较短延长的原因。抗体在疟原虫再感染的保护性免疫中起至关重要的作用;对流行区患者抗体模式的验证以及诱导宿主产生有效抗体无疑为构建疟疾疫苗提供有效的实验性数据。

