弥漫性大B细胞淋巴瘤治疗中利妥昔单抗耐药与Smarcal1、PP2A-B55-α、PP2A-B56-α蛋白表达的相关性*
刘静,邓槿,顾季炜,马欣玥,宋国齐,2b
(1.南通大学医学院,江苏南通226001;2.南通大学附属医院 a.检验科,b.血液科,江苏南通226001)
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是成人非霍奇金淋巴瘤(NHL)最常见的亚型,每年约占新诊断NHL病例的25%~35%,是一种高度侵袭性疾病,其免疫表型、遗传学、临床表现及预后都极具异质性[1-2]。目前,临床使用的利妥昔单抗联合环磷酰胺、蒽环类、长春新碱及泼尼松(R-CHOP)一线治疗方案虽明显改善了DLBCL患者的预后,但仍有部分包含双打击/三打击(伴有MYC和BCL2/BCL6重排)的患者表现出对利妥昔单抗耐药,预后差[3]。目前国内外对于双打击/三打击淋巴瘤(DHI/THL)尚无统一、有效的治疗方案。因此,了解利妥昔单抗获得性耐药的机制对于提高利妥昔单抗疗效以及改善预后具有至关重要的意义。Smarcal1是一种DNA重塑蛋白质,它可以通过稳定、修复和重启停滞的复制叉以应对MYC等癌基因诱导的DNA复制压力。Puccetti等[4]发现,Smarcal1缺乏会减慢转基因小鼠(Eμ-myc)淋巴瘤形成并提高生存率。B56-α及B55-α为PP2A调节亚基,研究发现,B56α-PP2A全酶在DT-061(SMAP)特异性结合下,可选择性地对c-Myc去磷酸化,从而诱导细胞死亡和抑制肿瘤生长[5]。有学者还发现,Eya3可通过B55-α调控c-Myc中pT58去磷酸化过程促进肿瘤进展[6]。本研究拟参照Jazirehi等[7]的研究,采用“梯度加药法”诱导DLBCL细胞系耐药并进行验证;检测亲本及耐药细胞系中Smarcal1、PP2A-B55-α和PP2A-B56-α蛋白表达变化;进一步干扰耐药细胞系中Smarcal1、PP2A-B55-α的表达以及过表达PP2A-B56-α,评估其对利妥昔单抗敏感性改变。
1 材料与方法
1.1主要试剂与仪器 健康人血浆(南通大学附属医院体检健康者),RPMI-1640培养基及胎牛血清FBS(美国Gibco公司),SDS-PAGE凝胶配制试剂盒及CCK-8试剂盒(上海碧云天公司),AnnexinV-FITC/PI双染细胞凋亡试剂盒(江苏凯基生物公司),利妥昔单抗注射液(上海罗氏制药公司),鼠抗人PP2A-B55-α单克隆抗体及PP2A-B56-α单克隆抗体(美国Santa Cruz Biotechnology公司),兔抗人 Smarcal1单克隆抗体以及GAPDH单克隆抗体(美国 cell signaling technology公司),sh-Smarcal1、sh-PP2A-B55-α和oe-PP2A-B56-α 以及其阴性转染对照(sh-NC、oe-vector)由广州锐博生物科技公司设计及合成,LipofectamineTM2000 转染试剂以及Trizol 试剂(美国Invitrogen公司)。酶联仪(美国 Biotek公司),流式细胞仪(美国BD公司),蛋白免疫印迹电泳设备及化学发光成像系统(美国Bio-Rad公司),ABI 7500荧光定量PCR仪(美国ABI公司)。
1.2细胞来源及培养 人弥漫大B细胞淋巴瘤细胞系OCI-LY10、OCI-LY18均购自中国科学院细胞库上海保藏中心,取上述生长状态良好的细胞系,培养于含10% FBS、1%青霉素-链霉素的RPMI-1640完全培养基中,置于37 ℃、5% CO2、100%饱和湿度CO2培养箱中常规培养,每2~3 d换液1次,以1 000 r/min离心5 min,重悬于T75 cm培养瓶中,取对数生长期细胞用于后续实验。
1.3耐药细胞系模型的建立 采用“梯度加药法”诱导DLBCL细胞的耐药:分别将处于生长对数期的DLBCL细胞系OCI-LY10、OCI-LY18以5×105/mL的细胞密度接种于含10%新鲜健康人血浆的RPMI-1640培养基中,加入0.5 μg/mL浓度利妥昔单抗,12 h后换完全培养基培养至细胞状态恢复正常(约为4~5 d),在下1个周期将利妥昔单抗的浓度提高至前1个周期的2倍,按此方式重复9个周期后,获得对128 μg/mL利妥昔单抗耐药的淋巴瘤细胞系。
1.4CCK-8法检测细胞存活率 将亲本及耐药细胞系分别重悬于RPMI-1640完全培养基以及含10%新鲜健康人血浆RPMI-1640培养基中,分别接种于96孔细胞培养板中,每孔含细胞为5×104个,分别加入浓度为0、2、10、50 和100 μg/mL利妥昔单抗,每个样本设3个复孔,温育48 h后,按照CCK-8试剂盒说明书操作,在酶联仪上检测450 nm波长处的吸光度(A)值,计算细胞存活率。细胞存活率(%)=[A(加药组)-A(空白组)]/[A(对照组)-A(空白组)]×100。采用SPSS 13.0软件分析药物的半数生长抑制浓度(IC50)值,并计算耐药指数。耐药指数(resistance index,RI)=耐药株IC50/亲本株IC50。
1.5流式细胞术检测调亡 将亲本及耐药细胞系分别重悬于RPMI-1640完全培养基以及含10%新鲜健康人血浆RPMI-1640培养基中,每种细胞系均分为2组:control组(0 μg/mL利妥昔单抗组)和50 μg/mL利妥昔单抗组,每组设3个复孔,置于37 ℃、5%CO2、饱和湿度培养箱内培养。48 h后收集细胞,1 000 r/min离心5 min,PBS冲洗2次,Binding buffer缓冲液重悬细胞,分别加入FITC-AnnexinV和PI染料各5 μL,避光温育20 min, buffer缓冲液补足体积至500 μL。BD流式细胞仪检测细胞凋亡率,采用BD分析软件收集荧光信号,FlowJo软件进行统计分析。细胞凋亡率=早期凋亡率(AnnexinV+/PI-)+晚期凋亡率(AnnexinV+/PI+),实验重复3次。
1.6总蛋白质提取及western blot 收集LY10及LY18的亲本及耐药细胞系,预冷PBS洗涤2次后加入RIPA 蛋白质裂解液,冰浴裂解提取总蛋白质,4 ℃、12 000 r/min离心15 min,吸取上清液采用BCA法测定蛋白质浓度。按照制胶试剂盒说明书,取变性后蛋白质15 μL(30 μg)加入至125 g/L PAGE凝胶中(上层胶恒压 80 V,恒压120 V),电泳结束后在300 mA恒压条件下2 h将蛋白质转移至PVDF膜上,50 g/L脱脂奶粉封闭1 h。加入鼠抗人PP2A-B55-α单克隆抗体(1∶500稀释)、鼠抗人PP2A-B56-α单克隆抗体(1∶500稀释)、兔抗人Smarcal1单克隆抗体(1∶800稀释)以及兔抗人GAPDH单克隆抗体(1∶800稀释) 4 ℃温育过夜。TBST洗膜3次,每次10 min,结束后分别加入HRP标记的羊抗鼠IgG(1∶5 000稀释)和HRP 标记的羊抗兔IgG(1∶5 000稀释)后室温下避光温育2 h,TBST洗膜5次,每次10 min,ECL化学发光法显影后经化学发光成像系统曝光检测目的条带,Image J 4.1 软件对条带进行灰度扫描,GraphPad Prism 8.0软件进行结果统计分析。目的蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值,实验重复3次。
1.7细胞转染 将2株耐药细胞重悬于含10%新鲜健康人血浆的RPMI-1640培养基中,接种于12孔细胞培养板,每孔含细胞为5×104个,按照LipofectamineTM2000说明书操作进行转染,将2株耐药细胞均分为sh-NC组(NC shRNA转染组)、oe-vector组(vector oeRNA 转染组)、sh-Smarcal1组(Smarcal1 shRNA转染组)、sh-PP2A-B55-α组(PP2A-B55-α shRNA转染组)及oe-PP2A-B56-α组(PP2A-B56-α oeRNA转染组),每组设置3个复孔,其中取1个复孔转染24 h 后用于CCK-8法检测(方法同1.4,向耐药细胞及转染后的耐药细胞中分别加入0、2、10、50、100 μg/mL利妥昔单抗),其余2个复孔细胞转染48 h后用于验证蛋白质表达。实验重复3次。
1.8RNA提取、逆转录反应及实时荧光定量PCR(RT-qPCR) 收集实验1.7中转染48 h后的细胞系(约5×106个)于1.5 mL无酶EP管中,各加入1 mL Trizol试剂提取总RNA,NanoDrop 2000超微量分光光度计测定总RNA浓度和比值(A260/280 nm为1.8~2.0)。取1 μg RNA,按照逆转录试剂盒说明书将RNA逆转录为cDNA。样本置于-20 ℃保存。采用RT-qPCR检测各组sh-Smarcal1、sh-PP2A-B55-α及oe-PP2A-B56-α转染耐药细胞系前后的表达水平,根据NCBI参考序列Smarcal1、PP2A-B55-α、PP2A-B56-α(分别为NC_000002.12、NC_000008.11、NC_000001.11),由广州锐博生物科技公司使用Primer Premier 5.0软件设计及合成。Smarcal1上游引物序列:5′-AGGCCACAGTCCACGTAGT-3′,下游引物序列:5′-GCTGTTGTTTAGGGACCTCTGG-3′;PP2A-B55-α上游引物序列:5′-CCACCTTTATCTCCTGTTGC-3′,下游引物序列:5′-TTTCTCAGGTGAAAGGAGCAG-3′;PP2A-B56-α上游引物序列:5′-CGGGATCCATGTCGTCGCCGTCGCCGC-3′,下游序列:5′-CCGCTCGAGTTATTTGGCACTGGTACTGCTGCG-3′;GAPDH上游序列:5′-GGTCACCAGGGCTGCTTTTA-3′,下游序列:5′-GGATCTCGCTCCTGGAAGATG-3′。PCR反应体系为20 μL,包括:10 μmol/L上、下引物各0.5 μL,2×SYBR Green Mix 10 μL,cDNA 2 μL,DEPC水7 μL。PCR循环参数:95 ℃预变性10 min;95 ℃ 2 s,60 ℃ 20 s,70 ℃ 10 s,共40个循环。利用StepOneTM软件于62 ℃时进行熔解曲线分析。以GAPDH为内参照,采用2-ΔΔCt法计算相对表达量,ΔΔCt =(实验组Ct目的基因-实验组Ct内参基因)-(对照组Ct目的基因-对照组Ct内参基因),每个样本设置3个复孔并取平均值。

2 结果
2.1利妥昔单抗耐药DLBCL细胞系鉴定结果 应用CCK-8法检测耐药细胞系的存活率结果表明,在0、2、10、50 和100 μg/mL的利妥昔单抗作用下,LY10及LY10RR细胞的IC50分别为(0.91±0.07) μg/mL和(287.40±26.30) μg/mL,耐药指数为315.58;LY18及LY18RR细胞的IC50分别为(4.73±0.24) μg/mL和(532.10±37.95) μg/mL,耐药指数为112.41,二者差异有统计学意义(t值分别为10.51和15.18,P均<0.001)。各细胞系细胞存活率结果见图1。
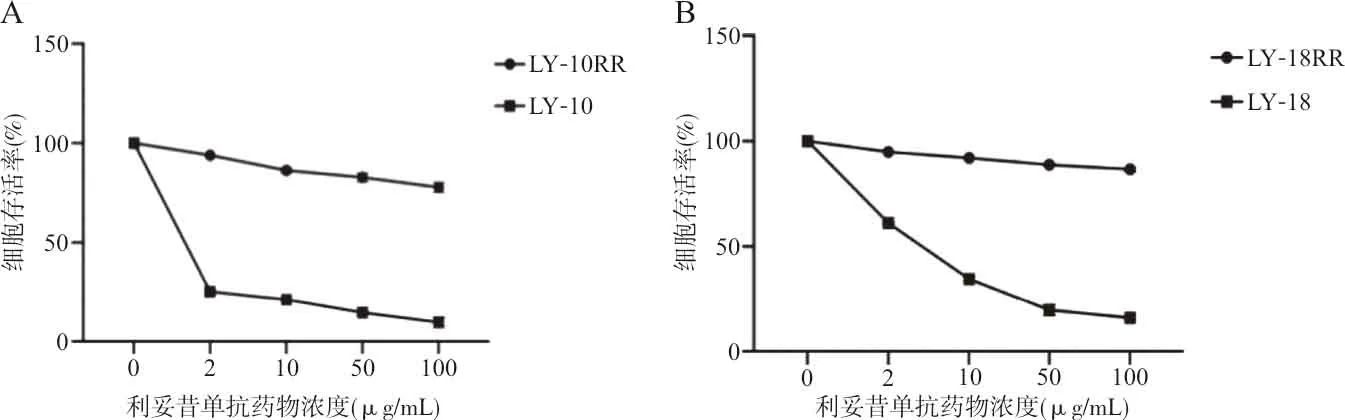
注:A,LY10及LY10RR细胞存活率;B,LY18及LY18RR细胞存活率。
2.2利妥昔单抗处理亲本与耐药细胞系的凋亡差异 50 μg/mL利妥昔单抗处理48 h后,LY10RR和LY18RR细胞的凋亡率分别为(7.28±1.25)%、 (6.41±1.46)%,与对照组LY10RR和LY18RR细胞的凋亡率分别为(4.94±0.79)%、(4.07±1.35)%相比,差异均无统计学意义(t值分别为2.86和2.90,P值分别为0.06和0.05),而利妥昔单抗处理48 h后,LY10和LY18细胞的凋亡率分别为(30.42±5.52)%、(26.46±2.34)%,与对照组LY10和LY18细胞的凋亡率分别为(4.09±0.73)%、(3.21±0.32)%相比,差异有统计学意义(t值分别为10.50和9.86,P均<0.001)。见图2。

注:A、B,LY10RR以及利妥昔单抗处理LY10RR 48 h后的凋亡比率;C、D,LY10以及利妥昔单抗处理LY10 48 h后的凋亡比率;E、F,LY18RR以及利妥昔单抗处理LY18RR 48 h后的凋亡比率;G、H,LY18以及利妥昔单抗处理LY18 48 h后的凋亡比率。
2.3western blot检测 Smarcal1、PP2A-B55-α及PP2A-B56-α蛋白在亲本与耐药 DLBCL 细胞系中的表达情况 结果显示,与亲本细胞相比,在发生利妥昔单抗耐药细胞系中,Smarcal1和PP2A-B55-α表达量均增加,PP2A-B56-α表达水平下降,且差异均具有统计学意义(P均<0.05)。见表1、图3。

表1 western blot检测Smarcal1、 PP2A-B55-α及PP2A-B56-α在亲本和耐药细胞系中的表达
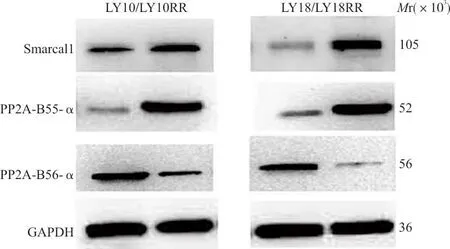
图3 western blot检测Smarcal1、PP2A-B55-α及PP2A-B56-α在亲本及耐药 DLBCL 细胞系中的表达
2.4RT-qPCR检测耐药细胞系sh-Smarcal1、sh-PP2A-B55-α及oe-PP2A-B56-α的转染效率 结果表明,相对于sh-NC组(均为1.00±1.00),sh-Smarcal1组LY10RR和LY18RR耐药细胞系中Smarcal1的表达水平均明显下调(分别为0.45±0.05、 0.41±0.07),差异均有统计学意义(t值分别为10.50、8.56,P均<0.01);sh-PP2A-B55-α组中PP2A-B55-α的表达水平均明显下调(分别为 0.51±0.05、0.45±0.06),差异均有统计学意义(t值分别为10.05、9.39,P均<0.01);相对于oe-vector组(均为 1.00±1.00),oe-PP2A-B56-α组中PP2A-B56-α的表达水平明显上调(分别为2.33±0.13、3.067±0.23),差异有统计学意义(t值分别为10.05、8.86,P均<0.01)。
2.5转染后耐药细胞对利妥昔单抗耐药性的影响 转染后的LY10RR和LY18RR在2、10、50 和100 μg/mL的利妥昔单抗刺激48 h后,经CCK-8法检测结果显示,sh-Smarcal1组的细胞活力明显低于sh-NC组(F值分别为226.9和67.1,P<0.01),sh-PP2A-B55-α组的细胞活力明显低于sh-NC组(F值分别为592.7和377.2,P<0.01),oe-PP2A-B56-α组的细胞活力明显低于oe-vector组(F值分别为734.5和219.9,P<0.01)。见表2、图4。
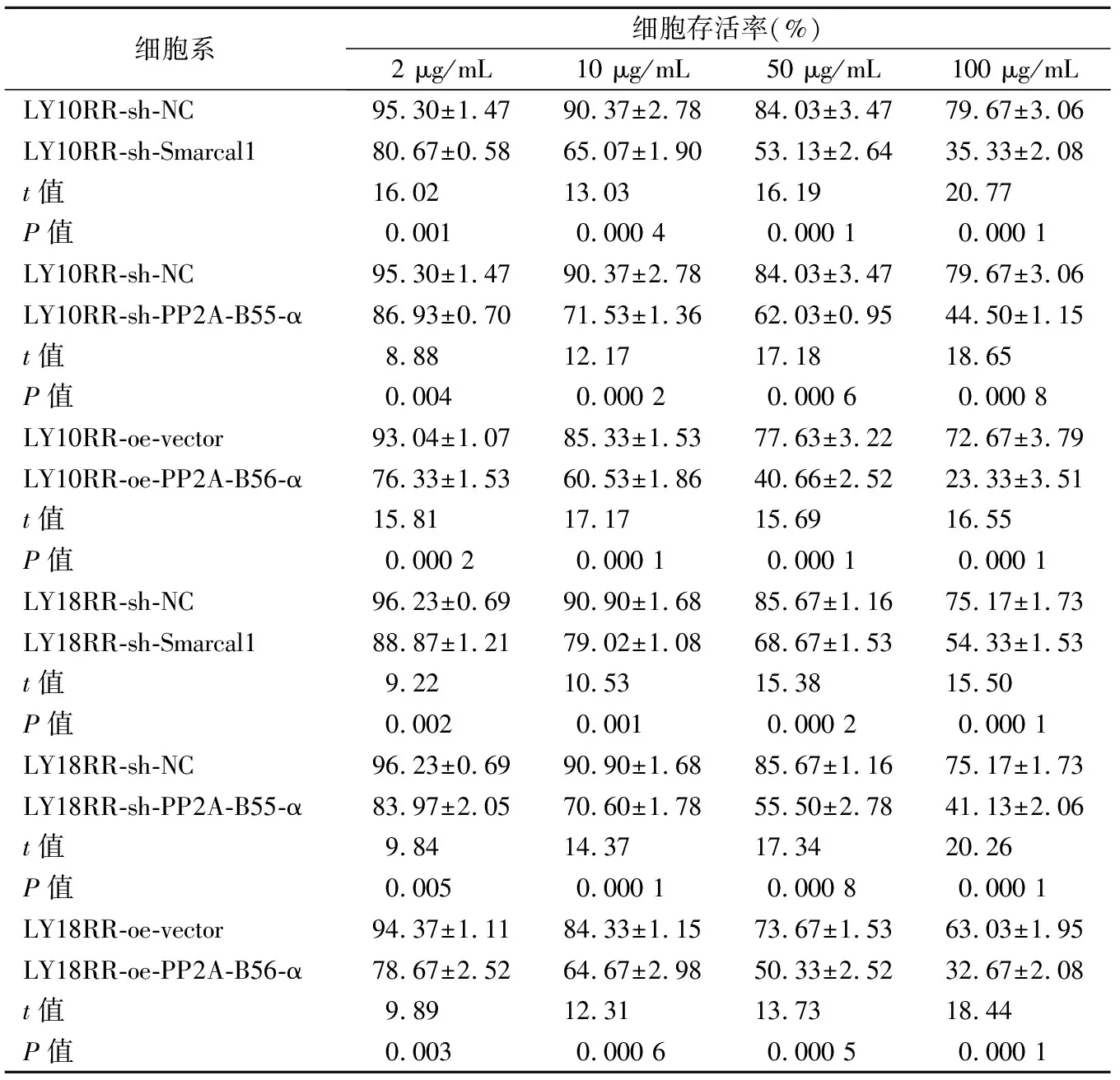
表2 CCK8法检测不同浓度利妥昔单抗处理不同细胞系的细胞存活率
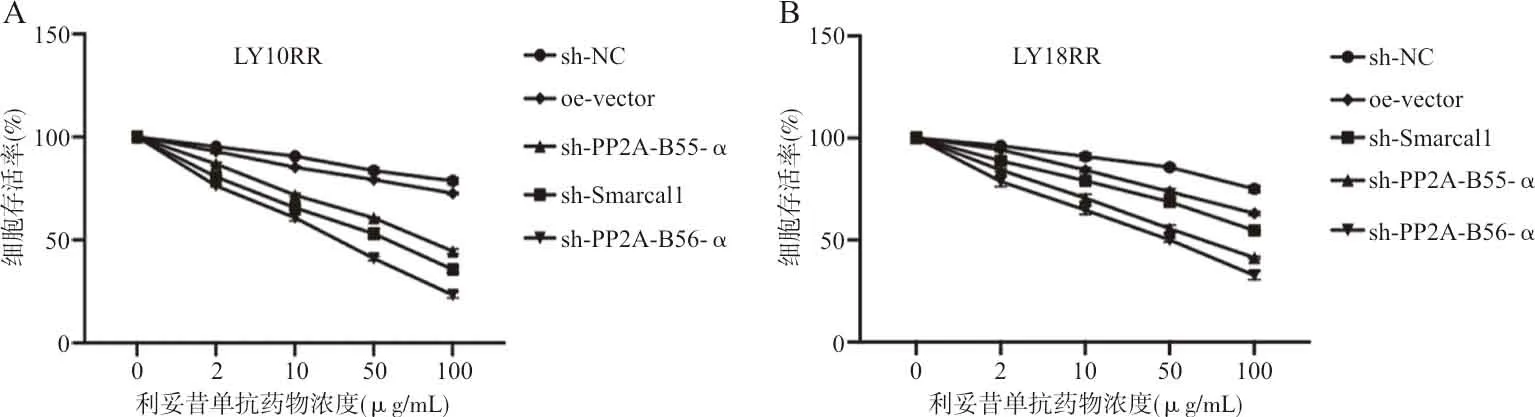
注:A,CCK-8法检测不同浓度利妥昔单抗对转染sh-Smarcal1、sh-PP2A-B55-α及oe-PP2A-B56-α后LY10RR细胞活力的影响;B,CCK-8法检测不同浓度利妥昔单抗对转染 sh-Smarcal1、sh-PP2A-B55-α及oe-PP2A-B56-α后LY18RR细胞活力的影响。
3 讨论
Puccetti等[4]通过持续调控MYC失调,产生慢性复制应激,从而诱导B细胞淋巴瘤形成,证实了Smarcal1的双等位基因失活可抑制肿瘤的进展,提示恶性肿瘤可能依赖于Smarcal1以稳定复制叉并完成复制。在本研究中,成功构建了稳定的利妥昔单抗耐药的“双重打击”淋巴瘤衍生细胞系LY10RR和LY18RR,并发现在耐药株中Smarcal1表达量明显增加;而进一步干扰Smarcal1表达后,发现利妥昔单抗对耐药细胞系的细胞毒作用均增强。这与Puccetti等[4]的研究结果较为一致,均证实抑制Smarcal1可延缓淋巴瘤形成。但本实验还进一步证实了Smarcal1与DLBCL治疗中利妥昔单抗耐药相关。
MYC基因和蛋白磷酸酶2A(protein phosphatase2A,PP2A)的失活是癌症中常见的2种类型,该2种蛋白质均为细胞增殖、凋亡和分化的重要调节因子,它们直接或间接调节彼此的生物活性。研究表明,针对MYC/PP2A通路是临床上可行的治疗策略[8]。PP2A的特定功能通常由其包含的特定调节亚基——B亚基控制。Leonard等[5]研究发现,DT-061(SMAP)可以特异性稳定B56α-PP2A全酶,使后者可选择性的对底物c-Myc等去磷酸化,从而诱导细胞死亡和抑制肿瘤生长。Zhang等[6]研究发现,Eya3可通过PP2A的B55-α亚基控制c-Myc基因的pT58位点发生去磷酸化,从而促进肿瘤的进展。在本研究中发现耐药株中PP2A-B55-α表达量增加以及PP2A-B56-α表达量下降;进一步在2株耐药细胞中分别干扰PP2A-B55-α和过表达PP2A-B56-α,发现利妥昔单抗对LY10RR和LY18RR的细胞毒作用均增强。本研究结果与Leonard等[5]和Zhang等[6]的研究结果类似,均证实了在弥漫大B细胞淋巴瘤中抑制PP2A-B55-α蛋白的表达或增强PP2A-B56-α蛋白表达会增强其对利妥昔单抗的敏感性。因此,笔者认为Smarcal1、PP2A-B55-α和PP2A-B56-α均可导致MYC基因失调,促进细胞的增殖,从而在利妥昔单抗耐药形成过程中发挥重要作用。然而,本研究仅检测上述3种蛋白质在利妥昔单抗耐药前后DLBCL细胞中的表达水平变化,对其下游的相互作用靶点尚未确定。今后还需要进一步深入的研究来阐明其在肿瘤发生、发展过程中的分子机制,以确认Smarcal1、PP2A-B55-α和PP2A-B56-α作为利妥昔单抗耐药DLBCL治疗和诊断靶点的潜能。

