血清胃泌素释放肽前体检测对小细胞肺癌诊断及预后的临床价值*
王莹,连丽丽,许建成
(吉林大学第一医院检验科,长春 130021)
小细胞肺癌(SCLC)是肺癌中侵袭性最强的亚型,约占肺癌的13%~17%[1]。由于早期症状不显著,约70%~75%的肺癌患者确诊时已处于晚期,其5年生存率仅为15%[2]。临床指南推荐采用4~6个周期的化疗或根据肿瘤分期联合放疗。然而,在接受有效治疗的某些肺癌患者中,影像学观察到其肿瘤体积变化并不显著,同时由于辐射暴露及高昂费用,导致无法及时发现复发和/或转移。因此,为优化疾病管理,临床上需要更灵敏的血清肿瘤标志物以监测SCLC对治疗的反应性并评估其预测价值。
神经元特异性烯醇化酶(NSE)被推荐为SCLC高度敏感和特异的肿瘤标志物[3]。胃泌素释放肽前体(pro-GRP)作为一种新的肿瘤标志物,其单独或联合NSE检测在SCLC诊断方面的作用引起学者们的广泛关注。然而,血清pro-GRP对SCLC疗效监测价值的研究报道少见。本研究拟探讨血清pro-GRP对SCLC诊断及预后的临床价值。
1 对象与方法
1.1研究对象 选取2018年1月至2021年1月吉林大学第一医院经病理组织学确诊为肺癌的2 584例患者,其中SCLC 132例,男77例,女55例,年龄38~80岁,中位年龄61岁;鳞癌患者1 323例,男609例,女714例,年龄20~79岁,中位年龄59岁;腺癌患者1 129例,男438例,女691例,年龄35~80岁,中位年龄61岁。SCLC纳入标准[4]:(1)支气管镜活检、CT引导下的针肺活检或手术切除标本等均经病理组织学确诊;(2)患者入院时未接受任何治疗;(3)治疗前检测血清NSE和pro-GRP水平;(4)整个化疗过程均在医院进行,至少随访4个月;每例患者每个时间点采集1份血清样本以分析NSE和pro-GRP水平。(5)肾功能相关指标肌酐、肌酐清除率、尿氮均在参考范围内。根据实体瘤1.1版疗效评价标准[5],治疗疗效分为有效组、稳定组和进展患者。化疗耐药定义为SCLC患者一线治疗后进展或复发。健康人对照组为同期在吉林大学第一医院体检健康者3 606例,男1 900例,女1 706例,年龄19~95岁,中位年龄51岁。肺良性病变组为经CT及临床明确诊断的肺占位性非恶性病变患者4 174例,男2 120例,女2 054例,年龄19~95岁,中位年龄61岁。本研究经吉林大学第一医院医学伦理委员会审核批准(No. 2019-249),患者及家属知情同意。
1.2仪器与试剂 血清pro-GRP、NSE、CEA、CYFAR21-1、SCC检测试剂盒及Cobas e601全自动电化学发光分析仪均购自瑞士Roche公司。
1.3标本采集和处理 所有研究对象均于治疗前采集空腹静脉血5 mL,3 000 r/min离心5 min,吸取上层血清进行检测。实验于2 h内完成。
1.4方法 血清pro-GRP、NSE、CEA、CYFAR21-1、SCC测定均采用电化学发光免疫分析法,按照Cobas e601全自动电化学发光分析仪及相应的检测试剂盒说明书操作及结果判读。参考区间:pro-GRP 28.3~65.7 pg/mL,NSE 0~18.3 ng/mL,CEA 0~5 ng/mL,CYFAR21-1 0~3.3 ng/mL,SCC 0~2.7 pg/mL。连续测量132例SCLC患者血清pro-GRP和NSE水平的变化,将第1个数据点设为基线水平,作为化疗开始前测量基础值。每个点对应1个化疗周期(共检测21 d)。

2 结果
2.1各组血清肿瘤标志物水平比较 与健康人对照组、肺良性病变组比较,肺癌组血清pro-GRP、NSE、CEA、CYFAR21-1、SCC水平均显著升高(P<0.05);此外,肺良性病变组血清pro-GRP、NSE、CEA、CYFAR21-1、SCC水平均显著高于健康人对照组。见表1。

表1 各组血清肿瘤标志物比较[M(P25,P75)]
2.2不同类型肺癌患者血清肿瘤标志物水平比较 SCLC组与NSCLC组比较,除 CYFAR21-1外,其余各指标间比较差异均有统计学意义(P均<0.05)。腺癌组与鳞癌组血清NSE水平差异无统计学意义(P>0.05)。pro-GRP在SCLC组中的表达水平显著高于NSCLC组(P<0.05)。见表2。

表2 不同类型肺癌患者血清肿瘤标志物水平比较[M(P25,P75)]
2.3血清pro-GRP和NSE与SCLC患者临床病理参数关系 随临床分期进展,pro-GRP和NSE的表达水平均显著升高,且广泛期SCLC中pro-GRP和NSE的表达水平明显高于局限期(P<0.05)。吸烟者pro-GRP和NSE的表达水平显著高于非吸烟者(P<0.05)。体重指数(BMI)>26组pro-GRP的表达水平均高于其他组(P<0.05)。pro-GRP和NSE水平在年龄、性别、肿瘤部位间的差异无统计学意义(P>0.05)。见表3。

表3 血清pro-GRP、NSE与SCLC患者临床病理参数关系[M(P25,P75)]
2.4ROC曲线评估各血清肿瘤标志物对SCLC的诊断价值 以NSCLC患者为对照组,SCLC患者为疾病组,ROC曲线分析结果表明,pro-GRP诊断SCLC的AUCROC(0.976)、敏感性(76.60%)及特异性(99.70%)均高于其他血清肿瘤标志物,5项肿瘤标志物联合检测诊断SCLC的敏感性、特异性、阳性预测值、阴性预测值、总有效率均明显升高。见图1及表4。

图1 5项肿瘤标志物联合诊断SCLC的ROC曲线

表4 各指标单独及联合诊断SCLC的结果
2.5SCLC组血清pro-GRP和NSE水平与预后的符合度分析 连续测量SCLC患者血清pro-GRP和NSE水平的变化,对化疗有反应者,在化疗第2个周期后血清pro-GRP水平显著低于基线水平(Z=-8.607,P<0.001)。对于稳定的患者,未观察到肿瘤标志物显著波动(Z=-0.221,P>0.05)。在耐药复发或进展的患者中,疾病进展伴随pro-GRP和NSE水平升高。对于治疗有反应者中,SCLC患者的pro-GRP水平下降幅度更为明显,对于耐药复发或进展的患者,pro-GRP水平升高时间比NSE明显提前。见图2。
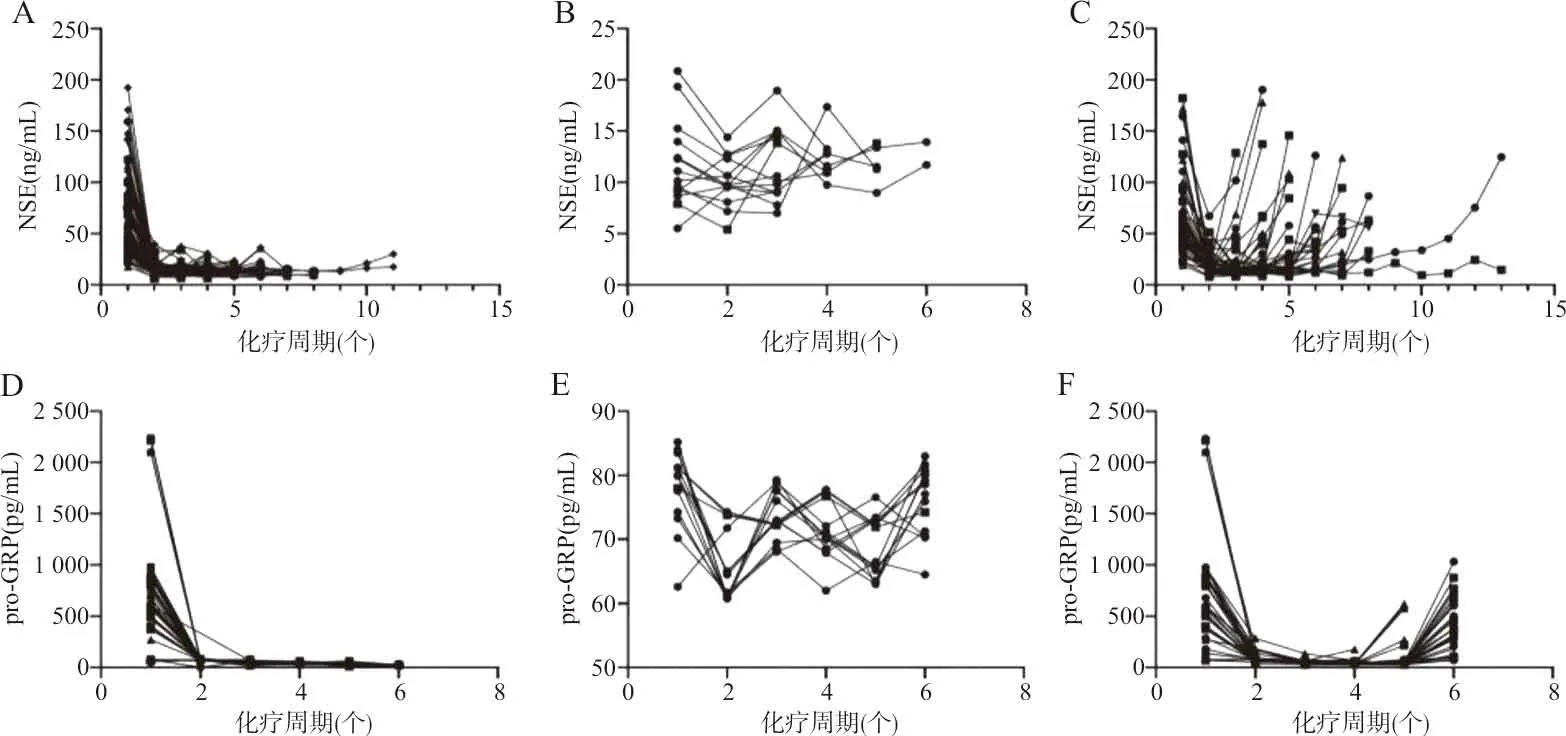
注:A、D对治疗有反应的患者(n=68);B、E疾病稳定的患者(n=14);C、F病进展的患者(n=50)。
3 讨论
SCLC呈异质性,且侵袭性强。目前临床上多应用中华医学会肺癌临床诊疗指南(2019 版)推荐的检测肺癌的5种血清标志物——pro-GRP、NSE、CEA、CYFAR21-1、SCC。本研究中SCLC组血清pro-GRP、NSE的表达水平显著升高,分析原因可能因为SCLC的主要特征是神经内分泌表型,具有胺前体摄取和脱羧系统的特性,可捕获脱羧儿茶酚胺及前体的羧基,从而促进抗利尿激素和促肾上腺皮质激素的合成,导致许多神经肽表达量增加[6-7]。本研究结果显示,NSCLC组中CYFAR21-1的表达水平升高,SCLC组和肺腺癌组中CEA的表达水平亦明显升高。此外,多项研究[8-9]证实,SCC在肺鳞状细胞癌患者血清中的表达水平升高,且对肺癌具有鉴别诊断作用,在临床上可辅助病理组织学诊断。
研究表明,肺癌患者的肿瘤分期为SCLC的独立预后因素[10]。本研究发现pro-GRP和NSE水平随临床分期的进展而表达水平升高。广泛期SCLC患者中pro-GRP和NSE的表达水平明显高于局限期(P<0.05)。有学者证实,pro-GRP参与肺神经内分泌肿瘤细胞的快速生长,可抑制癌细胞增殖并促进细胞凋亡[11-12],并可引起不同临床分期患者中pro-GRP表达水平的差异[13]。NSE作为糖酵解烯醇酶同工酶的一种,主要在神经元和神经内分泌细胞的细胞质中表达,尤其是在胺前体摄取和脱羧中(如垂体、甲状腺、胰腺、肠和肺)[14]。吸烟为SCLC的主要诱发因素,本研究发现吸烟者pro-GRP和NSE水平显著高于非吸烟者,与Chen等[15]和Tammemägi等[16]的研究结果相一致。
此外,本研究还发现,pro-GRP诊断SCLC的敏感性较高,5项肿瘤标志物联合检测可明显提高SCLC诊断的敏感性、特异性、阳性预测值、阴性预测值和总有效率。一项荟萃分析[17]结果证实,在7 268例SCLC患者中,血清ProGRP的诊断敏感性和特异性分别为75.4%和94.5%,AUCROC为0.910,均与本研究结果相类似。
研究表明,NSE水平可用于评估SCLC患者的预后[18]。pro-GRP作为SCLC潜在靶标[19],其动态监测可用于评估治疗效果。本研究拟验证pro-GRP水平变化是否可以评估SCLC化疗疗效,笔者通过连续测定132例SCLC患者的血清pro-GRP和NSE水平的变化,结果发现在对化疗有反应者中,血清pro-GRP和NSE水平明显下降。而对于耐药复发或进展的患者,pro-GRP水平升高时间比NSE水平变化提前,进一步证实了抑制pro-GRP可抑制细胞增殖,阻止细胞周期进程。
值得注意的是,本研究还发现少部分肺癌患者初诊时pro-GRP水平低于25 pg/mL,其他指标水平均在参考区间内,化疗后pro-GRP水平的变化较小,且多为微浸润性腺癌。然而,低表达pro-GRP水平是否与腺癌相关,仍需要进一步研究证实。

